糖络宁对糖尿病周围神经病变大鼠细胞凋亡相关通路的影响
2020-12-14陈枫郭宇鑫王利莹
陈枫 郭宇鑫 王利莹

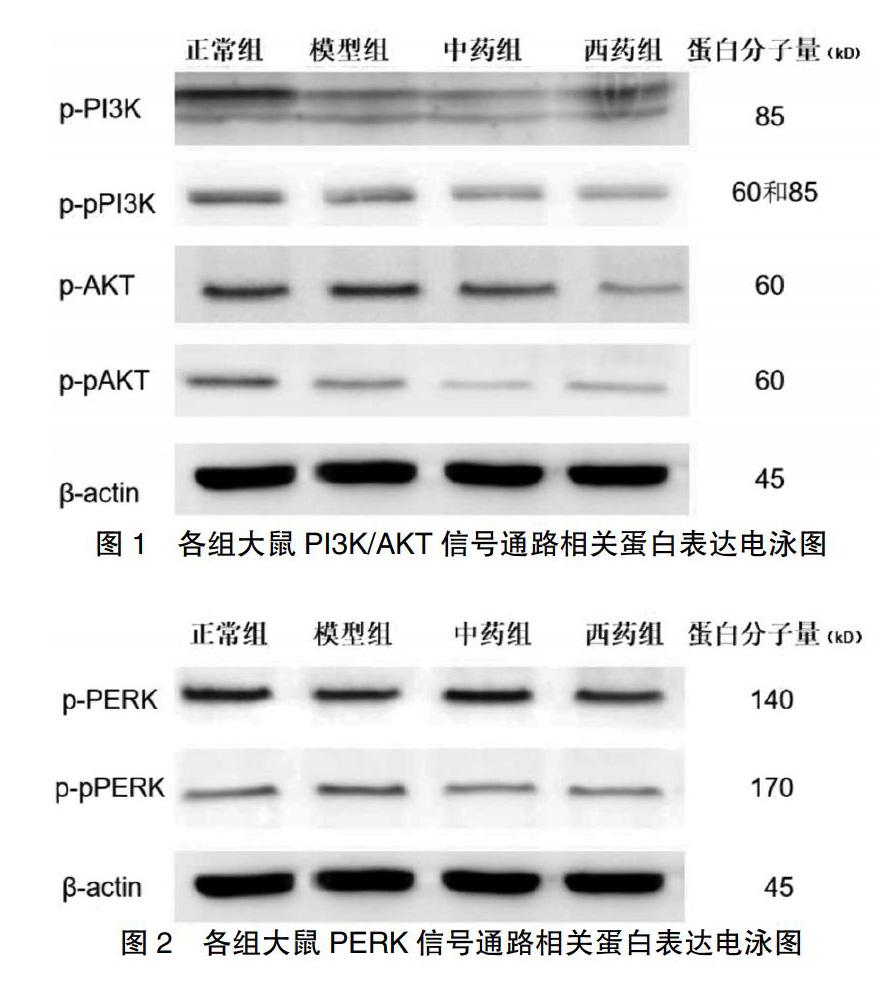
[摘要] 目的 觀察糖络宁对糖尿病周围神经病变(DPN)大鼠坐骨神经组织中PI3K/AKT及PERK信号传递通路的调节作用。 方法 选用8周龄的清洁级雄性SD大鼠80只,随机选择14只为正常组,其余66只通过一次性腹腔内注射链脲佐菌素60 mg/kg,诱导大鼠高血糖,建造DPN大鼠实验模型。将造模成功的61只大鼠采用随机数字表法分为模型对照组(模型组,21只)、糖络宁组(中药组,21只)、α-硫辛酸治疗组(西药组,19只)。中药组予糖络宁5 g/(kg·d)一次灌胃,西药组予α-硫辛酸20 mg/(kg·d)一次灌胃,模型组每天予等量蒸馏水灌胃,各组均连续用药8周。8周后通过Western blot检测坐骨神经中p-PI3K、p-pPI3K、p-AKT、p-pAKT、p-PERK、p-pPERK蛋白的表达。 结果 各组大鼠脊髓背根神经节(DRG)中p-PI3K、p-pPI3K、p-AKT、p-pAKT、p-PERK、p-pPERK蛋白表达比较,差异均有统计学意义(P < 0.05)。与正常组比较,模型组大鼠DRG中p-PI3K、p-pPI3K、p-AKT、p-pAKT蛋白表达显著降低(P < 0.01),p-PERK、p-pPERK蛋白表达显著升高(P < 0.01);与模型组比较,中药组、西药组大鼠DRG中p-PI3K、p-pPI3K、p-AKT、p-pAKT蛋白表达升高(P < 0.05),p-PERK、p-pPERK蛋白表达降低(P < 0.05)。 结论 糖络宁可通过激活PI3K/AKT和信号传递通路,抑制PERK信号传递通路,改善神经细胞凋亡状况,抑制神经损伤。
[关键词] 糖络宁;细胞凋亡;糖尿病周围神经病变;信号通路
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2020)10(b)-0021-04
[Abstract] Objective To observe the regulatory effect of Tangluoning on PI3K/AKT and PERK signaling pathway in sciatic nerve tissue of diabetic peripheral neuropathy (DPN) rats. Methods Eighty eight-week-old male SD rats of clean grade were selected. Fourteen rats were randomly selected as normal group. The other 66 rats were induced hyperglycemia by intraperitoneal injection of streptozotocin 60 mg/kg. Sixty-one rats were randomly divided into model control group (model group, 21 rats), Tangluoning group (traditional Chinese medicine group, 21 rats), α-lipoic acid treatment group (Western medicine group, 19 rats). Traditional Chinese medicine group was given Tangluoning 5 g/(kg·d), Western medicine group was given α-lipoic acid 20 mg/(kg·d) once a day. Model group was given the same amount of distilled water by gavage every day. All groups were treated for eight weeks. After eight weeks, the expression of p-PI3K, p-pPI3K, p-AKT, p-pAKT, p-PERK and p-pPERK protein in sciatic nerve was detected by Western blot. Results The expression of p-PI3K, p-pPI3K, p-AKT, p-pAKT, p-PERK and p-pPERK protein in dorsal root ganglion (DRG) of rats in each group had statistical significance (P < 0.05). Compared with normal group, the protein expressions of p-PI3K, p-pPI3K, p-AKT and p-pAKT in DRG of model group were significantly decreased (P < 0.01), and the protein expressions of p-PERK and p-pPERK were significantly increased (P < 0.01). Compared with model group, the protein expressions of p-PI3K, p-pPI3K, p-AKT and p-pAKT in the DRG of Chinese medicine group and Western medicine group were increased (P < 0.05), and the protein expressions of p-PERK and p-pPERK were decreased (P < 0.05). Conclusion Tangluoning can regulate PI3K/AKT and PERK signaling pathway so as to inhibiting apoptosis and avoid nerve injury.
[Key words] Tangluoning; Apoptosis; Diabetic peripheral neuropathy; Signaling pathway
我国2型糖尿病发病率逐年上升,目前患病率已达10.4%,糖尿病周围神经病变(DPN)是其最常见的慢性并发症之一[1],其患病率可达50%以上[2]。DPN会导致慢性疼痛、感觉丧失、足部溃疡和最终截肢[3]。糖尿病性神经病的病因之一可能是感觉神经元和雪旺细胞发生凋亡,甚至死亡[4],但DPN病因机制更为复杂,免疫机制、遗传基因机制等均与DPN的发病有关[5]。临床研究表明,糖络宁对DPN的治疗效果明显[6-7],但其作用机制尚待研究。本研究通过观察糖络宁对DPN大鼠坐骨神经中的PI3K/AKT及PERK信号通路表达的影响,探讨其治疗DPN的作用机制。
1 对象与方法
1.1 实验动物
清洁级雄性8周龄大鼠SD大鼠80只,体重(225±25)g,合格证书编号:SCXK(京)2012-0001,由中国北京维通利华实验动物技术有限公司提供。购入后于北京中医药大学动物实验中心饲养,实验室条件:国标GB14925-2001规定动物实验设施大鼠SPF级屏障环境[环境安全合格证号:SYXK(京)2011-0024],实验中心温度(20±2)℃,湿度45%~65%,12 h明暗交替照明。实验前大鼠适应性喂养2周。实验程序由北京中医药大学东方医院医学伦理委员会论证通过。
1.2 药物与试剂
链脲佐菌素(美国Merck公司,批号:B69776);α-硫辛酸(批号:82159-09-9),兔抗大鼠ART多克隆抗体(货号:4685),兔抗大鼠磷酸化ART(p-pART)多克隆抗体(货号:4060),兔抗大鼠PI3 Kinase p85(Tyr458)/p55(Tyr199)多克隆抗体(货号:4257),兔抗大鼠磷酸化PI3 Kinase p85(Tyr458)/p55(Tyr199)(货号:4228),兔抗大鼠细胞PERK多克隆抗体(货号:3192),兔抗大鼠磷酸化PERK单克隆抗体(货号:3179),以上试剂均购自美国CST公司;糖络宁制剂(北京中医药大学东方医院制剂室自制,约为生药10 g/mL,方药组成:牛膝、丹参、生黄芪、全蝎、狗脊等)。
1.3 造模、分组与给药方式
参照既往研究[6-9]进行造模、分组及给药等处理。选用8周雄性SD大鼠80只,造模前随机选择14只为正常组,剩余66只予链脲佐菌素60 mg/kg进行腹腔注射,72 h后随机测定其血糖≥16.7 mmol/L则造模成功。将成模大鼠61只采用随机数字表法分为三组:西药组(19只)、中药组(21只)、模型组(21只)。中药组每只大鼠给予糖络宁制剂5 g/(kg·d)进行灌胃;西药组将2.5 mg/mL α-硫辛酸用等量蒸馏水调配,每只大鼠予20 mg/(kg·d)进行灌胃;模型组予等量蒸馏水进行灌胃。连续给药8周。实验期间大鼠自由饮食。因大鼠死亡,模型组、西药组、中药组最终剩余大鼠数量分别为17、18、18只。由于神经组织取材困难,故在实验结束时统一进行取材。
1.4 脊髓背根神经节(DRG)神经组织取材及线粒体提取
DRG神经组织取材均参照既往研究[6-9],最终提取样本放进-80℃冰箱备用。
1.5 Western blot检测PI3K、AKT、PERK的表达
于-80℃冰箱中提取DRG神经组织,冰浴下组织匀浆,提取蛋白,按BCA法定量,保证每个样品的蛋白量。每个样品蛋白量均为40 μg。进行制胶与上样后进行电泳与转模。按浓缩胶80 V、分离胶120 V进行恒压电泳,按300 mA恒流转膜电泳,持续时间根据目的蛋白分子量进行调整。于室温封闭液中加入已经转膜完成的膜,封闭1 h,再加入已溶液稀释好的一抗(以1000∶1比例混合5%BSA与兔抗p-PI3K、p-pPI3K、p-AKT、p-pAKT、p-PERK、p-pPERK)4℃过夜,之后用TBST清洗5 min,共3次,加入稀释好的二抗(以比例10 000∶1混合5%脱脂牛奶与山羊抗兔第二抗体),室温下静置30 min后,在摇床上用TBST清洗5 min,共4次。操作完成后,将其在暗室中曝光,扫描胶片图像,进行存档。对胶片目标带通过Alpha Ease FC 4.0进行分析,检测吸光度值。
1.6 统计学方法
采用SPSS 20.0统计软件处理数据,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t、SNK-q检验,以P < 0.05为差异有统计学意义。
2 结果
各组大鼠DRG中p-PI3K、p-pPI3K、p-AKT、p-pAKT、p-PERK、p-pPERK蛋白表达比较,差异均有统计学意义(P < 0.05)。与正常组比较,模型组大鼠DRG中p-PI3K、p-pPI3K、p-AKT、p-pAKT蛋白表达显著降低(P < 0.01),p-PERK、p-pPERK蛋白表达显著升高(P < 0.01);与模型组比较,中药组、西药组大鼠DRG中p-PI3K、p-pPI3K、p-AKT、p-pAKT蛋白表达升高(P < 0.05),p-PERK、p-pPERK蛋白表达降低(P < 0.05)。见表1、图1~2。
3 讨论
中医学方面虽无糖尿病周围神经病这一病名,但其表现手足麻木、腿膝肌肉枯细、肢体酸软痿痹等临床症状与现代中医“痹证”“痿证”相似。因继发于消渴病,因此有人称之为消渴病、痹病。也有研究从经络学说角度论述本病,提出益气补肾、化瘀活血通络的基本治法[10]。在临床治疗上,应针对本病“氣阴两虚,血脉不畅,气滞血瘀,络脉瘀阻”的临床病理变化特点,以“益气养阴,化瘀通络”为治则。中药糖络宁由牛膝、丹参、生黄芪、全蝎、狗脊等药组成,全方益气养阴而使血脉畅达,通痹活血止痛而无破血伤阴。十余年来,糖洛宁在临床上治疗DNP的效果确切,然而其作用机制尚待研究。糖络宁有改善线粒体抗氧化剂的活性作用[7],可明显抑制神经细胞线粒体DNA的过度表达,对神经细胞凋亡状况有较好的改善和治疗效果。
研究发现,周围神经细胞的凋亡是DPN的重要发病原因之一[10-11]。神经细胞受损后发生凋亡的机制涉及众多途径,PI3K/AKT信号通路是其中之一[12]。PI3K/AKT信号通路参与体内糖代谢的调控,是高血糖和细胞凋亡的一个细胞内靶点[13-14]。胰岛素样生长因子-1的激活诱导PI3K/AKT途径磷酸化和促进抗凋亡蛋白、增殖细胞核抗原和细胞周期蛋白表达,可能促进雪旺细胞增殖和神经再生,有助于修复受损的周围神经[15]。DPN的发病机制绝非单一,內质网应激所诱导神经细胞凋亡是DPN发病的重要机制之一[16-18]。有研究[19-21]表明,DPN的发生可能与内质网应激分子PERK有关。PERK是一种跨膜糖蛋白,为ER特有。未折叠或折叠错误的蛋白会诱导PERK表达升高和促磷酸化,从而抑制鸟嘌呤eIF2β,使其从活性GTP结合的形式还原为eIF2,促使mRNA翻译停止[22]。PERK的表达升高和促磷酸化还促进C/EBP同源蛋白的表达,同时还可激动死亡蛋白酶caspase-12,从而使细胞凋亡速度加快,导致DPN的发生。
总之,持续的高血糖状态会抑制PI3K/AKT信号传递通路和激活PERK通路,加速细胞凋亡,最终造成神经损伤。作为一个临床效果显著的中药复方,糖络宁可以促进PI3K/AKT信号传递通路和抑制PERK通路,抑制细胞凋亡,改善神经细胞损伤,这可能是糖络宁治疗DPN的机制之一。
[参考文献]
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[2] Finnerup NB,Attal N,Haroutounian S,et al. Pharmacotherapy for neuropathic pain in adults:a systematic review and meta-nalysis [J]. Lancet Neurol,2015,14(2):162-173.
[3] Ozaki K,Terayama Y, Matsuura T,et al. Effect of combined dyslipidemia and hyperglycemia on diabetic peripheral neuropathy in alloxan induced diabetic WBN/Kob rats [J]. J Toxicol Pathol,2018,31(2):125-133.
[4] Cinci L,Corti F,Di Cesare Mannelli L,et al. Oxidative,metabolic,and apoptotic responses of Schwann cells to high glucose levels [J]. J Biochem Mol Toxicol,2015,29(6):274-279.
[5] 黄海伦,吴珊.糖尿病周围神经病相关发病机制研究进展[J].中华脑科疾病与康复杂志,2019,9(3):176-180.
[6] 张涛静,龚燕冰,周晖,等.糖络宁对STZ诱导糖尿病大鼠背根神经节线粒体呼吸链复合物的影响[J].北京中医药,2013,32(8):621-624.
[7] 张涛静,龚燕冰,周晖,等.糖络宁对STZ诱导糖尿病大鼠背根神经节线粒体抗氧化剂活性的影响[J].疑难病杂志,2015,14(2):179-181.
[8] 张涛静,高彦彬,龚燕冰,等.糖络宁对糖尿病大鼠背根神经节线粒体DNA及电镜下线粒体结构的影响[J].中国医药导报,2016,13(11):4-8.
[9] 郭宇鑫,王利莹,李逸潇,等.糖络宁对糖尿病大鼠周围神经病变氧化应激相关通路的影响[J].北京中医药大学学报,2018,37(11):1018-1021.
[10] El-Horany HE,Watany MM,Hagag RY,et al. Expression of LRP1 and CHOP genes associated with peripheral neuropathy in type 2 diabetes mellitus:correlations with nerve conduction studies [J]. Gene,2019,702:114-122.
[11] Sadeghiyan Galeshkalami N,Abdollahi M,Najafi R,et al. Alpha-lipoic acid and coenzyme Q10 combination ameliorates experimental diabetic neuropathy by modulating oxidative stress and apoptosis [J]. Life Sci,2019,216:101-110.
[12] Chang Y,Huang W,Sun Q,et al. MicroRNA-634 alters nerve apoptosis via the PI3K/Akt pathway in cerebral infarction [J]. Int J Mol Med,2018,42(4):2145-2154.
[13] Dong P,Zhang X,Zhao J,et al. Anti-microRNA-132 causes sevofluraneinduced neuronal apoptosis via the P13K/AKT/FOX03a pathway [J]. Int J Mol Med,2018,42(6):3238-3246.
