TAT-SOD脂质体对UC模型大鼠的口服治疗作用
2020-12-13周建森周秋婷林春通刘航琪刘树滔
周建森, 周秋婷, 叶 芬, 林春通, 刘航琪, 刘树滔
(福州大学 生物工程研究所,福建 福州350002)
溃疡性结肠炎(UC)是结肠的一种慢性特发性炎症性肠病[1]。UC的发病机制很复杂,目前尚不明确。越来越多的证据表明,活性氧(ROS)在UC的发生和发展中起着至关重要的作用。ROS是一类含氧元素、具有高活性的小分子物质,主要包括·O2-、H2O2和·OH-。ROS是体内正常氧代谢的中间代谢产物,主要由线粒体呼吸链和NADPH氧化酶系统生成[2]。在正常情况下,机体的ROS和抗氧化水平处于一个动态平衡,并维持细胞和组织的正常功能。但是,当ROS超出平衡时,过量的ROS会造成生物分子(如磷脂、蛋白质、核酸)的氧化损伤,导致组织和细胞的结构和功能异常[3-4]。过量的ROS可以通过补充外源性的抗氧化剂来去除。
已有报道,多种抗氧化剂被应用于治疗UC。例如,口服N-乙酰半胱氨酸(NAC)[5]、天然植物提取的多酚类化合物[6]等均可以改善UC动物模型结肠中的抗氧化状态,减轻结肠炎症。但是,这些抗氧化剂都是非特异性,可能有副作用,如引起恶心、呕吐,甚至导致肾脏损伤等等[7-9]。
超氧化物歧化酶(SOD)是机体内源性自由基清除剂中重要的酶类抗氧化剂,也可望用于治疗UC。它可以催化两个超氧化物阴离子之间发生歧化反应,生成对人体伤害较低的过氧化氢和氧气,其中的过氧化氢可以在过氧化物酶的作用下转化成对人体完全无害的H2O和O2[10]。补充SOD传统的方式是注射给药。例如,静脉注射人工合成的卵磷脂化的SOD可以降低UC小鼠的结肠损伤,但是其合成所用的交联剂是否存在副作用仍存在疑问[11]。口服补充SOD是更加安全、方便的给药方式,但是需要解决胃肠道消化使其失活的问题。已有一些口服SOD治疗UC的研究。例如,虫胶包被的SOD[12]、超稳定的SOD[13]均可抵抗胃肠道的消化并减轻UC小鼠的炎症。前期研究发现,TAT-SOD是富含碱性氨基酸的TAT短肽与SOD的融合蛋白,它比SOD稳定并具有更好的细胞粘附性[14],这种生物粘附性可能会增强SOD与小肠上皮的黏附,从而延长SOD与肠道的结合。另外,脂质体包埋可保护药物免受酸性条件下胃蛋白酶的破坏[15],可以提高SOD在肠道的生物利用度。作者尝试探究TAT转导肽修饰和脂质体包埋的SOD对UC模型大鼠的口服治疗作用,以期为UC的辅助治疗提供新的选择。
1 材料与方法
1.1 实验材料
TAT-SOD发酵液冻干粉:福州大学生物工程研究所提供;无水乙醇(分析纯)、胆固醇(分析纯)、胃蛋白酶(分析纯):国药集团化学试剂有限公司产品;大孔树脂HPD500:沧州宝恩吸附材料科技有限公司产品;SOD:天津生命科学应用研究所产品;胰酶(分析纯):美国Amersco公司产品;大豆卵磷脂(分析纯):萨思化学技术(上海)有限公司产品;葡聚糖硫酸钠(DSS):MPBiomedicals公司产品;BCA蛋白浓度测定试剂盒:上海碧云天生物技术有限公司产品;TritonX-114:美国Sigma公司产品;细菌内毒素检测试剂盒:福州新北生化工业有限公司产品;SD大鼠:上海禹堃实验动物有限公司产品;大鼠血清脂多糖(LPS)检测试剂盒:江苏酶标生物科技有限公司产品。
1.2 实验方法
1.2.1 发酵液中的TAT-SOD的乙醇沉降 称取发酵液冻干粉状20 g溶解于100 mL蒸馏水中,充分溶解发酵液。分取5 mL发酵液上清置于离心管中,调整无水乙醇的添加量,使无水乙醇最终体积分数为70%。充分混匀后于-20℃下静置30 min。4℃条件下,以13 000 r/min离心10 min,收集沉淀溶于5 mL SOD酶活力测定用PBS中,使用盐酸羟胺法测定SOD酶活力[17]。使用BCA蛋白质浓度测定试剂盒检测蛋白质含量,具体步骤见试剂盒说明书[16]。
1.2.2 大孔树脂纯化TAT-SOD经过乙醇沉淀重溶的样品在4℃下以12 000 r/min离心10 min,取复溶液过大孔树脂柱,并用0.5 mol/L NaCl溶液进行洗脱,流量为0.6 mL/min,每管5 min,测定在280 nm吸光值,得到除去大部分色素的样品。测定在400 nm及490 nm波长的吸光值,通过吸光值的变化,表征发酵液的脱色率[18]。
1.2.3 TritonX-114相分离法去除细菌内毒素 收集以上所得TAT-SOD溶液与Triton X-114以体积比99∶1混合;于4℃下、800 r/min条件下搅拌30 min;将样品转移至37℃水浴10 min;经25℃、13 000g离心10 min,并取上层水相;以上各步至少循环2次;收集上层的TAT-SOD溶液,使用细菌内毒素检测试剂盒检测其中的内毒素含量,具体步骤见试剂盒说明书[20]。
1.2.4 TAT-SOD脂质体的制备 将以上去除内毒素的TAT-SOD溶液,通过逆相蒸发法,包埋于脂质体。将大豆卵磷脂和胆固醇以质量比2∶1加入到装有30 mL乙醚的茄型瓶中充分溶解;再将溶有适量TAT-SOD的磷酸盐缓冲溶液(pH 7.4)10 mL加入到有机相中,经常温水浴超声(100 W)5 min;超声形成的乳液经抽真空旋转蒸发(40℃水浴)充分去除有机相,最终得到TAT-SOD脂质体(L-TATSOD)[21]。
1.2.5 TAT-SOD脂质体在模拟消化液中的降解情况 将TAT-SOD脂质体分别与模拟胃液(SGF)和模拟肠液(SIF)以体积比1∶3混合,于37℃水浴240 min,并分别检测0,15,30,60,120,240 min时 的SOD酶活力[22]。
1.2.6 动物实验 选取SD雄性大鼠30只,初始体质量(220±15)g,随机分成5组,每组6只,分别为模型组、正常组、L-TAT-SOD组、L-SOD组(SOD脂质体组)和TAT-SOD组。造模期间,正常组自由饮用灭菌水,其余组大鼠连续7 d自由饮用3.0 g/dL葡聚糖硫酸钠(DSS)溶液,构建急性结肠炎模型鼠[23]。造模成功后,分别给予每只大鼠10 000 U/kg的SOD剂量,灌胃给药。实验分组如下:正常组,全程饮用不含DSS灭菌水+灌胃生理盐水;L-SOD组,全程饮用含3.0 g/dL DSS灭菌水+灌胃L-SOD;TAT-SOD组,全程饮用含3.0 g/dL DSS灭菌水+灌胃TAT-SOD;L-TAT-SOD组,全程饮用含3.0 g/dL DSS灭菌水+灌胃L-TAT-SOD。
1.2.7 结肠损伤评价(DAI评分) 通过疾病活动指数(DAI)评价大鼠的结肠损伤情况:每天记录大鼠体质量、排便情况,评分后取平均值得出结肠炎模型大鼠DAI评分以及其变化趋势[24]。

表1 DAI评分Table 1 DAI score
1.2.8 结肠密度的测定 给药7 d后,解剖大鼠腹腔,找到结肠,测定结肠密度[25]。
1.2.9 结肠组织的HE染色 取大鼠结肠组织做固定、脱水、石蜡包埋、切片、HE染色,再于显微镜下观察[26]。
1.2.10 血清中酶活和LPS的测定 从小鼠腹主动脉取血并按照盐酸羟胺法测血清中酶活。用试剂盒测定血清中的LPS含量,具体步骤见试剂盒说明书。
1.3 数据处理方法
用SPSS 24对数据进行统计分析,P<0.05表示差异显著,记为“*”。
2 结果与分析
2.1 TAT-SOD的制备
发酵液经过乙醇沉淀、大孔树脂分离、TritonX-114相分离,并检测其酶活、蛋白质质量分数、脱色率和细菌内毒素等。酶活回收率最终为57.93%,脱色率为94.72%,细菌内毒素由5.6×10-3EU/U降为0.4×10-3EU/U,远低于人体给药的SOD的内毒素限度(5.0×10-3EU/U),去除率为99.30%[26]。
2.2 TAT-SOD脂质体的制备
相比于TAT-SOD,制备样品能形成纳米颗粒,且其平均粒径为(261.9±1.664)nm,说明已经成功制备TAT-SOD脂质体(L-TAT-SOD);其平均电位为(-41.3±4.40)mV≤-30 mV,具有较高的稳定性;其PDI为0.226±0.020。数据表明,已经成功制备L-TAT-SOD,且具有较高的稳定性,结果见图1。

图1 L-TAT-SOD的粒径、电位Fig.1 Particle size and Zeta potential distribution of L-TAT-SOD
2.3 L-TAT-SOD在体外模拟人工胃液(SGF)、人工肠液(SIF)的酶活回收率
如图2所示,在SGF的作用下,SOD和TATSOD的酶活迅速降低,15 min后几乎失活;脂质体包埋的L-SOD、L-TAT-SOD的酶活损失则比较少,240 min后稳定于85%左右。这些说明,在模拟胃液中,脂质体包埋能有效保护SOD的活性,TAT转导肽的修饰对SOD活性的保护没影响。
如图3所示,在SIF的作用下,不同SOD样品的酶活都有小幅度的下降,240 min后稳定于90%左右,其酶活保留率顺序为:L-TAT-SOD>L-SOD>TAT-SOD>SOD。这些说明,在模拟肠液中,脂质体包埋和TAT转导肽的修饰都能一定程度地保护SOD的活性,且两者对SOD的协同保护更加明显。

图2 不同SOD在SGF中的酶活回收率Fig.2 Enzyme activity recovery of different SOD in SGF

图3 不同SOD在SIF中的酶活回收率Fig.3 Enzyme activity recoveryof different SOD in SIF
2.4 L-TAT-SOD对UC大鼠模型的DAI评分的影响
DAI评分越高,表明结肠损伤程度越高,正常生理状况的DAI评分为0。如图4所示,经过灌胃给药7天的过程中,与模型组相比,L-TAT-SOD、L-SOD、TAT-SOD组的DAI评分都呈现显著性降低(P<0.05),且呈现持续下降的趋势。最终,L-TAT-SOD、L-SOD、TAT-SOD组的DAI评分分别降低了(71.37±8.97)%、(69.33±6.15)%、(66.67±7.26)%。不同SOD组别之间,L-TAT-SOD组的DAI评分在第1、2、3天显著性低于TAT-SOD组(P<0.05),在第4、5、6、7天无显著性差异。而L-TAT-SOD组与LSOD组之间、L-SOD组与TAT-SOD组之间的差异性较低,但存在一定趋势。这些部分组别之间存在无显著性差异的情况,可能是动物实验误差范围较大造成的,这有待实验验证。
这些数据表明,从趋势以及DAI评分的降低情况来看,治疗效果:L-TAT-SOD>L-SOD>TAT-SOD,其中L-TAT-SOD的效果最好。

图4 不同SOD对DAI评分的影响Fig.4 Effect of different SOD on DAI score
2.5 L-TAT-SOD对UC大鼠模型的结肠密度的影响
结肠受损后,易纤维化致使密度变大[27]。因此,可以通过测定结肠密度来评估结肠组织的受损情况。如图5所示:L-TAT-SOD组(0.086±0.012)、LSOD组(0.093±0.014)、TAT-SOD组(0.092±0.016)和与模型组(0.121±0.020)相比,其结肠密度测量值均显著(P<0.05)低于模型组(0.121±0.020),与正常组(0.088±0.004)相比,无显著性差异。表明L-TATSOD、L-SOD、TAT-SOD对DSS诱导的结肠炎症均有较好的治疗效果,且L-TAT-SOD的效果最好,最接近正常组。

图5 不同SOD对结肠密度的影响Fig.5 Effect of different SOD on colon density
2.6 结肠组织切片染色观察
如图6所示,TAT-SOD组、L-SOD组、L-TATSOD组结肠组织表现较为相似,与模型组相比,其隐窝结构正常、杯状细胞正常、黏膜下层仅有少量炎性细胞浸润。表明TAT-SOD、L-SOD、L-TATSOD对DSS诱导的结肠炎屏障损伤有明显的修复作用。
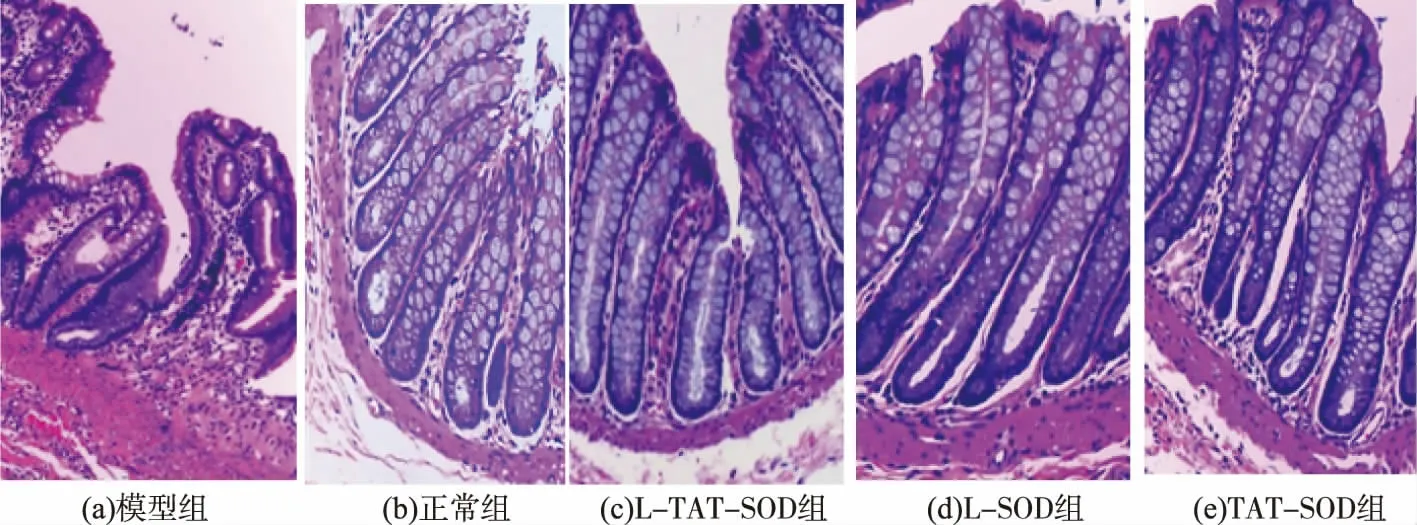
图6 不同SOD对结肠组织的影响(HE,×100)Fig.6 Effects of different SOD on colonic tissue(HE,×100)
2.7 L-TAT-SOD对UC大鼠模型的血清中SOD酶活的影响
通过测定用药对UC模型大鼠的血清中的SOD酶活的影响,来评估其对机体的抗氧化水平的调节情况。如图7所示,模型组与正常组相比,其血清酶活均显著(P<0.05)低于正常组。表明DSS诱导的结肠炎症的产生,伴随着机体的抗氧化酶水平的下降。而L-TAT-SOD组、L-SOD组和TAT-SOD组的血清酶活均显著(P<0.05)高于模型组和正常组。而L-TAT-SOD组的血清酶活显著(P<0.05)高于LSOD组、TAT-SOD组。这些结果表明:L-TAT-SOD、L-SOD、TAT-SOD均能通过口服灌胃来提高血清的SOD酶活,增强机体的抗氧化能力;而且,L-TATSOD的改善效果要优于L-SOD和TAT-SOD。根据模型组大鼠血清SOD酶活显著低于正常组的数据,推测3种SOD样品可能是通过改善UC状况,从而提高血清酶活。

图7 不同SOD对血清SOD酶活的影响Fig.7 Effect of different SOD on SOD enzyme activity in serum
2.8 L-TAT-SOD、TAT-SOD、L-SOD对UC大鼠模型的血清中LPS质量浓度的影响
UC模型大鼠肠道菌群产生的脂多糖(LPS)相比正常的大鼠更容易通过损伤的肠道屏障进入血液[28]。通过测定血清中LPS含量可评估肠道损伤情况,结果如图8所示,血清中LPS含量却无显著性差异。LPS主要来源于革兰氏阴性菌的细胞壁[29],而ROS本身也具有抗革兰氏阴性菌的活性[30],由此推测,这可能是UC大鼠肠道中含有丰富的ROS,抑制了革兰氏阴性菌的生长,从而使得肠道中可产生LPS的革兰氏阴性菌的数量减少。UC大鼠的肠道屏障虽然受到破坏,受损的肠道更容易受到细菌的感染,但是ROS可能会造成肠道菌群整体数量下降,从而导致所测的LPS表观上并无显著性差异。
3 结语
近年来,SOD作为特异性的抗氧化剂来治疗溃疡性结肠炎,受到越来越多关注[12-13]。SOD作为酶类抗氧化剂,可反复利用,能高效清除多余的ROS,有很大的应用潜力和市场需求。尽管SOD来源较广,可从动植物中提取得到,但是,其提纯的步骤较为复杂[31]。作者通过基因工程菌表达的SOD,更容易获得,提纯工艺也更为简单[32]。TAT-SOD发酵冻干粉仅通过乙醇沉淀、大孔树脂吸附、TritonX-114等步骤,就去除了大部分色素和细菌内毒素,获得了高比活(11 003 U/mg)的TAT-SOD;与天然SOD相比,TAT-SOD添加了富含碱性氨基酸的短肽TAT,提高了其对细胞表面的黏附能力[14],这为SOD应用于UC模型大鼠治疗提供了良好的基础。
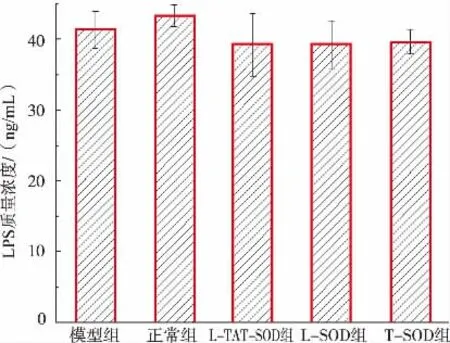
图8 不同SOD对血清LPS质量浓度的影响Fig.8 Effect of different SOD on LPS content in serum
天然SOD本身存在相对分子质量大、传递时难透过细胞膜、半衰期短、难耐酸、容易被胃蛋白酶降解等缺点,限制了其临床应用。前人用卵磷脂化和季铵化壳聚糖等化学修饰的方法,显著提高其静脉注射后SOD在血液中的半衰期,但是,静脉注射给药方式的舒适度有待提高[11]。利用脂质体包埋TATSOD,在体外模拟消化液降解的试验中,能够保护80%以上的TAT-SOD活性免受胃液环境的破坏,达到口服给药的要求,进一步提高了UC模型大鼠治疗时的生活质量评分(QOL)。
作者通过葡聚糖硫酸钠(DSS)诱发的大鼠结肠炎模型来评估TAT-SOD及L-TAT-SOD的治疗效果。结果表明,L-TAT-SOD能够显著地降低结肠炎大鼠的DAI评分。此外,结肠组织的切片染色结果显示,L-TAT-SOD能够减少杯状细胞的丢失、减少炎性细胞的浸润,这可能是SOD可以部分恢复UC模型大鼠结肠中紧密连接蛋白 (如ZO-1和occlaudin-1)的表达水平[13],改善肠道屏障,从而抵抗炎性细胞的入侵。L-TAT-SOD还能够显著提高结肠炎大鼠血清中的SOD酶活水平。鉴于模型组大鼠血清SOD酶活显著低于正常组的数据,推测LTAT-SOD可能是通过改善UC状况,来实现SOD水平的升高[13];也有可能是通过降低ROS水平来改善肠道环境,部分恢复肠道菌群的平衡状态,进一步提高机体的免疫力和自愈能力来实现。此外,相对于UC模型,DSS诱导的大鼠结肠炎被认为更像是急性肠道炎症[12],所以,L-TAT-SOD对慢性肠道炎症模型的治疗效果有待进一步的验证。
与口服SOD样品相比,作者制备的SOD样品原料来源更广、制造成本更低[12]。与从嗜热菌中分离得到的超稳定SOD相比,分离纯化步骤更简单[13]。
综上所述,口服L-TAT-SOD、L-SOD、TATSOD对于DSS诱导的结肠炎大鼠均有积极的治疗效果。其中,L-TAT-SOD的治疗效果最好,TATSOD和L-SOD的治疗效果相当。这可能是因为脂质体包埋有效避免其在胃肠道中酸解和酶解[22],TAT短肽富含碱性氨基酸的结构提高了SOD对肠道的黏附能力[14],可能也会改善SOD的作用。因此,口服L-TAT-SOD作为治疗溃疡性结肠结肠炎的辅助治疗手段具有良好的应用前景。
