可注射磁性液固相变材料用于骨肉瘤的磁共振成像与低温磁热治疗研究
2020-12-11朱钰方郑元义陈航榕
徐 东,朱钰方,郑元义,罗 宇,陈航榕
(1. 上海理工大学 材料科学与工程学院,上海 200093; 2. 中国科学院 上海硅酸盐研究所,上海 200050; 3. 上海交通大学附属第六人民医院 上海超声医学研究所,上海 200233; 4. 同济大学 化学科学与工程学院,上海 200092)
骨肉瘤是一种常见的恶性肿瘤,起源于骨,主要发生在儿童和青少年时期。它常在股骨远端和胫骨近端发芽,并容易转移到肺。目前临床上对骨肉瘤的治疗主要采取手术切除或者截肢方式[1]。手术切除虽然可以去除肿瘤病灶,但是难清除由于骨肉瘤浸润生长残留的肿瘤细胞,往往术后一定时间复发[2]。此外,截肢虽然在某种程度上更为彻底清除原发病灶,但是由于骨肉瘤的高转移性,在截肢前肿瘤已转移到其他脏器,截肢意义不大,同时截肢后病人往往失去劳动能力,给病人后期回归生活造成了巨大障碍[3]。现今,虽然可以采用保守的化学治疗,但是其全身性毒副作用以及较低的抗肿瘤效率也难以满足治愈骨肉瘤的需求。由此可见,研发一种更为安全高效的骨肉瘤治疗药物或者技术迫在眉睫。
热疗作为一种新型的高效治疗技术正在被越来越多的科研人员所关注,主要分为光热治疗和磁热治疗[4]。光热治疗受限于激光的穿透深度,且存在光热性能衰减的问题[5],限制了其在临床上的应用。磁热治疗因其无穿透深度限制、非侵入性等特点[6-8],在肿瘤的深部治疗方面具有独特的作用。前期的研究,几乎都采用过高温(>50 ℃)的磁热消融方式杀死肿瘤细胞[9-10],然而过高温度会对瘤周正常组织产生热辐射,从而破坏正常组织使其丧失生物学功能。因此,如何实现在较低磁热温度(正常组织细胞能耐受的温度约为43 ℃)下高效杀死肿瘤细胞成为急需解决的问题[11]。据报道利用低热可诱导肿瘤细胞程序性凋亡,但是,由于肿瘤细胞在低于45 ℃刺激下会诱发应急反应产生大量的热休克蛋白(HSP90)抑制细胞凋亡,削弱低热对肿瘤细胞的杀伤能力,疗效并不理想[12-14]。
围绕骨肉瘤的低温、高效磁热治疗这一研究目标,借鉴临床治疗脊柱压缩性骨折时可注射骨水泥液固相变原理[15],我们研发了一种可注射的液固相变磁热材料,通过微创的方式将材料注入肿瘤组织,液态材料在接触肿瘤之后迅速转化为固态磁性复合材料。在外加脉冲磁场刺激下,局部产生热杀死肿瘤细胞。此外,利用表没食子儿茶素没食子酸酯(EGCG)抑制肿瘤细胞在低温刺激下产生大量的热休克蛋白(HSP90)的活性,有效提高了低温磁热下对骨肿瘤细胞的杀伤力,避免了高温对瘤周正常组织的热辐射损伤。
1 实验方法
1.1 Fe3O4@PEI的制备
将FeCl3·6H2O的水溶液(1.3 g,20 mL)放入200 mL的三颈烧瓶中,通入高纯氮气30 min以上去除水中溶解氧,在氮气氛围下持续搅拌15 min。将Na2SO3水溶液(0.2 g,10 mL)滴加到上述溶液中,在氮气氛围下持续搅拌30 min后,将超支化的聚乙烯亚胺(PEI.NH2) (0.5 g,5 mL)和氨水(2 mL)依次加入上述混合物溶液中。撤去氮气保护,将混合物溶液在60~70 ℃下搅拌30 min,冷却至室温后继续搅拌1.5 h,采用磁分离方式收集、洗涤黑色产物Fe3O4@PEI纳米颗粒,重复洗涤三次以上。最后,将Fe3O4@PEI分散在超纯水中4 ℃保存备用。
1.2 PLGA/Fe3O4及PLGA/Fe3O4/EGCG的制备
首先称量聚乳酸-羟基乙酸(PLGA)(1 g)溶于1 mL N-甲基吡咯烷酮(NMP),然后放入37 ℃的干燥箱中过夜。采用磁分离方式用二甲亚砜(DMSO)洗涤Fe3O4@PEI纳米颗粒,最后将含Fe 100 mg 的纳米颗粒分散在2 mL的DMSO中,并通过磁力搅拌方式将其分散到的PLGA溶液中形成PLGA/Fe3O4的共混液。然后将小分子抑制剂EGCG分散在PLGA/Fe3O4混合溶液中形成PLGA/Fe3O4/EGCG的混合溶液,PLGA/Fe3O4(PF),PLGA/Fe3O4/EGCG(PFE)复合材料可在水溶液中液固相变之后得到。
1.3 磁热性能测试
将不同Fe浓度(0.45、0.9、1.8、3.6 mg/mL)的溶液1.5 mL置于2 mL离心管中,将其放在交变电流频率为550 kHz,输出功率恒定为7 kWh、线圈大小为10 cm的磁场下,利用Fotric-225热红外相机监测材料的升温曲线。
1.4 r2弛豫率测试及T2加权磁共振(MR)成像
用0.5%琼脂糖溶液稀释Fe3O4溶液配置一系列Fe浓度梯度(0.8、0.4、0.2、0.1、0.05和0.025 mmol/L)样品,冷却至室温后,测不同Fe浓度样品的T2弛豫时间,计算出r2弛豫率[16]。
用临床使用的3.0 T磁共振成像仪评估上述样品T2加权MR成像性能(TR=4313.7,TE=99.6)。另外将PLGA/Fe3O4配制成不同Fe浓度的溶液,分别取50 μL注射到去离子水中使其液固相变,考察液固相变之后的复合材料在3.0 T磁共振成像仪中T2加权MR成像[17]。
1.5 细胞毒性测试
将一定体积的PLGA、PF、PFE注射到2 mL超纯水中,得到PLGA相变体及PF、PFE复合材料,将得到的三组材料放置水中过夜以充分排尽NMP。将材料转移至完全培养基中使材料的质量浓度为0.1 g/mL,浸泡24 h后弃去材料,将浸提液用新鲜培养基稀释成不同浓度(不同百分含量的浸提液)。将骨肉瘤MG-63细胞以104个细胞/孔的密度种植在96孔板中,贴壁过夜,然后将稀释后的复合材料浸提液100 μL与细胞在37 ℃、5vol% CO2的环境下共培养24 h,弃掉培养基,90 μL无血清培养基+10 μL细胞活力检测试剂CCK-8共培养2~4 h后用酶标仪测定430 nm波长吸收值。
1.6 体外细胞低热治疗
将骨肉瘤MG-63细胞以5×104个细胞/孔密度种植在24孔板中,在37 ℃、5vol% CO2的湿润气氛中贴壁培养24 h。分别加入50 μL PLAG、PF、PFE液体形成的PLGA相变体及PF、PFE复合材料分别共培养12 h后,利用电流频率为550 kHz,输出功率恒定为7 kW,线圈大小为10 cm的磁场升温(SPG400KZ高频感应加热器),利用热红外相机将监测温度控制在43 ℃ 40 min,弃掉三组材料再培养24 h后,再弃掉培养基,90 μL无血清培养基+10 μL CCK-8试剂共培养2~4 h,用酶标仪测定430 nm波长吸收值。
2 结果与讨论
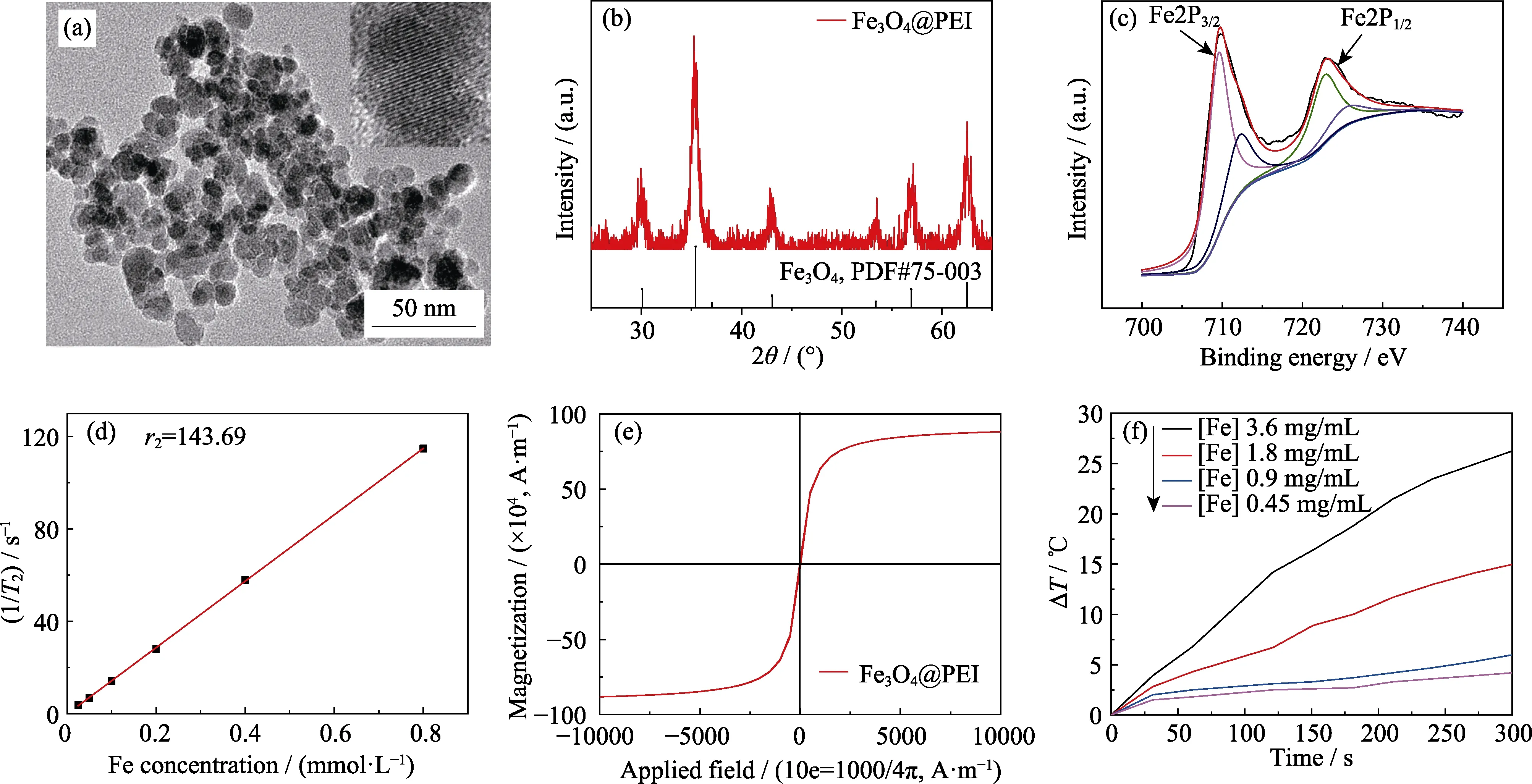
图1 超顺磁性Fe3O4纳米颗粒的透射电镜照片(a)、X射线衍射图谱(b)、X射线光电子图谱(c)、r2弛豫率(d)、饱和磁化强度(e)以及在交变磁场中不同Fe浓度的升温曲线(f)Fig. 1 TEM images of superparamagnetic Fe3O4 nanoparticles (a),XRD patterns (b),XPS spectra (c),r2 relaxation rate (d),saturation magnetization (e),and temperature rise curves of different Fe concentrations in an alternating magnetic field (f)
采用温和还原法[17-19]合成了超顺磁性氧化铁纳米颗粒(SPION),如图1(a)所示,制备得到的纳米颗粒呈准球形,直径约为15 nm。XRD分析显示纳米颗粒晶体结构的三强峰(2θ=35.422°、56.942°、62.515°)与标准卡片PDF#75-003较好对应,表明合成样品物相组成为Fe3O4(图1(b))。为了验证样品中Fe2+与Fe3+的相对比值,采用X射线光电子能谱(XPS)对样品进行测试,从图1(c)可看到两个明显的Fe2P3/2(709.78 eV)和Fe2P1/2(722.88 eV)特征峰,经过拟合计算得到样品中的Fe2+:Fe3+= 33.2 :66.8 ≈1 :2,进一步证实了制备得到的氧化铁纳米颗粒为Fe3O4。磁性能测试表明所合成的氧化铁纳米颗粒饱和磁化强度为8.96×104A·m-1(图1(e)),与文献报道的超顺磁性Fe3O4饱和磁化强度基本一致[20],表明制备得到纳米颗粒具有潜在的MR成像性能。弛豫率是衡量纳米颗粒MR成像性能的重要指标之一,通过测定材料的驰豫时间,经拟合后计算得到Fe3O4的r2值为143.69 mmol·L-1·s-1(如图1(d)),表明制备得到的纳米颗粒具有较高的T2加权MR成像性能。随后在交变磁场频率为550 kHz、输出功率恒定为 7 kW、线圈大小为10 cm的条件下[21]测定制备得到的磁性氧化铁纳米颗粒的磁热升温曲线如图1(f)所示,随着Fe浓度的升高,纳米颗粒升温能力逐渐增强,呈浓度依赖性。当Fe浓度为3.6 mg/mL时,5 min内材料温度增加26.3 ℃,可满足体外细胞实验及活体动物实验磁热升温需求。
如图2(a,b)所示装载有Fe3O4纳米粒子的PLGA/Fe3O4复合物(PF)在未与水相接触之前,呈可注射的粘稠流动液体,可用1 mL注射器吸取,为其体内肿瘤磁热治疗提供了可能。将流动的PF注入水中后,可快速发生液固相变形成PF复合材料(如图2(c)所示),表明在进行肿瘤内注射后,PF可以锚定在肿瘤部位,发挥被动靶向功能。

图2 Fe3O4分散到PLGA液体中得到均匀流体的数码照片(a),用1 mL注射器吸取PLGA/ Fe3O4流体数码照片(b),用注射器将PLGA/Fe3O4流体打入水中液固相变数码照片(c)Fig. 2 Digital photo of Fe3O4 dispersed in PLGA liquid to obtain a homogeneous fluid (a); Digital photo of PLGA / Fe3O4 fluid sucked with a 1 mL syringe (b); Digital photo of liquid-solid phase transition of PLGA / Fe3O4 fluid driven into water with a syringe (c)
通过扫描电镜对PF复合物在发生液固相变之后所形成的PF复合材料表面形貌进行观察,结果显示在液固相变之后形成的复合材料具有多孔表面且粗糙褶皱的结构(如图3(a)所示),这样的结构有利于小分子药物的释放,为后续HSP90小分子抑制剂的装载提供了可能。此外,通过能量色散X射线光谱(EDX)测试发现有Fe元素存在,并且分散均匀,表明Fe3O4成功地均匀分散到PLGA流体中(图3(b,c))。

图3 PLGA/Fe3O4(PF)复合材料的SEM照片(a)及其对应能量色散X射线光谱(b),以及不同元素分布扫描(c)Fig. 3 SEM image of PLGA/Fe3O4 (PF) composite (a),with its corresponding EDX spectrum (b),and different elements mapping (c)
为了控制复合材料的磁热升温幅度,对材料体系的体积/含铁量进行了优化,最终确定比例为注射体积50 μL、Fe含量为10%。对优化后的PF复合材料在不同介质(空气和水)中磁热升温性能进行了研究。如图4(a)所示,50 μL、Fe含量为10%的PF在交变磁场作用下,5 min内在水中和空气中温度上升量分别为11 ℃和21.3 ℃,满足体外细胞实验以及活体动物实验需求。不同铁含量PF复合材料的T2加权MR成像性能表征结果显示(图4(b))随着Fe浓度的增加,PF复合材料的MR信号逐渐衰减,呈现浓度依赖性,表明PF具有良好的T2加权MR成像潜能[22]。采用浸提液共培养方法评估了PF复合材料的细胞毒性(图4(c)),结果显示当复合材料在培养基中浓度为0~80 mg/mL范围内时,骨肉瘤MG-63细胞存活率均保持在90%以上(图4(c)),表明体外细胞治疗实验所用PF复合材料(50 μL,液固相变之后浓度为59.45 mg/mL)具有良好的细胞相容性。评估HSP90小分子抑制剂EGCG的细胞相容性,以支撑后续的体外细胞治疗实验。采用培养箱升温模拟磁热升温[23],研究发现43 ℃低温处理骨肉瘤MG-63细胞40 min后,骨肉瘤MG-63细胞的存活率随小分子抑制剂EGCE浓度增加而显著降低,当EGCE浓度为200 μg/mL时,37 ℃正常培养组骨肉瘤MG-63细胞存活率为84%,而低热43 ℃治疗组的细胞存活率仅有24%,结果证实小分子抑制剂能有效地抑制了热休克蛋白(HSP90)活性,削弱了HSP90对骨肉瘤细胞的保护作用实现了在低温下杀死骨肉瘤的研究目的(图4(d))。
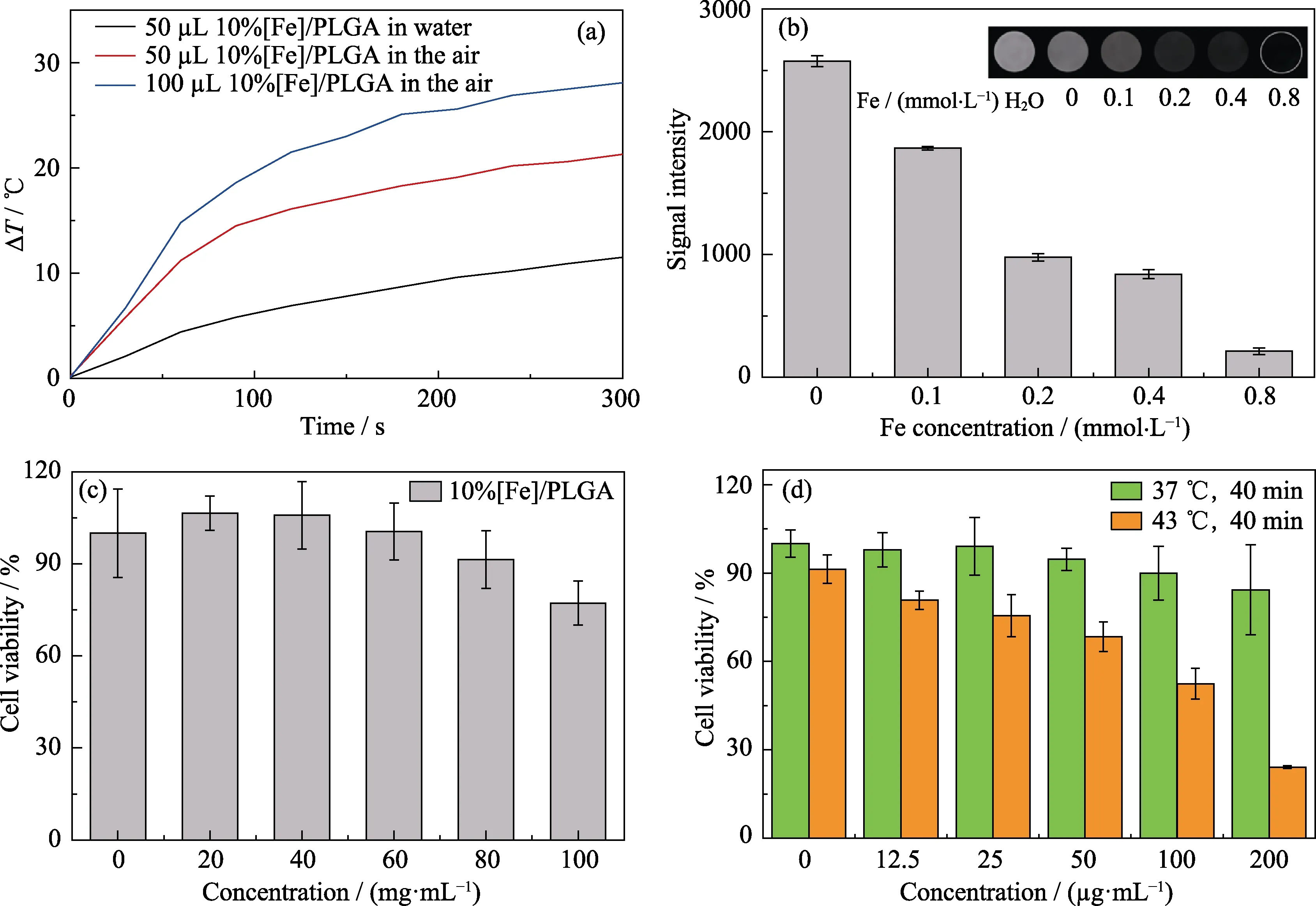
图4 PLGA/Fe3O4复合物(PF)在交变磁场中的升温(a)、细胞毒性(b)及体外T2加权MR成像(c),以及在模拟磁热升温(43 ℃)下抑制剂EGCG的细胞相容性(d)Fig. 4 Temperature rise of PLGA/Fe3O4 composite (PF) in AMF (a),cytotoxicity (b) and in vitro T2-weighted MR imaging (c),and the cytocompatibility of the inhibitor EGCG under simulated magnetocalormic temperature rise (43 ℃,d)
为了评估PFE复合材料对骨肉瘤的治疗效果,将PLGA、PF、PFE三组材料与骨肉瘤细胞共培养后的24孔细胞板置于电流频率为550 kHz、输出功率恒定为7 kW、线圈大小为10 cm的磁场中,通过控制交变磁场的工作时间,利用红外相机监控温度。在AMF下(图5),对照组与PLGA组都未升温,且骨肉瘤细胞MG-63的存活率都在95%以上,表明磁场对肿瘤细胞无损伤作用。而PF、PFE复合材料组都可在AFM下升温。利用热红外相机监测并控制温度在43 ℃,保持40 min,实验结果表明,PF组低温磁热处理前后骨肉瘤细胞都具有高于80%的存活率,这是由于热休克蛋白HSP90在低热刺激下的大量表达启动热应激保护[24],造成低热(43 ℃)下不能有效杀死肿瘤细胞。值得注意的是,PFE组低温磁热处理后骨肉瘤细胞31%的存活率大大低于未低温磁热处理81%的存活率,表明HSP90小分子抑制剂ECGG可以有效地抑制HSP90的活性,使得骨肉瘤细胞在较低的温度下就能被高效杀死,从而有望实现在低温下治疗肿瘤的目的,为后续的动物活体实验提供支撑。

3 结论
本研究通过简易方法制备出基于PLGA液固相变的可注射磁性材料。其中超顺磁性氧化铁纳米颗粒Fe3O4实现肿瘤T2加权MR成像的同时在交变磁场激发下可以发生磁热转化,从而实施肿瘤的磁热治疗。此外,利用小分子抑制剂有效抑制热休克蛋白HSP90活性,削弱肿瘤细胞的热应激保护机制,可实现低温(43 ℃)磁热杀死骨肉瘤细胞,有望克服高温磁热对瘤周正常组织存在热辐射损伤的不足,为深部肿瘤的磁热治疗提供新的方法和材料支撑。
