寄生于罗非鱼的刺纹车轮虫种群分析及其寄主偏好性研究
2020-12-10秦微微赵元莙唐发辉
秦微微 赵元莙 唐发辉
(重庆师范大学动物生物学重点实验室, 重庆 401331)
罗非鱼隶属于鲈形目Perciformes、丽鱼科Cichlidae、罗非鱼属Oreochromis, 是原产于非洲的中小型硬骨鱼类, 现为世界水产业重点培养的海、淡水养殖鱼类, 是渔业经济发展的重要组成。自20世纪60年代以来, 我国罗非鱼养殖业发展迅速[1], 但在养殖过程中常常遭受多种病害的困扰。其中, 车轮虫就是常见的寄生虫, 主要寄生于鱼类的皮肤及鳃,往往引起皮肤病和鳃病, 从而影响幼鱼的生长发育,严重时可引起鱼苗大批死亡, 严重危害养殖渔业的发展[2—4]。迄今, 基于健康养殖的理念, 尚未有高效低毒的车轮虫病防治手段。
作为一类具有危害性的游走类纤毛虫, 车轮虫的寄主十分广泛, 除鱼类外, 其亦可广泛地外寄生或共栖生于贝类以及两栖类。据报道, 全世界已记录车轮虫400余种[5—10], 其中感染罗非鱼的车轮虫达30种, 包括车轮虫属Trichodina18种, 拟车轮虫属Paratrichodina1种, 小车轮虫属Trichodinella2种,三分虫属Tripartiella9种。刺纹车轮虫Trichodina centrostrigataBasson, Van As & Paperna, 1983是罗非鱼上常见的病害性纤毛虫[7,9,11—18]。本文结合其形态学特征、分子特征及系统发育分析, 对刺纹车轮虫的种群多样性及寄主偏好性进行了研究, 以期为罗非鱼的车轮虫病原的鉴定提供参考资料。
1 材料与方法
1.1 样本采集与鉴定
寄主罗非鱼(单性吉富系列:Oreochromis niloticus×Oreochromis mossambicus)分别于2017年7月、2018年7月采自重庆市江津区长冲镇鱼类养殖场。将其带回实验室解剖取鳃进行涂片镜检以观察车轮虫的活体, 自然空干后的鳃涂片采用干银法进行染色[19]。车轮虫的形态描述及测量依据Lom的统一特定方法进行[20]; 齿体定位图则借助CorelDRAW 11.0绘制; 齿体定位描述则依据Van As和Basson[21]倡导、唐发辉等[22]补充的方法进行。基于形态学测量数据, 利用SPSS和Past3软件进行种群间的显著性差异分析与主成分分析(PCA)。
1.2 DNA提取、扩增、测序与序列提交
为了DNA数据获取的准确性, 用于分子研究的刺纹车轮虫两种群[Trichodina centrostrigata(W)与Trichodina centrostrigata(Q)]各自分别进行了两次(2条序列)与四次(4条序列)纯化虫体的分离与DNA样本的扩增测序。具体操作为: 每次收集1—2只无菌水洗涤数次的刺纹车轮虫于1.5 mL的Eppendorf管中, 按照REDExtract-N-AmpTM Tissue PCR Kit (Sigma, St. Louis, USA)试剂盒说明书提取样本DNA, 随后保存于–20℃备用。18S rDNA扩增共涉及3对引物和3种PCR反应条件: (1) 82F (5′-GAAACTGGGAATGGCTC-3′)和LSUR (5′-GT TAGTTTCTTTTCCTCCGC-3′)[23], 反应条件为:94℃预变性1min 30s; 94℃变性20s, 58℃退火20s,72℃延伸2min, 35个循环; 72℃再延伸5min; (2) TGF (5′-AACCTGGTTGATCCTGCCAGT-3′)和TG-R(5′-TGATCCTTCTGCAGGTTCACCTAC-3′)[23], 反应条件为: 94℃预变性5min; 94℃变性1min, 56℃退火1min, 72℃延伸2min, 35个循环; 72℃再延伸10min; (3) 18S-F1 (5′-ACCTGGTTGATCCTGC CAGT-3′)和18S-R1 (5′-TGCAGGTTCACCTACG GAAA-3′)[24], 反应条件为: 94℃预变性1min, 56℃退火2min, 72℃延伸2min, 5个循环; 94℃变性1min,58℃退火1min, 72℃延伸2min, 35个循环; 72℃再延伸10min。ITS-5.8S rDNA扩增引物为ERIB10-V(5′-CCGTAGGTGAACCTGCGGAAG-3′)和28S1R(5′-GTGTTTCAAGACGGGTCG-3′)[25], PCR反应条件为: 94℃预变性3min, 94℃变性30s, 54℃退火30s,72℃延伸2min, 35个循环; 72℃再延伸10min。PCR纯化产物送至英潍捷基(上海)贸易有限公司完成测序。
本研究共获得6条刺纹车轮虫18S rDNA序列,包括T. centrostrigata(W)种群2条序列:T. centrostrigata(W1, MN071225)和T. centrostrigata(W2,MN071226);T. centrostrigata(Q)种群4条序列:T.centrostrigata(Q1, MN071227)、T. centrostrigata(Q2, MN071228)、T. centrostrigata(Q3, MN071229)和T. centrostrigata(Q4, MN071230)。同样, 共获得刺纹车轮虫ITS-5.8S rDNA序列6条, 包括T. centrostrigata(W)种群2条序列:T. centrostrigata(W1,MN071231)和T. centrostrigata(W2, MN071232);T.centrostrigata(Q)种群4条序列:T. centrostrigata(Q1, MN071233)、T. centrostrigata(Q2, MN071234)、T. centrostrigata(Q3, MN071235)和T. centrostrigata(Q4, MN071236)。
1.3 18S rDNA的一级和二级结构分析
通过GenBank中BLAST对本研究所获的刺纹车轮虫序列进行序列同源性比对; 使用MEGA6中的Kimura 2-parameter模型计算遗传距离; 采用MEGA6和BioEdit 7.0.5.3进行变异位点分析。基于自由能最小化利用RNA structure 5.2进行RNA二级结构预测, 参照选自European ribosomal RNA database的二级结构模型, 使用RNAViz 2.0进行手动调整[26]。本研究选取与系统发育相关的18S rDNA的三个高变区(V4、V5和V7区)来分析刺纹车轮虫的种群变异。
1.4 系统发育树的构建
将本研究新获得的18S rDNA序列和从Gen-Bank数据库中选取的寡膜纲53条完整或部分18S rDNA序列(共59条序列), 以大肾形虫Colpoda magna(EU039896)和毛板壳虫Coleps hirtus(AM 292311)为外群, 所有序列在MEGA6中的Clustal W多重比对后, 分别使用MrBayes 3.1.2软件与CIPRES Science Gateway在线网站构建BI树与ML树[27,28], 最后使用FigTree v1.4.2与Photoshop CS3完成系统发育树的绘制。
2 结果
2.1 形态学重描述
本研究所获刺纹车轮虫两个种群均采自重庆市江津区长冲镇鱼类养殖场的单性吉富系列罗非鱼(Oreochromis niloticus×Oreochromis mossambicus)的鳃表; 基于本研究对寄主鱼的解剖调查数据: 两次检测种群样本的感染率高而感染强度却较低(表 1)。
种群1: 刺纹车轮虫,Trichodina centrostrigata(W)
感染率: 100% (检查84条, 84条感染)
感染强度: 轻度感染(+)
采集时间: 2017年7月
形态学描述(标本测量数n=14): 虫体呈圆盘状,属中型车轮虫, 虫体直径42.9—57.5 μm (49.4±4.1),附着盘直径34.9—51.7 μm (41.8±4.2), 齿环直径21.7—32.4 μm (25.7±3.0), 缘膜宽3.0—4.4 μm(3.8±0.4); 齿体之间嵌合紧密, 齿体纵长10.8—15.7 μm (12.9±1.3), 齿长3.4—5.9 μm (4.7±0.6)。齿钩宽大粗壮, 齿钩长4.9—7.0 μm (6.1±0.5), 齿钩外切缘圆滑与缘膜不平行, 骨突钝圆且低于外切缘,齿钩前缘平直, 齿钩凸点超过Y+1轴, 齿钩后缘平直或稍弯曲与齿钩凹点形成“L”形, 无明显后突起,但有的齿体具有钩突; 齿钩连接纤细而齿锥发达,齿锥宽1.6—2.3 μm (2.1±0.3), 在X轴上下大小相似;齿棘长3.8—6.8 μm (4.8±0.7), 呈棒状, 较直略向前倾, 超过Y+1轴, 齿棘顶点钝圆, 无明显棘突; 辐射状排列的中央颗粒呈棒状或长条状; 口围绕度约360° (图 1和表 2)。
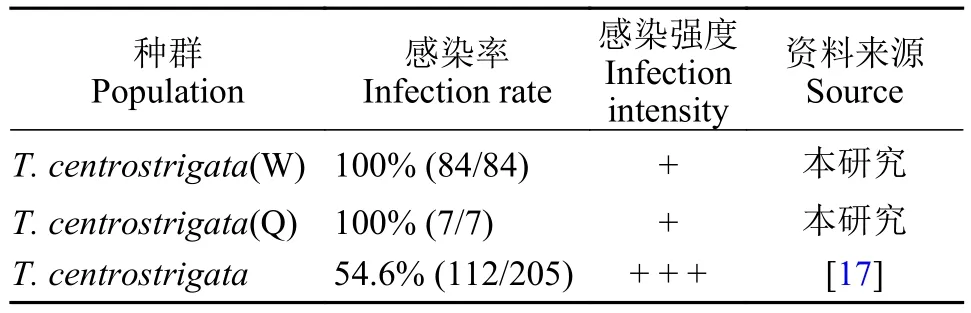
表 1 罗非鱼感染刺纹车轮虫情况表Tab. 1 Infection data of the T. centrostrigata from cultured tilapia
种群2: 刺纹车轮虫,Trichodina centrostrigata(Q)
感染率: 100% (检查7条, 7条感染)
感染强度: 轻度感染(+)
采集时间: 2018年7月
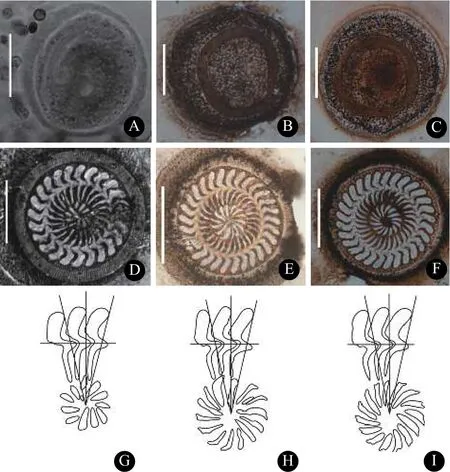
图 1 刺纹车轮虫银染标本的显微照片与齿体定位图Fig. 1 Photomicrographs of silver stained specimens and diagrams of the denticle location for T. centrostrigata
形态学描述(标本测量数n=15): 中型淡水车轮虫, 虫体呈圆盘状, 齿体与中央颗粒分布明显。虫体直径42.1—54.7 μm (47.4±3.8), 附着盘直径35.1—46.3 μm (40.3±3.3), 齿环直径20.5 —30.9 μm(24.9±2.8), 缘膜宽2.5—4.2 μm (3.5±0.4); 齿钩长4.4—7.1 μm (5.8±0.6), 齿钩宽大呈长方形, 骨突钝圆, 齿钩外切缘圆滑与缘膜平行且高于骨突, 齿钩前缘平直或稍弯曲, 齿钩凸点超过Y+1轴, 齿钩后缘平直光滑, 具明显钩突, 无明显后突起; 齿钩连接及齿锥发达, 齿锥宽1.1—2.6 μm (1.7±0.4), X轴上锥形与下锥形比例接近; 齿棘长3.6—6.9 μm (5.0±0.7), 齿棘前倾, 超过Y+1轴, 齿棘顶点尖锐且指向长条状中央颗粒, 无明显棘突; 口围绕度约400°(图 1和表 2)。
2.2 基于SPSS与PCA对刺纹车轮虫的种群比较研究
以网状车轮虫Trichodina reticulataHirschmann& Partsch, 1955的T. reticulata(S)种群[25]作为种间对照, 通过SPSS软件对刺纹车轮虫T. centrostrigata(W)和T. centrostrigata(Q)两种群进行显著性差异分析, 结果显示: 网状车轮虫T. reticulata(S)与刺纹车轮虫T. centrostrigata(Q)在虫体直径、附着盘直径、缘膜宽、齿环直径、齿体纵长、齿长、齿钩长、齿棘长以及中央颗粒数九方面的形态特征具有极显著差异(P<0.01), 在齿锥宽具有显著差异(P=0.019<0.05); 刺纹车轮虫T. centrostrigata(W)和T. centrostrigata(Q)种群之间仅在齿锥宽上具有极显著差异(P=0.003<0.01, 表 3)。
同理, 以网状车轮虫T. reticulata(S)作为种间对照, 利用Past3对以上三个种群进行主成分分析,刺纹车轮虫T. centrostrigata(W)与T. centrostrigata(Q)两种群在形态学上具有高度的重叠, 而网状车轮虫T. reticulata(S)在形态学上明显区别于T. centrostrigata(Q, 图 2)。
2.3 基于18S rDNA与ITS-5.8S rDNA的分子特征分析
18S rDNA序列的同源性、遗传距离及变异位点的分析: 将T. centrostrigata(W)与T. centrostrigata(Q)种群的18S rDNA序列在GenBank中进行BLAST比对, 均与现有的刺纹车轮虫T. centrostrigata(KP295473)最相似(相似度≥99.9%)。以上三个种群之间的序列相似度为99.8%—100%, 遗传距离为0—0.001。其中,T. centrostrigata(KP295473)与T. centrostrigata(W)种群之间序列相似度为100%, 遗传距离为0;T. centrostrigata(KP295473)与T. centrostrigata(Q)种群之间序列相度为99.8%—100%, 遗传距离为0—0.001;T. centrostrigata(W)与T. centrostrigata(Q)种群之间序列相似度为99.9%—100%, 遗传距离为0—0.001。7条刺纹车轮虫的18S rDNA序列经多重比对后, 其覆盖长度为1326 bp, 与T. centrostrigata(KP295473)进行变异位点分析, 结果显示:T. centrostrigata(Q1)在第2位点处发生颠换;T. centrostrigata(Q4)在第577位点出现gap (图 3)。
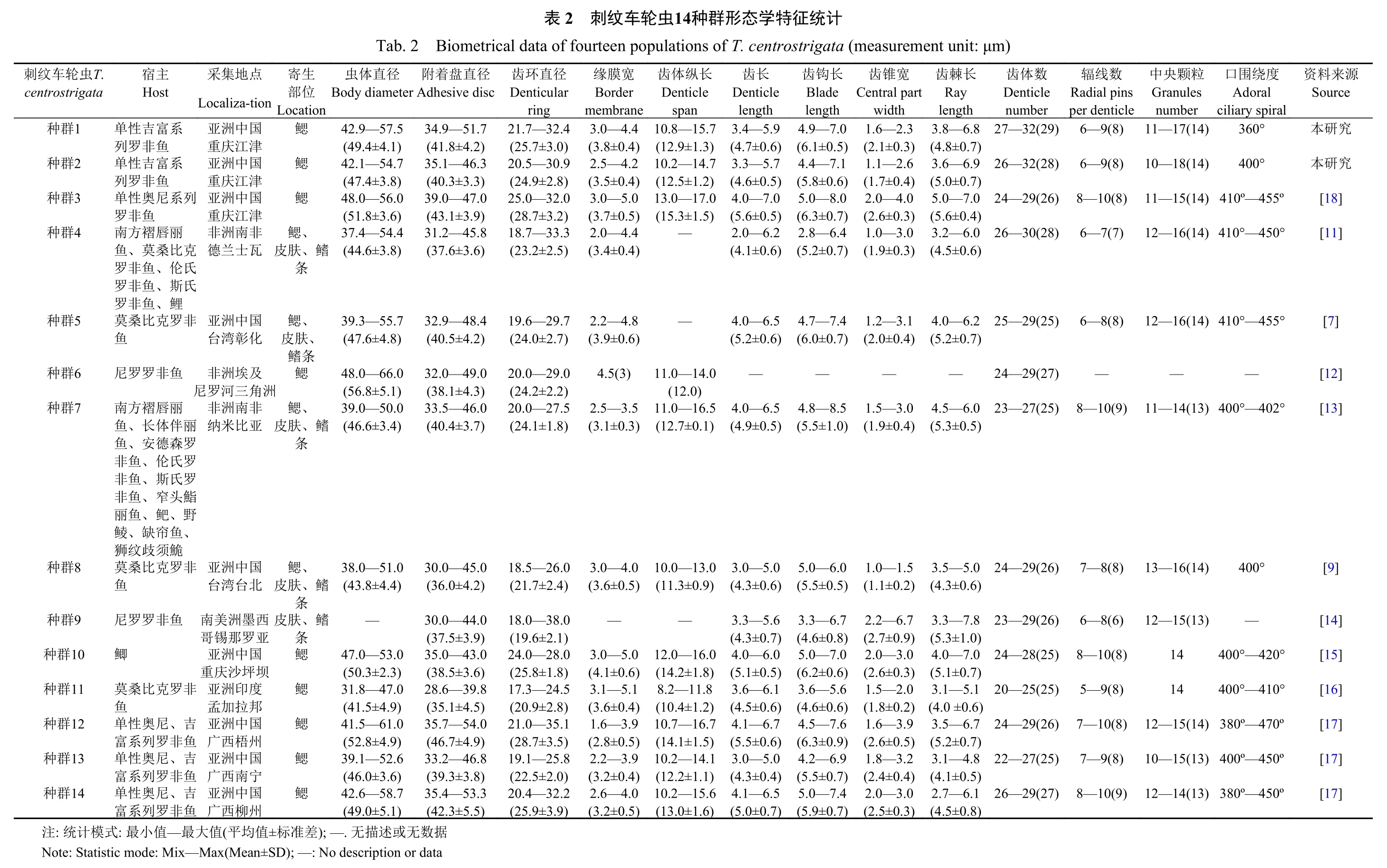
源料Source来 究 究研研8][1 1][1[7]2][1 3][1[9]4][1 5][1 6][1 7][1 7][1 7][1资围Adoral° °度绕0° 本36 0° 本40 455º450°ciliary spiral 455°402°0°470º450º450º40º—10—0°—420º—º—º—0°—410 40口)4 80 00 80)410°—)400°—)中Granules 40—)—17(14))3—18(14)4)3 number—15(14颗))410°—粒央—16(14 14 14—16(14 10—11 11 12 12—14(13 11—16(14 13—15(13 12—15(14 12—15(13 10—14(13 12数ins线9(8)9(8)10(8)7(7)8(8)—10(9)8(8)8(6)10(8)9(8)10(8)9(8)10(9)辐Radial p per denticle 6—6—8—6—6—8—7—6—8—5—7—7—8—数2(28)9(26)0(28)9(25)9(27)7(25)9(26)9(26)8(25)5(25)9(26)7(25)9(27)m)体齿Denticle er mb 2(29)nu ent unit: μ 27—3 26—3 24—2 26—3 25—2 24—2 23—2 24—2 23—2 24—2 20—2 24—2 22—2 26—2长6.9 7.0 6.0 6.2 6.0棘Ray th 6.8 5.0 3.8—±0.7)leng 7.8 7.0 3.6—±0.7)5.1 0.6)6.7 5.0—±0.4)4.8 6.1(4.8齿(5.0(5.6 3.2—±0.6)(4.5 4.0—±0.7)(5.2 4.5—±0.5)—(5.3 3.5—±0.6)(4.3(3 5..3 3—±1.0)4.0—±0.7)(5.1 3.1—(4.0 ±3.5—±0.7)(5.2 3.1—±0.5)(4.1 2.7—±0.8)(4.5态. centrostrigata (measurem宽4.0 width 2.3 3.0 Central part 3.1 3.0 1.6—±0.3)1.5 6.7(2 1.1—±0.4)3.0 2.6 2.0 3.9 3.2 3.0锥.1.7(1 2.0—±0.3)齿.6(2 1.0.9—±0.3)1.2—±0.4)(1.0(2—(1 1.5.9—±0.4)1.0.1—±0.2)(1(2 2.2.7—±0.9)2.0.6—±0.3)(2 1.5.8—±0.2)(1 1.6.6—±0.5)(2 1.8.4—±0.4)(2 2.0.5—±0.3)(2计 长7.1)8.0)6.4)7.4)8.5)6.0)6.7)7.0)5.6)7.6)6.9)7.4)统 钩.1±0.5.8±0.6.3±0.7.2±0.7.0±0.7—.5±1.0.5±0.5.6±0.8.2±0.6.6±0.6.3±0.9.5±0.7.9±0.7征 齿Blade length 7.0)(6 4.4—(5 5.0—4.9—(6 2.8—(5 4.7—(6 4.8—(5 5.0—(5 3.3—(4 5.0—(6 3.6—(4 4.5—(6 4.2—(5 5.0—(5特)Denticle)th 5.9.6)))))))))))学 长6.5.6 6.5.5 5.0.6 5.6.7齿leng 3.4—形(4.7±0 5.7.5 3.3—(4.6±0 7.0.5 4.0—(5.6±0 6.2.6 2.0—(4.1±0 4.0—(5.2±0—4.0—(4.9±0 3.0—(4.3±0 3.3—(4.3±0 6.0.5 4.0—(5.1±0 6.1.6 3.6—(4.5±0 6.7.6 4.1—(5.5±0 5.0.4 3.0—(4.3±0 6.5.7 4.1—(5.0±0群种 长.8 14 ns of T纵—15.7 1.3)1.2)1.5)0.1)齿Denticlepulatio—14.0 0.9)—16.5 span 1.8)—13.0 11 1.2)1.5)1.1)—16.0 1.6).8体虫10(12.2.9±—14.7(12.0.5±—17.0(15.3±—10—.0 13(12.0).0(12.7±11.0.0(11.3±11—8.2—.7.2.2 10 12(14.2±(10.4±—16.7 10(14.1±—14.1 10(12.2±—15.6 10(13.0±4.0.5)5.0.6)3.0—(3.6±0—3.0—(4.1±0 5.1.4)3.1—(3.6±0 3.9.5)1.6—(2.8±0 3.9.4)2.2—(3.2±0 4.0.5)2.6—(3.2±0 2.4)2.1)1.8)2.8)3.5)2.0)3.9)—26.0—38.0.5 18(21.7±.0 18(19.6±—28.0.0 24(25.8±—24.5.3 17(20.9±—35.1.0 21(28.7±—25.8.1 19(22.5±—32.2.4 20(25.9±4.2)3.9)3.6)4.5)4.9)3.8)5.5)30.0—45.0 6.0±(3 30.0—44.0 7.5±(3 35.0—43.0 8.5±(3 28.6—39.8 5.1±(3 35.7—54.0 6.7±(4 33.2—46.8 9.3±(3 35.4—53.3 2.3±(4据数5.1)或1.0 4.4)3.0 7.0 2.3)4.9)1.0 2.6 4.9)3.6)8.7述o description描38.0—5(43.8±47.0—5(50.3±—31.8—4(41.5±41.5—6(52.8±39.1—5(46.0±42.6—5(49.0±. 无鳍); —: N无or data鳍、、 、差条鳃肤条肤条鳃 鳃 鳃 鳃 鳃皮准); —标±SD国北 西亚墨罗中台 国坝度邦国州国宁国州值美锡洲庆洲加洲西洲西洲西(平洲那 坪皮洲湾重亚孟亚广亚广亚广值ax(M中沙印拉中梧中南中柳均ean±亚台 南哥亚罗罗罗鮨野、 非 非 吉鱼吉鱼吉鱼最—M大森氏氏头、鱼鮠罗 鱼 罗 、非、非、非i x德伦斯窄鲃帘须克 非 克 尼罗尼罗尼罗—安、、、、缺歧比 罗 比 奥列奥列奥列值罗桑、鱼鱼鱼鱼、纹桑性系性系性系14单富: 最鱼非非非丽鲮狮莫鱼 尼式模8 9计10鲫11莫鱼单富: 统te: S 13单富tatistic m群小ode: M群12群群群群群种 种种种种种种 注N o
ITS-5.8S rDNA序列的同源性、遗传距离及变异位点的分析: 将6条ITS-5.8S rDNA序列进行序列同源性与遗传距离分析, 结果显示:T. centrostrigata(W)与T. centrostrigata(Q)种群之间的序列相似度为100%, 遗传距离为0。将ITS-5.8S rDNA序列进行变异位点分析, 结果显示T. centrostrigata(W)与T.centrostrigata(Q)种群之间无变异位点。

表 3 基于SPSS的车轮虫种群统计分析结果Tab. 3 Statistical analysis of trichodinid populations based on SPSS
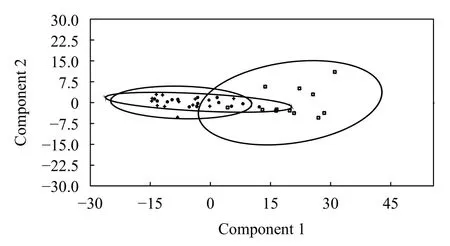
图 2 刺纹车轮虫种群的主成分分析(以网状车轮虫为参考对象)Fig. 2 Principal component analysis (PCA) of populations for T.centrostrigata (based on T. reticulata)
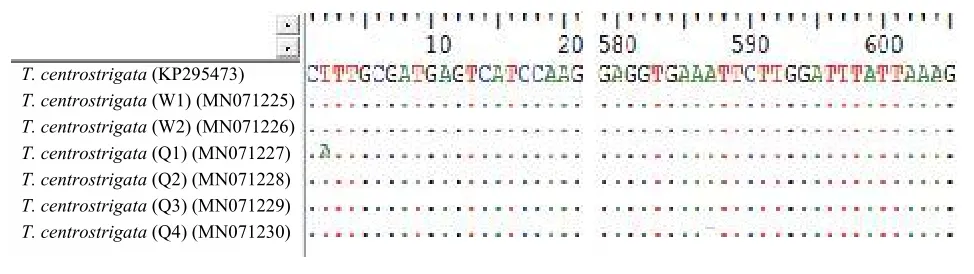
图 3 刺纹车轮虫3种群的18S rDNA序列变异位点比较Fig. 3 The comparison of variation site among three populations of T. centrostrigata
18S rRNA二级结构的分析: 为了进一步评估刺纹车轮虫种群变异, 本文对其18S rRNA进行二级结构预测, 结果显示: 7条刺纹车轮虫序列在V4、V5和V7三个高变区具有一致的二级结构构型, 且在一级结构上也完全一样(图 4和图 5)。
2.4 系统发育分析
基于18S rDNA序列, 通过BI法与ML法构建的系统发育树显示: 所有刺纹车轮虫聚为一支, 具有高靴攀值(1.00BI, 100%ML)支持, 靠近系统发育树的顶端; 其次, 刺纹车轮虫支与2种海水鱼类和4种海水贝类寄生车轮虫聚为一支(1.00BI, 96%ML), 之后再与寄生于淡水类寄主的车轮虫聚支(图 6)。
3 讨论
3.1 刺纹车轮虫的系统发育与种群分化
刺纹车轮虫三个种群的形态学比较表明, 本研究所涉刺纹车轮虫T. centrostrigata(W)与T. centrostrigata(Q)种群在虫体大小及各形态特征量度上相似, 而王琴等[18]从单性奥尼系列罗非鱼Oreochromis aurea♂×Oreochromis nilotica♀鳃表检获的T.centrostrigata(KP295473)种群在虫体各形态特征上则差异略大, 齿钩呈棒槌状, 棒状的中央颗粒略短。PCA与SPSS分析显示,T. centrostrigata(W)与T. centrostrigata(Q)种群除在齿锥宽上具有极显著差异(P=0.003<0.01)外, 在其他形态特征上均不具有明显差异; 而不同物种之间在各形态特征上具有极显著性差异。18S rDNA与ITS-5.8S rDNA常用作种间、种内鉴定的分子标记[29,30], 刺纹车轮虫三个种群之间在18S rDNA的序列相似度(99.8%—100%)、遗传距离(0—0.001)、变异位点(1处颠换)仅存在微小差异, 但均在种内水平; 基于18S rRNA的二级结构预测表明, 三个种群在V4、V5与V7三个高变区不仅具有一致的二级结构构型, 在一级结构碱基序列上也无差异, 从而支持其同种性。在系统发育树中, 7条刺纹车轮虫序列并未按种群聚支。综上, 结合形态学、分子特征及系统发育综合分析, 刺纹车轮虫T. centrostrigata(KP295473)、T. centrostrigata(W)和T. centrostrigata(Q)三个种群之间在虫体及各形态特征的量度上, 齿钩、齿棘、中央颗粒形态上, 18S rDNA序列上存在微小的种群差异, 但未出现明显的种群分化, 这可能是由于寄主罗非鱼品系不同而导致的。在系统发育树中, 刺纹车轮虫支靠近系统树的顶端且与海水寄主寄生车轮虫聚支, 表明其与海水寄主寄生车轮虫的亲缘关系较近, 且在系统进化中分化较晚。这可能是由于罗非鱼为广盐性的经济养殖鱼类, 在世界各地之间进行广泛地引种养殖中, 或许在引种过程中的检疫不严格等原因将海水环境中的刺纹车轮虫带入淡水领域。
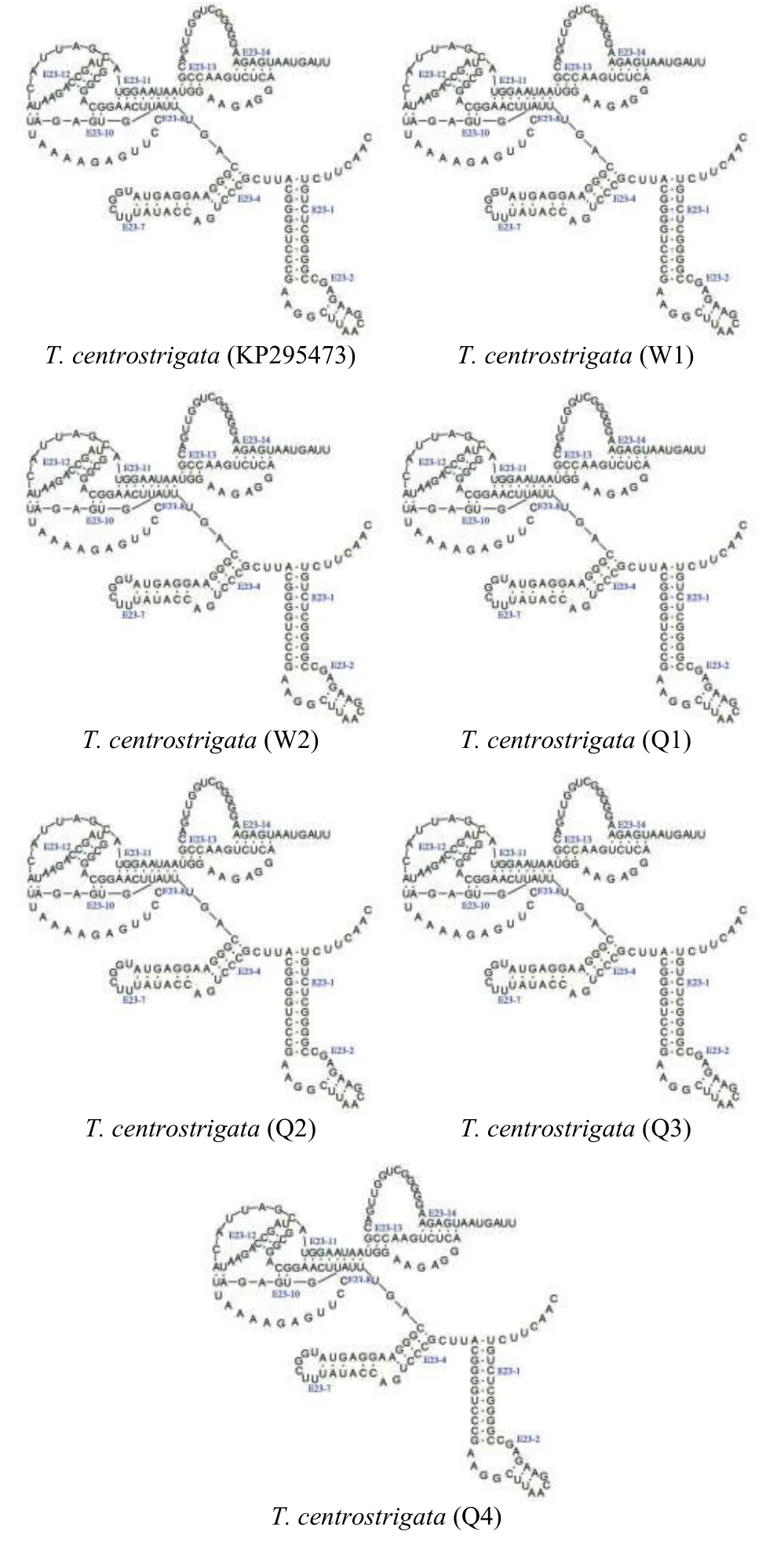
图 4 刺纹车轮虫3种群的18S rRNA V4区的比较Fig. 4 The V4 region of the 18S rRNA secondary structure for T.centrostrigata
3.2 寄主偏好性

图 5 刺纹车轮虫3种群的18S rRNA V5和V7区的比较Fig. 5 V5 and V7 regions of the 18S rRNA secondary structure for T. centrostrigata
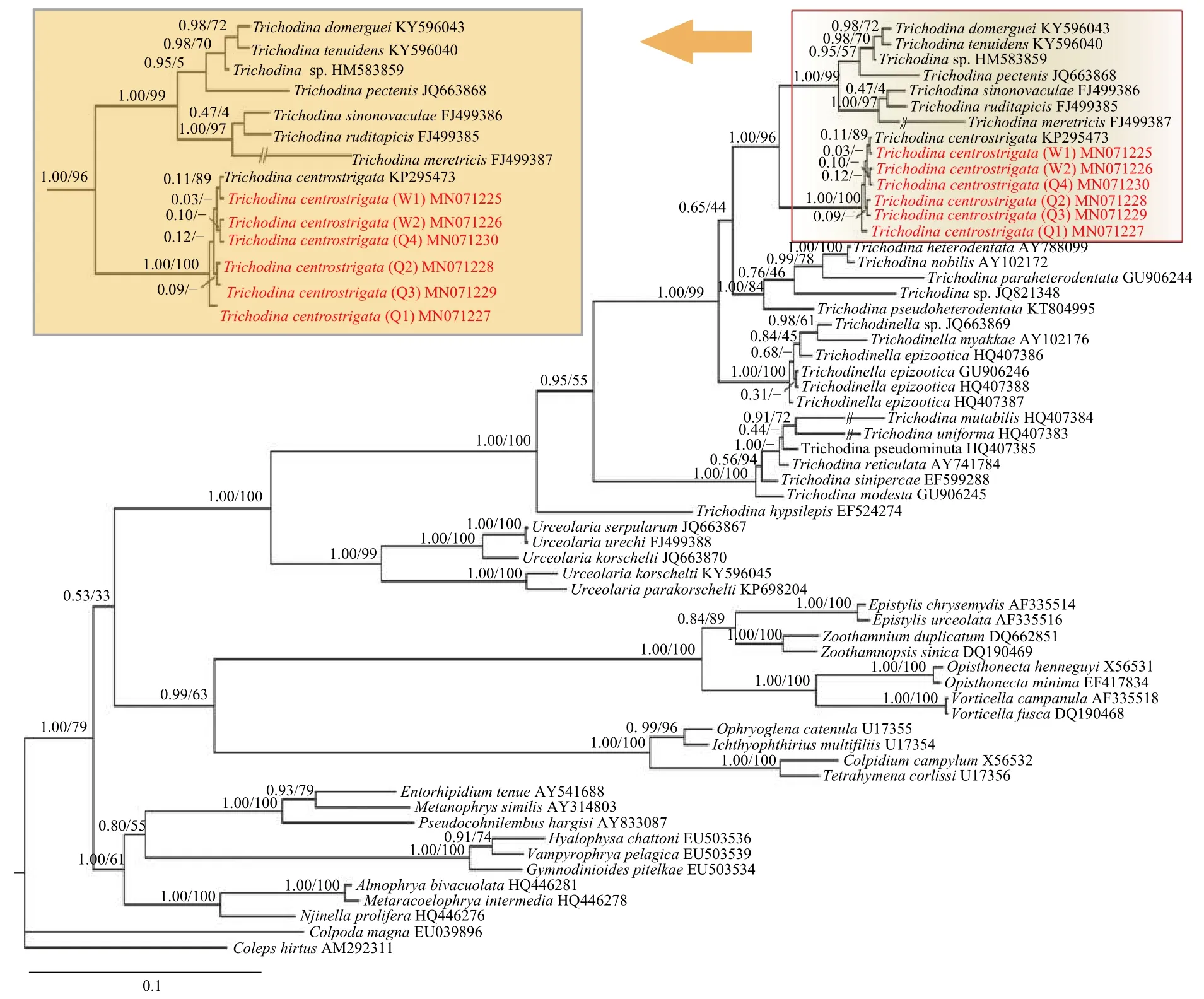
图 6 基于BI法与ML法构建的18S rDNA系统发育树Fig. 6 Phylogenetic tree based on 18S rDNA sequences by BI and ML analyses
刺纹车轮虫首次由Basson等[11]发现于南非的鲈形目鱼类: 莫桑比克罗非鱼Oreochromis mossambicusPeters, 1852、南方褶唇丽鱼Pseudocrenilabrus philanderWeber, 1897、斯氏罗非鱼Tilapia sparrmaniiSmith, 1840、伦氏罗非鱼Tilapia rendalliBoulenger, 1896与鲤形目淡水鱼类: 鲤Cyprinus carpioLinnaeus, 1758的鳃表, 偶见于体表和鳍条。1986年, El-Tantawy和Kazubski[12]在埃及尼罗河三角洲从鲈形目鱼类: 尼罗罗非鱼Oreochromis niloticaLinnaeus, 1758的鳃表检获到刺纹车轮虫。同年, Van As和Basson[7]在中国台湾从养殖的莫桑比克罗非鱼鳃表发现此虫种。1992年, Van As和Basson[13]在南非地区多次发现此虫种, 其寄生于鲈形目寄主长体伴丽鱼Hemichromis elongatusGuichenot,1861与窄头鮨丽鱼Serranochromis angusticepsBoulenger, 1907的鳃表、南方褶唇丽鱼与安德森罗非鱼Oreochromis andersoniCastelnau, 1861的鳃表、体表及鳍、伦氏罗非鱼的鳃表、斯氏罗非鱼体表及鳍; 寄生于鲤形目寄主鲃Barbussp. 与野鲮Labeo cylindricusPeters, 1852的鳃表、缺帘鱼Brycinus lateralisBoulenger, 1900的鳃表及体表, 还寄生于鲶形目的狮纹歧须Synodontis leopardinusPellegrin, 1914的鳃表。1994年, Basson和Van As[9]在中国台湾的莫桑比克罗非鱼的鳃表、皮肤及鳍条均获得该虫种。2002年, Rodríguez-Santiago[14]在墨西哥锡那罗亚地区的尼罗罗非鱼的鳃表和鳍条上检获到该虫种; 2005年, 唐发辉等[15]在中国重庆地区鲤形目鱼类: 鲫Carassius auratusLinnaeus,1758的鳃表获得该虫种。2006年, Mitra和Bandyopadhyay[16]在印度从莫桑比克罗非鱼的鳃表发现该虫种。之后, 姜艳妍等[17]在广西地区于养殖鱼塘或自然水体中的单性奥尼系列、吉富系列罗非鱼的鳃表检获到此虫。王琴等[18]于2014年在中国重庆江津区养殖鱼场的单性奥尼系列罗非鱼鳃表检获此虫种; 而在本研究中, 两次不同时期的采样均从单性吉富系列罗非鱼获得刺纹车轮虫。上述研究表明: 刺纹车轮虫主要寄生于鲈形目的罗非鱼,故罗非鱼对刺纹车轮虫具有较明显的易感性。换言之, 该类病原同时也对罗非鱼表现出较显著的寄生特异性或宿主偏好性。
在本研究中, 尽管两次调查样本量不同, 感染率均为100% (种群2样本量相对较少, 有待进一步深入调查), 但其感染强度较低, 均为轻度感染(表 1)。推测这种高感染率、低感染强度的寄生方式, 有助于刺纹车轮虫在尽量减轻对寄主伤害的同时来寻求更多寄主的庇护, 以维持自身种群的繁衍。虽然本研究调查涉及的寄主罗非鱼暂未表现出明显的病症, 但刺纹车轮虫仍然是一类在水产养殖中不可忽视的潜在病原, 故在罗非鱼养殖业中仍值得渔民高度关注。
