定量代谢物组学研究硫酸铵添加对高产红色糖多孢菌生理代谢的影响
2020-12-10原玉洁黄明志
徐 峰,原玉洁,黄明志,储 炬
(华东理工大学生物工程学院生物反应器国家重点实验室,上海 200237)
红霉素是由红色糖多孢菌产生的一类大环内酯类抗生素,其抗菌谱与青霉素G相似,但比青霉素宽[1-3]。红霉素主要结合致病微生物的核糖体50S亚基,影响其蛋白质合成,限制微生物的生长以达到抑菌作用[4-5]。根据侧链的结构,主要分为红霉素A(Er-A)、红霉素B(Er-B)、红霉素C(Er-C)和红霉素D(Er-D)。最有效和临床上最重要的成分是红霉素A[6-7],其余成分以Er-A的生物合成途径中的中间体形式存在。因此,在发酵阶段,可以通过提高Er-A的产量,减少其他副产物的生成,以降低生产成本和工业废料。
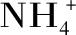
微生物代谢物组(metabolomics)研究的主要内容是通过对微生物在一定培养条件下的胞内和胞外大部分代谢物进行定性和定量分析,来解释微生物的一些代谢特征[12]。通过对胞内代谢物浓度水平进行分析可以找到代谢网络中的限制因素。同位素稀释质谱法(IDMS)已广泛应用于代谢物组学研究[13-15]。其中用全标记13C代谢物作为内标的方法被称为13C同位素稀释质谱法(13C IDMS)。13C IDMS方法还能避免传统胞内代谢物测定过程中对整个过程中每个步骤的回收率的评估。研究人员通过代谢组学研究发现一些难以达到平衡的反应,如磷酸果糖激酶催化的反应和丙酮酸激酶催化的反应是糖酵解途径的主要调控步骤[16]。但是,利用代谢物组学研究抗生素合成过程中氮源对胞内中心碳代谢影响的报道较少。深入了解红霉素工业生产菌的代谢特性,使培养工艺与细胞代谢相互适配,是提高红霉素产量、降低生产成本,从而让企业具备竞争力的关键。
本研究将基于13C辅助的定量代谢物组学技术用于考察硫酸铵添加对高产红色糖多孢菌生理代谢的影响,并探讨了硫酸铵添加后细胞生理代谢变化的调控机理,以期利用代谢物组学分析寻找红霉素合成中的代谢瓶颈,实现针对性补料,进一步提高底物利用效率,降低成本。
1 材料与方法
1.1 材料与仪器
红色糖多孢菌S.erythraea(Saccharopolysporaerythraea)E3-ΔsucC菌株 该菌株是对S.erythraeaE3菌株进行单交换敲除基因sucC(SACE_6669)得到,具有抗性筛选标记阿泊拉菌素Aprr、硫链丝菌素Tsrr,该菌株保藏在本实验室菌种库;淀粉、玉米浆、氯化钠、硫酸铵、琼脂、碳酸钙、葡萄糖、磷酸氢二钾、磷酸二氢钾、七水硫酸镁、氯化钴、硼酸钠、三氯化铁、氯化铜、钼酸铵 分析纯,凌峰化学试剂有限公司(上海);丙氨酸、精氨酸、半胱氨酸、丝氨酸 分析纯,泰坦科技股份有限公司(上海);衍生剂、乙腈 质谱纯,阿拉丁生化科技股份有限公司(上海)。
SPY50回转式摇床 离心机械研究所(上海);LGJ-10D冷冻干燥机 慕泓真空设备有限公司(上海);RapidVap真空旋转蒸发仪 LABCONCO公司(美国);TGL-16A台式高速离心机 悦丰仪器仪表有限公司;FE20 pH电极 Mettler Toledo仪器;InPro6800溶氧电极 Mettler Toledo仪器;5 L发酵罐 国强生化工程装备有限公司(上海);Agilent 1100 series 高效液相色谱 Agilent公司(美国)。
1.2 实验方法
1.2.1 培养基的配制 平板培养基:淀粉10 g/L、玉米浆13 g/L、NaCl 3 g/L、(NH4)2SO43 g/L、琼脂20 g/L、CaCO33 g/L,pH7.0,121 ℃灭菌20 min[17]。
摇瓶培养基:淀粉40 g/L、蛋白胨20 g/L、NaCl 4 g/L、KH2PO40.2 g/L、MgSO4·7H2O 0.25 g/L、CaCO31.5 g/L,pH7.0,121 ℃灭菌20 min;葡萄糖10 g/L单独于115 ℃灭菌20 min[17]。
发酵合成培养基:K2HPO41.28 g/L、KH2PO40.64 g/L、MgSO4·7H2O 1 g/L、丙氨酸0.86 g/L、精氨酸0.68 g/L、半胱氨酸0.78 g/L、丝氨酸0.73 g/L、CoCl2·6H2O 0.009 g/L、Na3BO30.06 g/L、FeCl30.0068 g/L、CuCl20.00027 g/L、(NH4)2MoO40.00027 g/L,pH7.0,121 ℃灭菌20 min;葡萄糖22 g/L单独于115 ℃灭菌20 min[17]。
1.2.2 培养方法 平板种子培养:在倒平板之前,向平板培养基中加入抗生素阿泊拉霉素(浓度为50 μg/mL)和硫链丝霉素(浓度为100 μg/mL)。之后用接种环从保存有高产红色糖多孢菌E3-ΔsucC的甘油管中蘸取菌种,均匀涂布于平板上,放置在34 ℃恒温培养箱中培养7 d。待菌落均匀分布于平板上且呈灰白色时进行下一步培养。
摇瓶种子培养:在平板上挖取1 cm2携带有菌种的小块,并接种至锥形瓶中,再倒入5 mL葡萄糖溶液,转速为220 r/min,34 ℃培养48 h。
5 L发酵罐培养:用灭菌的生理盐水清洗种子液,首先将种子液在4000 r/min条件下离心5 min,然后倒出上清液,此时倒入30 mL灭好菌的生理盐水,反复振荡重悬菌体,然后在4000 r/min条件下离心5 min,将上清倒出,重复上述操作两次,之后再分别向离心管中倒入50 mL灭过菌的去离子水,振荡重悬菌体得到菌悬液,接种量为10%。火焰圈接种法将菌悬液、葡萄糖和微量元素倒入5 L发酵罐中,装液量为3 L,并设置好通气量3000 mL/min和转速400 r/min、发酵温度34 ℃,之后维持整个发酵过程中的溶氧水平大于30%。发酵至60 h后,添加10 g/L葡萄糖和按0.01 g·(L·h)-1流加硫酸铵。其余发酵条件一致。整个发酵过程通过biostar软件采集溶氧、pH、OUR、CER、通气量、转速、温度等在线参数。
1.2.3 检测方法
1.2.3.1 菌体干重 取5 mL发酵液,将菌悬液倒入事先称量好的滤纸上,用抽滤装置进行抽滤。将过滤后的滤纸放入80 ℃的烘箱中放置24 h。称出带有菌体的滤纸重量,计算出菌体干重DCW[18]。按照公式(1)计算比生长速率。
式(1)
其中,X表示菌浓,g/L;t表示时间,h;μ表示比生长速率,h-1。
1.2.3.2 葡萄糖浓度测定 使用DNS比色法进行测定[19]。按照公式(2)计算比葡萄糖消耗速率。
式(2)
其中,X表示菌浓,g/L;S表示底物浓度,g/L;μ表示比生长速率,h-1;qS表示底物比消耗速率,mmol/L/h。
1.2.3.3 红霉素效价测定 采用磷酸分光光度法进行检测[20]。采用磷酸水解法,即红霉素经过磷酸水解后生成黄色物质,该物质于483 nm处有极大吸收值。
按照公式(3)计算比红霉素速率。
式(3)
其中,X表示菌浓,g/L;P表示产物浓度μg/mL;μ表示比生长速率,h-1;qP表示产物比合成速率,mmol/L/h。
1.2.3.4 发酵过程尾气氧气和二氧化碳组分含量的测定 使用过程质谱仪(MAX300-LG,Extrel,USA)测定废气中氧气和二氧化碳的体积分数。使用Parekh等[22]描述的方法在线计算氧消耗速率(OUR)和二氧化碳合成速率(CER)。OUR(Oxygen Uptake Rate)是指单位时间、单位体积发酵液细胞消耗的氧量,CER(Carbon-dioxide Escape Rate)是指单位时间、单位体积发酵液细胞释放的二氧化碳量。按照公式(4)计算比氧气消耗速率和比二氧化碳合成速率。
式(4)
式(5)
其中,X表示菌浓,g/L;OUR表示氧消耗速率mmol/L/h;CER表示二氧化碳合成速率mmol/L/h;qO2表示比氧气消耗速率,mmol/g/h;qCO2表示比二氧化碳合成速率,mmol/g/h。
1.2.3.5 红霉素各组分测定 通过高效液相色谱检测红霉素各组分含量。检测条件:色谱柱采用Water XBridge C18柱,4.6 mm×250 mm,5 μm(Water Corporation,Ireland);流动相为0.025 mol/L的磷酸氢二钾缓冲液∶乙腈=60∶40;在流速为0.9 mL/min、柱温为35 ℃、检测器为紫外光检测器、且检测波长为215 nm、进样量为20 μL条件下进行红霉素各组分测定。
1.2.3.6 有机酸与氨基酸类的测定 样品前处理:取样5 mL,用抽滤瓶过滤。然后用15 mL去离子水清洗3次,然后将滤纸投入含有20 mL液氮的50 mL离心管中。
沸乙醇提取:向样品中加入25 mL煮沸的75%乙醇;然后在沸水浴中提取5 min;接着在振荡器上振荡30 s;接着将样品在8000 r/min,室温条件下离心5 min,将上清液通过0.45 μm的水相滤头;然后将上清液转入旋转蒸发仪(真空度为10 Pa,转速为50 r/min,温度为40 ℃)蒸发至底部有少许残余;接着用300 μL去离子水溶解样品;最后用0.22 μm滤头过滤后转入样品瓶。
衍生:吸取100 μL待测样品到内衬管中,加入20 μL13C内标,内衬管置于进样瓶(GC-vials)中用两层保护膜包好。将所有样品放入-80 ℃冰箱冷冻30 min,将样品放入冷冻干燥机(真空度为10 Pa,冷凝温度为-60 ℃),抽干过夜,准备衍生。在通风橱中先取75 μL乙腈(或新配制的甲氧胺吡啶)到各内衬管中,再加入75 μL N-(特丁基二甲基硅烷)-N-甲基三氟乙酰胺(MTBSTFA);盖好盖子,放入70 ℃烘箱静置60 min;待样品冷却至室温后,将内衬管转移至1.3 mL离心管中,12000 r/min离心3 min;最后将上清液转移至干净的内衬管中,放到GC-vials中,准备进样。
GC-MS参数设置为:气相毛细管柱为HP-5MS(30 m×0.25 mm×0.25 μm)(Agilent,America),进样量为1 μL,柱温为280 ℃,分流比为不分流,载气为氦气,载气流速为1 mL/min,传输线温度为250 ℃,离子源温度为230 ℃,四级杆温度为150 ℃,温度梯度设置为100 ℃保持1 min,然后10 min内以10 ℃/min的速度升至320 ℃。检测方法:全扫描模式。
根据无干扰且信号强的原则,选取的氨基酸碎片如表1所示。采用这些碎片进行同位素信息分析可以避免干扰,并能提高检测的灵敏度。

表1 采用GC-MS分析氨基酸同位素信息过程中所选取的碎片
1.3 数据处理
所有实验均重复三次,数据处理软件、数据分析软件、绘图软件采用Microsoft Excel 2019进行编辑。
2 结果与分析
2.1 硫酸铵添加对菌体表观生理参数影响
高产红色糖多孢菌在补料分批发酵过程后期添加硫酸铵对菌体表观生理参数的影响如图1所示。高产红色糖多孢菌发酵过程分为两个阶段,菌体生长期(12~48 h)和红霉素合成期(48~144 h),培养前12 h,菌体处于延滞期;12~48 h,菌体开始大量合成,菌体干重由1.1 g/L增长至8.4 g/L。48 h之后,菌体量开始逐渐下降,红霉素开始大量合成。在60 h添加硫酸铵后,菌浓于132 h后开始大量减少,而对照组则在72 h后明显下降。最终红霉素效价从830 μg/mL提高至1126 μg/mL。0~48 h、0~36 h,比二氧化碳合成速率与比氧气消耗速率分别呈现上升趋势,由0.7、0.9 μmol/L/h分别增长至1.8、2.4 μmol/L/h,说明该阶段菌体呼吸代谢旺盛。48 h之后两组实验的比二氧化碳合成速率与比氧气消耗速率均开始下降,60 h添加硫酸铵后出现二次上升,表明菌体代谢活性可能得到提高。高产红色糖多孢菌在60~144 h期间,其比红霉素合成速率和比葡萄糖消耗速率均一直在降低,但在添加硫酸铵后其比红霉素合成速率和比葡萄糖消耗速率分别比对照组提高了30.0%、47.2%。基于发酵过程中各参数间相关性分析,硫酸铵添加后各比速率水平提高,表明氮源的添加与菌体的生长过程耦合,未添加硫酸铵的批次在红霉素合成期可能出现菌体自溶现象,分析菌浓开始大量下降可能是氮源不足所致。
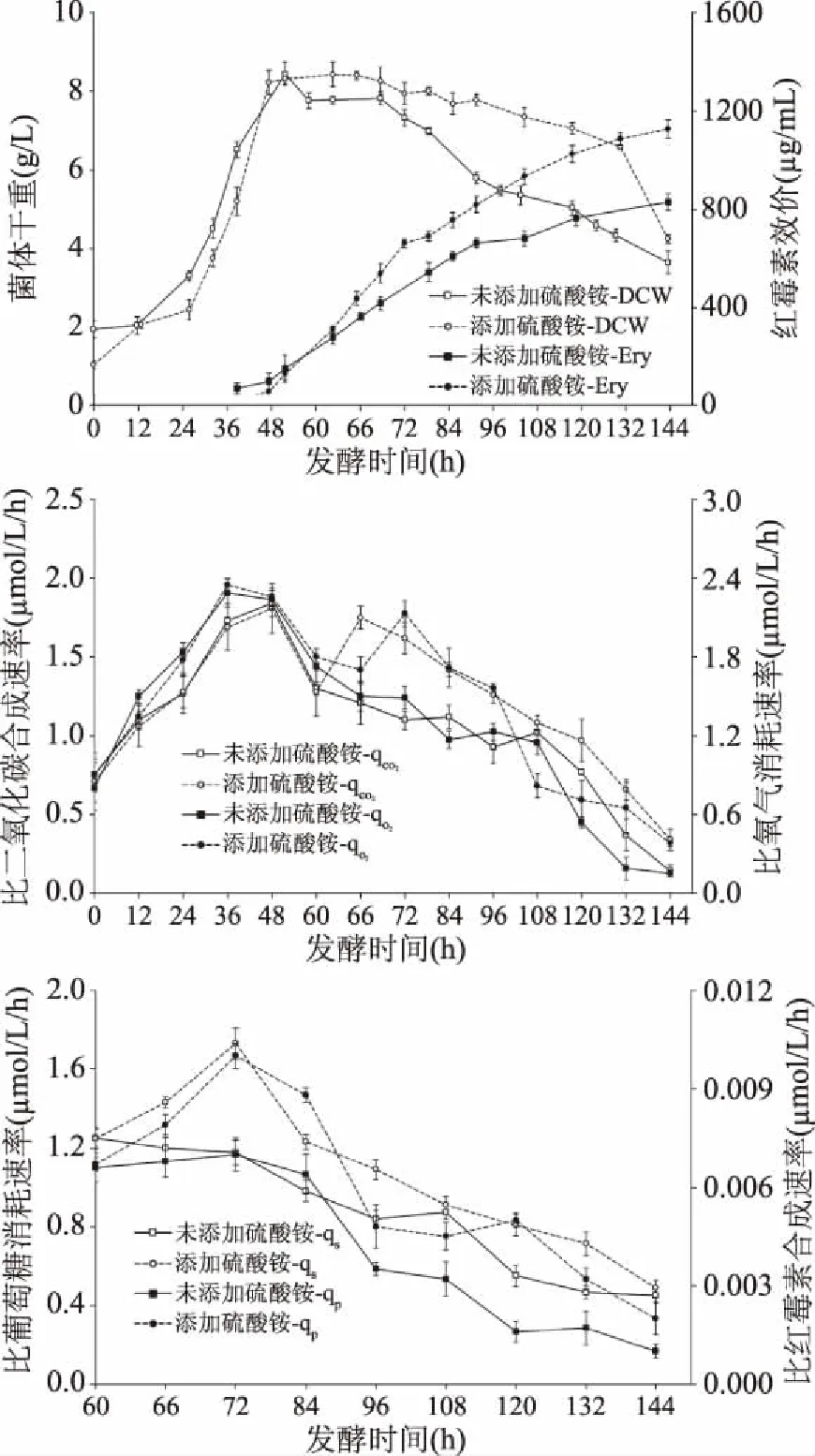
图1 5 L罐中添加硫酸铵与未添加硫酸铵表观生理参数
2.2 硫酸铵添加对红霉素组分的影响
如表2所示,与对照组相比,发酵60 h补加硫酸铵后,在不同时间点测定红霉素各组分浓度,结果发现添加硫酸铵后不仅红霉素A组分的比例从802.9 μg/mL提高到956.1 μg/mL,红霉素C的转化率在96 h达到99.2%,而对照组最高为84.1%。而且随着添加硫酸铵时间的变化(120~144 h),红霉素A组分浓度维持在一个较高的水平99.0%,对照组则呈现一个下降的趋势(由84.1%降到81.4%)。红霉素A的生物合成过程主要是6-脱氧红霉内酯的形成和后修饰形成红霉素D,然后红霉素D先在大环内酯12位碳原子上先羟基化形成红霉素C,再通过甲基化形成红霉素A[1]。添加硫酸铵后,红霉素A组分的变化非常显著(98.7%~99.2%),而对照组的红霉素A比例则相对较低(81.4%~84.1%),红霉素A组分的提高说明添加硫酸铵可能提高了红霉素C的甲基化过程。

表2 高产红色糖多孢菌未添加与添加硫酸铵实验红霉素各组分浓度
2.3 硫酸铵添加对胞内代谢物的影响
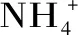

图2 5 L罐中胞内有机酸浓度随时间变化趋势
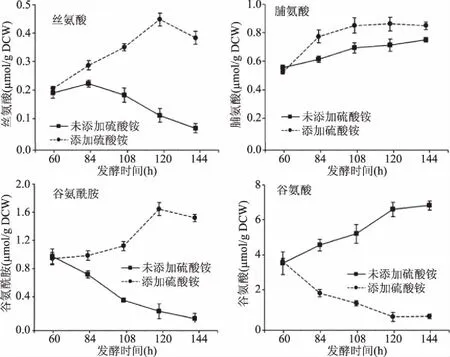
图3 5 L罐中胞内菌体合成前体氨基酸浓度随时间变化趋势

图4 5 L罐中胞内红霉素合成前体氨基酸浓度随时间变化趋势
图3表示添加硫酸铵对高产红色糖多孢菌发酵后期菌体合成前体类氨基酸的影响,添加硫酸铵后,脯氨酸浓度从0.53 μmol/g DCW提高到0.85 μmol/g DCW,丝氨酸浓度从0.20 μmol/g DCW提高到0.38 μmol/g DCW,谷氨酰胺浓度从0.94 μmol/g DCW提高到1.52 μmol/g DCW,这些氨基酸浓度的提高有利于补充菌体合成所需的前体物质,表明添加硫酸铵对菌体生长有促进作用。图4表示添加硫酸铵对高产红色糖多孢菌发酵后期红霉素合成前体类氨基酸的影响,其中丙酰辅酶A类合成前体包括天冬氨酸、苏氨酸、异亮氨酸。60 h添加硫酸铵后,天冬氨酸浓度从0.48 μmol/g DCW提高到1.46 μmol/g DCW,苏氨酸浓度从0.05 μmol/g DCW提高到0.08 μmol/g DCW,异亮氨酸浓度从0.45 μmol/g DCW提高到0.93 μmol/g DCW,这些氨基酸浓度的提高有利于红霉素合成所需的前体供应,表明发酵后期添加硫酸铵不仅可以提高菌体的初级代谢,也能改善菌体的次级代谢。
3 讨论
红霉素是我国目前年产量达万吨的抗生素产品之一,随着不断拓宽的临床用途和新一代半合成红霉素的开发,红霉素的需求和应用市场日趋活跃。对于红霉素氮源调控及相关研究中,Zou等[11]、Chen等[24]报道了氮源添加种类、氮源添加比例以及氮源磷源共调节等对红霉素发酵过程的影响,表明氮源对提高红霉素发酵单位有显著的提高。在本研究中,添加硫酸铵后最终红霉素效价从830 μg/mL提高至1126 μg/mL。
在红霉素发酵过程中,杂质组分Er-C向有效组分Er-A的转化过程也受到工艺条件的影响,李啸等以促进甲基化反应和强化基础代谢为主要手段,在发酵后期127 h,向发酵液中流加ATP、L-Met、MgSO4和柠檬酸,Er-A的比例由原来的73%提高到88%以上[25]。吕伟等在摇瓶培养过程初始添加0.05%的甘氨酸,红霉素产量明显提高(72.2%),Er-A组分相对百分含量提高9.7%,Er-C组分减少78.7%,在50 L发酵罐验证结果红霉素产量达到8939 U/ml,比对照提高12.2%,Er-A:Er-C从5.1∶1提高到8.2∶1[26]。pH控制发酵是提高红霉素A合成的有效手段,Elmahdi等报道在恒pH7.0条件下,Er-A∶Er-C组分从2∶1提高到11∶1,而Er-B组分未检测出,说明pH环境控制对Er-C转化Er-A组分中两个关键酶EryG和EryK的活性都有显著的影响[27]。李桢林等[28]在利用必特螺旋霉素基因工程发酵生产必特螺旋霉素,也发现过程补加铵离子也明显改善必特螺旋霉素组分。
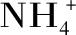

图5 红霉素C转化成红霉素A的过程
胞内氨基酸是菌体蛋白和红霉素前体合成的重要物质,因此胞内氨基酸浓度水平对于了解发酵后期菌体蛋白合成与红霉素前体供应过程中的代谢特征具有重要意义。红霉素合成前体主要由丙酰辅酶A和甲基丙二酰辅酶A所组成,其中丙酰辅酶A合成的主要来源则主要为转氨后的碳骨架与部分短链脂肪酸[29-30],另外部分分支氨基酸也可以在胞内转化成丙酰辅酶A。Hong等[31]利用同位素标记实验发现脯氨酸能够进入TCA循环通过分解代谢提供能量和辅因子,同时脯氨酸也可直接用于合成红色糖多孢菌。另外,硫酸铵进入TCA循环促进α-酮戊二酸转化成谷氨酸,然后通过转氨作用使得胞内谷氨酸水平下降,合成大量的谷氨酰胺,从而进一步促进菌体生长。该结果也同时表明添加硫酸铵在红霉素的生产过程中具有巨大潜力。在进一步的研究过程中,可以通过发酵调控来维持高产红色糖多孢菌较高的比红霉素合成速率,有望极大提高工业红霉素的产量。
4 结论
本研究将基于13C辅助的定量代谢物组学技术用于考察硫酸铵添加对高产红色糖多孢菌生理代谢的影响,并探讨了硫酸铵添加后细胞生理代谢变化的调控机理。表观生理代谢参数表明于60 h开始添加硫酸铵后菌体代谢活性得到提高,最终红霉素效价从830 μg/mL提高至1126 μg/mL,红霉素A组分的比例从802.9 μg/mL提高到956.1 μg/mL,红霉素C的转化率在96 h达到99.2%。定量代谢物组学结果表明添加硫酸铵后胞内有机酸水平差异明显,其中α-酮戊二酸浓度的降低(4.15 μmol/g DCW降到1.05 μmol/gDCW)有利于菌体的生长维持。对于胞内氨基酸水平而言,添加硫酸铵后,胞内菌体合成前体类和红霉素合成前体类氨基酸均有所提高,如脯氨酸、丝氨酸、天冬氨酸、异亮氨酸分别提高了60.4%、90.0%、204.2%、106.7%,表明添加硫酸铵之后不仅能够促进高产红色糖多孢菌的初级代谢,也在一定程度上刺激了次级代谢的提高。
