DKK3下调IL-32β对宫颈癌细胞增殖、凋亡、迁移、侵袭的影响
2020-12-09毕春燕王保莲王文翔田鹏飞任国平
毕春燕 王保莲 王文翔 田鹏飞 任国平
(新乡市中心医院 1产科三,河南 新乡 453000;2妇瘤科;3检验科)
宫颈癌是最常见的女性生殖道恶性肿瘤,在全球妇女常见肿瘤中排第三位,仅次于结肠癌和乳腺癌,在发展中国家是仅次于乳腺癌居第二位的常见肿瘤。世界卫生组织的数据显示,全球每年新增病例53万例,因宫颈癌死亡的女性约有25万例,并且高发地区扔是发展中国家,占全球的80%以上〔1,2〕。可以看出宫颈癌对全球广大女性的健康已造成严重威胁,因此阐明宫颈癌的发病机制,对改善宫颈癌的诊断方法和提高疗效意义重大。
Wnt通路拮抗基因(DKK)3是Dickkopf家族的一种分泌性糖蛋白,是Wnt信号通路的拮抗因子〔3〕。近年研究发现,DKK3在多种人类肿瘤细胞系和肿瘤组织中低表达,如在乳腺癌、骨肿瘤、胃肠道肿瘤、卵巢癌、肝癌等肿瘤中表达下调〔4〕,并作为抑癌基因参与相应肿瘤的发生发展。已有研究表明,DKK3在宫颈鳞癌、子宫内膜癌组织中表达下调,低表达DKK3患者的生存率明显下降,且DKK3表达量随着组织分期程度的升高而降低〔5,6〕,DKK3过表达可抑制β-catenin的表达,且过表达DKK3可抑制宫颈癌细胞生长〔7〕。最近的研究指出,miR-92a通过抑制DKK3表达在一定程度可促进宫颈癌细胞的存活和侵袭〔8〕。DKK3影响宫颈癌细胞生物学行为的具体机制尚不完全清楚,有关DKK3对宫颈癌细胞迁移和侵袭方面的研究还未见报道,因此本课题就DKK3对宫颈癌细胞生物学行为的影响及可能的分子机制进行研究。
1 材料与方法
1.1材料 宫颈癌Hela、SiHa细胞株和正常宫颈Ect1/E6E7细胞株均购自中国科学院上海细胞所;RPMI1640培养基购于HyClone;胎牛血清和脂质体Lipofectamine2000均购于Thermo;Trizol RNA 提取试剂购于康为世纪;DKK3和GAPDH及相关抗体购于Santa Cruz,它们各自引物序列由南京金斯瑞公司合成;Cell Lysis Buffer裂解液、结晶紫染色液、蛋白浓度测定试剂盒和蛋白抽提试剂盒购于上海碧云天公司;CCK-8试剂和胰蛋白酶购于美国Sigma公司;细胞凋亡试剂盒购于南京凯基公司;Transwell小室购于Millipore。
1.2方法
1.2.1细胞培养 采用含10%胎牛血清、100 U/ml青霉素及100 μg/ml链霉素的DMEM培养基对宫颈癌Hale、SiHa细胞和正常宫颈癌Ect1/E6E7细胞进行培养。设置培养箱的培养环境为37℃、5%CO2、相对湿度90%。细胞培养密度为(1~10)×105/cm2,呈贴壁生长,每2~3 d传代一次,取对数生长期的细胞用于后续实验。
1.2.2RT-PCR检测 利用TRIzol试剂提取Hela、SiHa和Ect1/E6E7细胞中总RNA,并以总RNA为模板,逆转录合成cDNA。再以cDNA为模板进行PCR扩增。其中DKK3和内参GAPDH引物序列根据NCBI GenBank中人源cDNA序列,由南京金斯瑞公司合成,相关引物序列如下:DKK3正义链:5′-GATGCCCTTGTGCCAGT-3′,反义链:5′-TGCCAACTTCATACTCATCGG-3′;GAPDH正义链:5′-GTGGACATCCGCAAAGAC-3′,反义链:5′-AAAGGGTGTAACGCAACTA-3′。以GAPDH作内参,2-△△Ct法计算各基因mRNA的相对表达水平。每个样品孔重复检测3次,取均值。
1.2.3Western印迹检测 采用Cell Lysis Buffer 裂解细胞,提取总蛋白并用二喹啉甲酸(BCA)法测定样品的浓度。按4∶1比列混合蛋白样品和蛋白上样缓冲液(5×)沸水浴变性后,取120 μg变性蛋白上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,转膜。在4℃下,将封闭后的聚偏氟乙烯(PVDF)膜放入已稀释的一抗(1∶1 000)中反应24 h。在Western洗涤液洗膜后,再在37℃下将PVDF膜转入稀释的二抗(1∶2 000)中反应2 h。避光条件下滴入发光剂显影,以凝胶成像系统采集图像,Image J分析目的条带的灰度值,以GAPDH为内参,目的蛋白的表达以目的条带灰度值与β-actin灰度值的比值表示。
1.2.4细胞转染 收集对数生长期的Hela、SiHa和Ect1/E6E7细胞,并以适当密度接到6孔板上。在培养细胞到细胞融合度为70%时,根据LipofectamineTM2000转染试剂使用说明将转染过表达DKK3的真核载体和pcDNA3.1空白载体分别转染到宫颈癌Hela细胞中,并分别标记为pcDNA3.1-DKK3组和pcDNA3.1组。转染6 h后换为含血清的新鲜培养液,再培养48 h。收集各组细胞,采用RT-PCR检测转染效果(参照1.2.2中的方法)。后续试验中,将Hela细胞随机分为si-DKK3组(转染沉默DKK3的siRNA)、si-NC组(转染沉默DKK3的阴性对照)、si-IL-32组(转染沉默IL-32的siRNA)、si-NC组(转染沉默IL-32的阴性对照)、pcDNA3.1-DKK3+pcDNA3.1组(pcDNA3.1-DKK3载体和pcDNA3.1空载体共转染)、pcDNA3.1-DKK3+ pcDNA3.1-IL-32组(pcDNA3.1-DKK3载体和pcDNA3.1-IL-32载体共转染)六组,采用上述方法转染后,进行后续实验研究。
1.2.5CCK-8检测细胞增殖 取对数生长期的各组Hela细胞,以每孔3×103个的密度接种于96孔板中。经相应处理后继续培养,在培养时间截止前2 h加入10 μl CKK-8溶液,放在5%CO2、37℃的培养箱中孵育2 h。450 nm波长处,酶标仪检测各孔的吸光度值。
1.2.6流式细胞术检测细胞的凋亡 采用AnnexinV/PI双染法,根据说明书的要求,简述步骤如下:消化细胞后,以1 000 r/min离心10 min,加入结合缓冲重悬细胞。避光及室温条件下加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),10 min后加入碘化丙啶(PI)染液,再染色5 min,后在激发波长为490 nm,发射波长为530 nm的条件下上机检测。
1.2.7Transwell法检测细胞迁移、侵袭细胞迁移实验如下:实验采用对数生长期的细胞,用0.25%的胰蛋白酶消化,离心后去上清,往上室内加入200 μl密度为2×108/L细胞悬液,下室加入500含有10%胎牛血清的RPMI1640培养基,将小室置于37℃、5%CO2的培养箱内孵育,24 h后取出上室,棉签擦去上室细胞,用4%多聚甲醛固定下室内的细胞15 min;用磷酸盐缓冲液(PBS)洗涤3次,再用0.1%结晶紫染色5 min,后用蒸馏水漂洗吹干后拍照。细胞侵袭实验在实验前用25 mg/L Matrigel 1∶4稀释液包被Transwell小室底部膜的上室面,4℃风干,后续步骤则同迁移实验。
1.3统计学处理 采用SPSS22.0软件进行t检验,方差分析,SNK-q检验。
2 结 果
2.1DKK3在宫颈癌Hela、SiHa细胞中表达下调 与正常宫颈癌Ect1/E6E7细胞相比,宫颈癌Hela、SiHa细胞中DKK3 mRNA及其蛋白表达显著下降(P<0.05)。见表1,图1。

表1 DKK3在宫颈癌Hela、SiHa细胞及正常宫颈Ect1/E6E7细胞中的表达情况

图1 DKK3蛋白的表达
2.2过表达DKK3对宫颈癌Hela细胞凋亡、迁移、侵袭及相关蛋白表达的影响 pcDNA3.1-DKK3组细胞中DKK3的蛋白表达水平显著高于pcDNA3.1组(P<0.05),成功构建了过表达DKK3的Hela细胞。转染24 h后,两组细胞的OD值差异不显著,而转染48 h和72 h后pcDNA3.1-DKK3组的OD值较pcDNA3.1组明显下降(P<0.05);pcDNA3.1-DKK3组的细胞凋亡水平较pcDNA3.1组显著升高(P<0.05),且DKK3过表达显著促进宫颈癌Hela细胞中Bax表达,抑制Bcl-2的表达,可见DKK3抑制细胞增殖,促进细胞凋亡。见图2,表2。
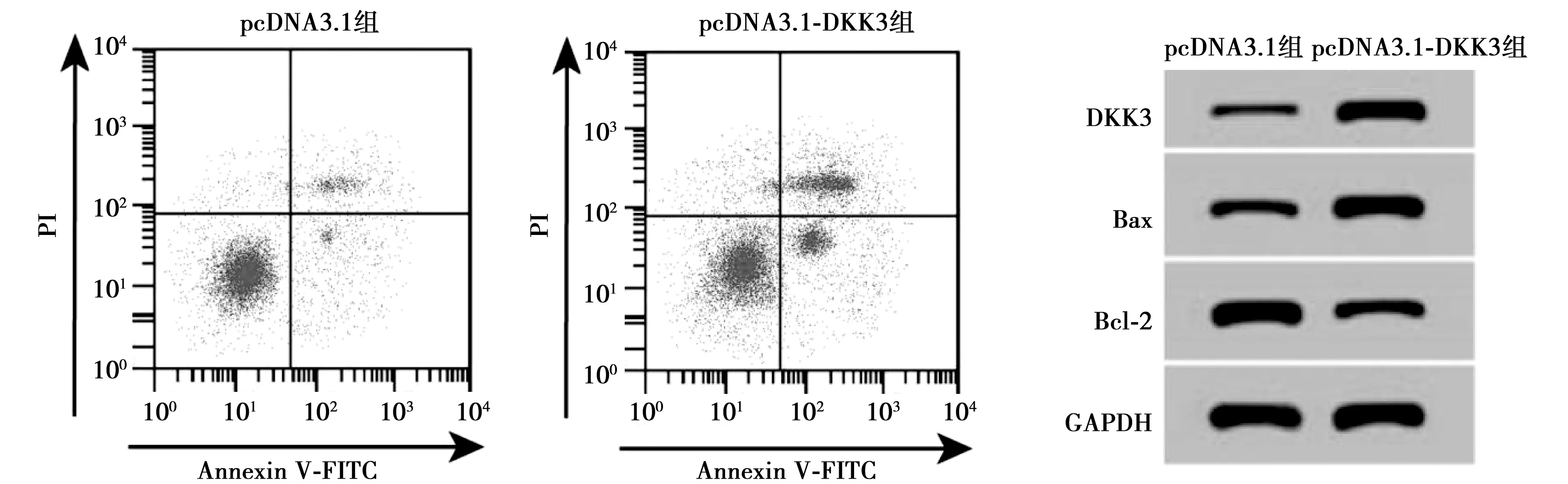
图2 过表达DKK3对宫颈癌 Hela 细胞活性凋亡及蛋白表达的影响
2.3DKK3抑制宫颈癌Hela细胞的迁移和侵袭pcDNA3.1-DKK3组细胞迁移和侵袭量明显低于pcDNA3.1组(P<0.05)。与pcDNA3.1组相比,pcDNA3.1-DKK3组中E-cadherin蛋白表达水平显著升高,MMP-2蛋白表达水平显著下降(P<0.05),可见DKK3过表达显著抑制细胞迁移和侵袭。见表2、图3。

图3 过表达 DKK3 对宫颈癌细胞 Hela 迁移、侵袭(结晶紫染色,×200)及蛋白表达的影响

表2 过表达 DKK3 对宫颈癌 Hela 细胞活性、凋亡、迁移、侵袭及相关蛋白表达的影响
2.4DKK3负向调控IL-32β的表达 pcDNA3.1-DKK3组Hale细胞中IL-32β的表达水平(0.21±0.02)较pcDNA3.1组显著下降(0.57±0.04,P<0.05),si-DKK3组Hale细胞中IL-32β的表达水平(1.02±0.07)较si-NC组显著升高(0.58±0.04,P<0.05)。见图4。

图4 IL-32β的表达
2.5IL-32β促进宫颈癌Hela细胞增殖、迁移和侵袭并抑制细胞凋亡 si-IL-32β组IL-32β蛋白表达量较si-NC组显著下降(P<0.05),可见沉默IL-32β的Hela细胞转染成功。转染24 h后,si-IL-32β组和si-NC组的OD值差异不明显,而转染48 h和72 h后,si-IL-32β组的OD值较si-NC组显著下降(P<0.05),可见沉默IL-32β能抑制细胞增殖。与si-NC组相比,si-IL32β组细胞Bax蛋白表达水平和细胞凋亡率显著上升,Bcl-2蛋白表达水平显著下降(P<0.05),可见沉默IL-32β对细胞凋亡具有促进作用。与si-NC组相比,si-IL-32β组MMP-2蛋白表达水平、细胞迁移和侵袭数量显著下降,E-cadherin 蛋白表达显著上升(均P<0.05),可见沉默IL-32β对细胞的迁移和侵袭具有抑制作用。见表3,图5。
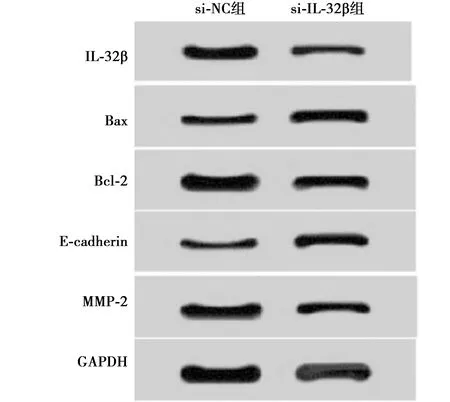
图5 抑制IL-32β对宫颈癌 Hela 细胞中蛋白表达的影响

表3 抑制IL32β对宫颈癌 Hela 细胞活性、凋亡、迁移、侵袭及相关蛋白表达的影响
2.6过表达IL-32β能逆转DKK3对宫颈癌细胞Hela增殖、凋亡、迁移和侵袭的影响 与pcDNA3.1组相比,pcDNA3.1-DKK3组细胞增殖、迁移和侵袭能力显著下降,细胞凋亡率显著上升(P<0.05);与pcDNA3.1-DKK3+pcDNA3.1组相比,pcDNA3.1-DKK3+pcDNA3.1-IL-32β组细胞增殖、迁移和侵袭能力显著上升,细胞凋亡率显著下降(均P<0.05)。与pcDNA3.1组相比,pcDNA3.1-DKK3组细胞中IL-32β、Bcl-2和MMP-2蛋白表达量显著下降,Bax、E-cadherin蛋白表达量显著上升(均P<0.05);与pcDNA3.1-DKK3+pcDNA3.1组相比,pcDNA3.1-DKK3+pcDNA3.1-IL-32β组细胞中IL-32β、Bcl-2和MMP-2蛋白表达量显著上升,Bax、E-cadherin蛋白表达量著下降(均P<0.05)。见图6,表4。
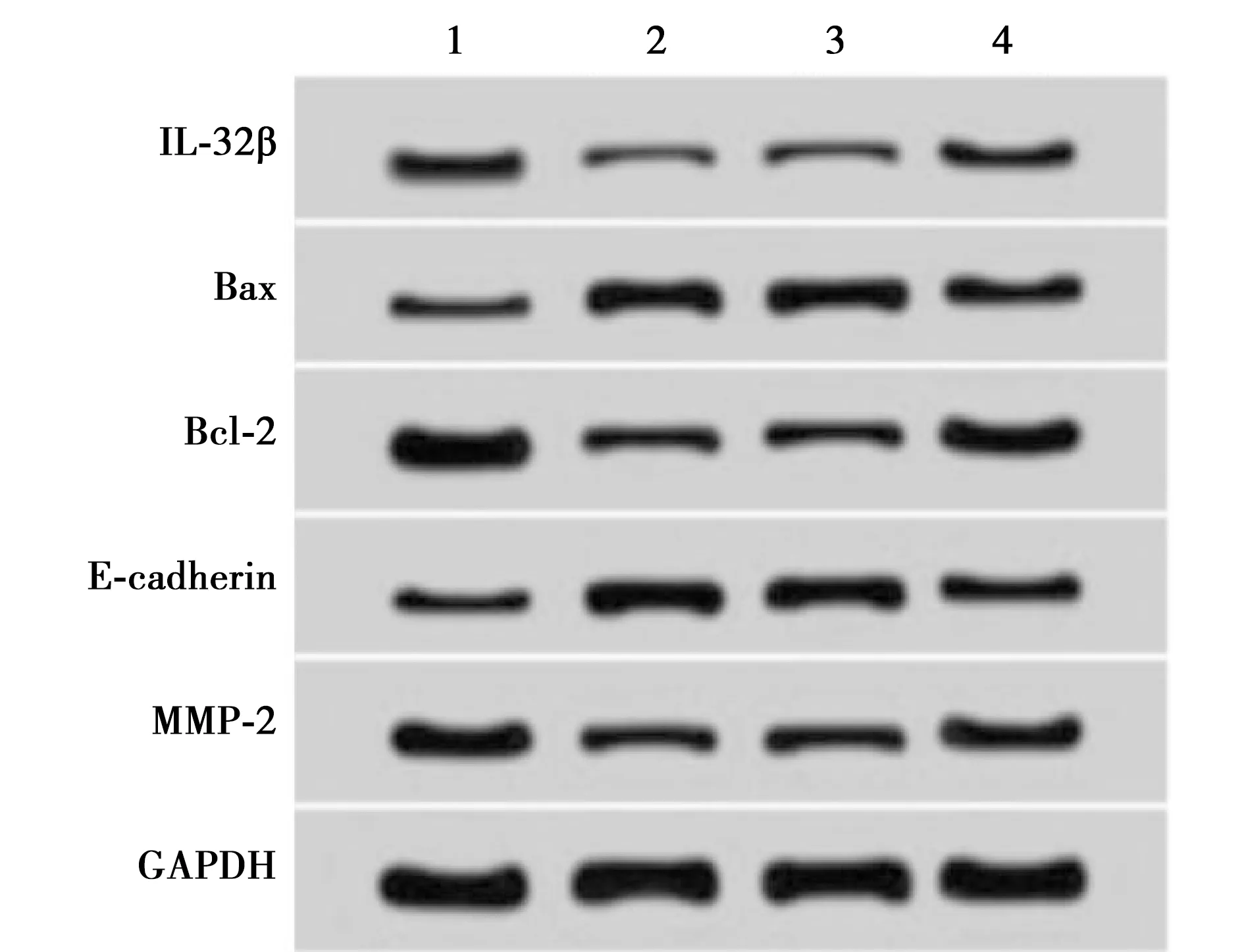
1~4: pcDNA3.1组、pcDNA3.1-DKK3组、pcDNA3.1-DKK3+pcDNA3.1组、pcDNA3.1-DKK3+pcDNA3.1-IL-32β组图6 过表达IL-32β影响 DKK3 对 Hela 细胞蛋白的表达

表4 过表达IL-32β影响 DKK3 对 Hela 细胞凋亡、迁移和侵袭及相应蛋白表达的作用
3 讨 论
宫颈癌是女性宫颈上皮细胞癌变而形成的肿瘤,是女性发病率和病死率最高的生殖道恶性肿瘤。目前宫颈癌的常用治疗方法是手术及放化疗,但对提高宫颈癌患者的生存率效果不显著〔9〕。目前研究证实,宫颈癌发病的重要原因是感染高危型人乳头瘤病毒(HPV),但有研究证实高危型HPV的感染对宫颈癌的发生是必要但不是充分条件〔10〕,HPV感染并不足以影响宫颈癌的发展〔11〕,所以阐述宫颈癌的发病机制,筛选出参与宫颈癌发生发展的关键性靶点,选择性阻断肿瘤相关信号通路是宫颈癌治疗的研究方向。
近年研究发现,DKK3基因是一种抑癌基因,其mRNA转录下调和蛋白表达缺失存在于多种人类肿瘤细胞系和肿瘤组织中〔12〕。DKK3首先是因为在肿瘤中的作用而被发现,它通过抑制wnt信号途径中Wnt/MMP-2、Wnt/β-连环蛋白、Wnt/JNK等通路发挥抑癌作用,并作为多种肿瘤的抑制剂被人们所熟知〔13,14〕。有研究表明,DKK3在宫颈鳞癌和子宫内膜癌组织中表达下调,且DKK3的表达量与癌组织分期和预后有关,但DKK3对宫颈癌细胞生物学行为的影响及其具体机制尚不完全清楚。本研究提示DKK3在宫颈癌中行使抑癌基因的作用。本研究发现过表达DKK3的宫颈癌Hela细胞的增殖能力显著下降,细胞的凋亡率显著上升,且过表达DKK3能促进细胞中相关凋亡蛋白Bax的表达,抑制Bcl-2的表达。其中Bcl-2家族被认为是细胞凋亡的主要调节机制,其按功能可以分为两类,一类像Bcl-2具有抑制凋亡作用,另一类像Bax具有促进凋亡作用〔15〕。上述实验表明DKK3能延缓宫颈癌细胞生长与先前研究结果一致〔7〕。本研究发现过表达DKK3组细胞的侵袭和迁移能力显著下降,并过表达DDK3能显著促进宫颈癌Hela细胞中相关侵袭蛋白E-cadherin的表达,抑制MMP-2的表达。其中E-cadherin是钙黏素家族的重要成员,能介导细胞间连接、维持细胞骨架和连接支架稳定性,其表达缺失将导致细胞间黏附能力下降或者缺失,是上皮间质转换(EMT)过程的关键性因素〔16〕;MMP-2是MMP家族成员,特异性的降解细胞外基质和基底膜的主要成分,是肿瘤侵袭过程中最重要的MMP〔17〕。上述实验进一步证实了DKK3对宫颈癌的肿瘤抑制功能,但是其相关作用机制尚不清楚。
据研究表明,炎性因子是肿瘤微环境的重要成分,对肿瘤的发生、发展、转移和侵袭关系密切〔18〕。IL-32是一种细胞因子可诱导IL-1β、IL-6等炎性介质的表达来起到抗炎或者促炎作用,且其可以通过不同信号通路如MMP-2、核因子(NF)-κB等来影响胃癌、乳腺癌、宫颈癌、肝癌、甲状腺癌等肿瘤的增殖、凋亡、迁移和侵袭〔19,20〕。IL-32可提高宫颈癌细胞C33A在低氧低糖条件下的生存率,通过提高血管内皮生长因子(VEGF)的表达水平来提升C33A细胞对低氧低糖环境的耐受〔21〕。IL-32β是IL-32主要的亚型,本研究说明DKK3负向调控IL-32β的表达。此外,沉默IL-32β抑制了宫颈癌Hela细胞的增殖、迁移和侵袭及促进其细胞凋亡,且沉默IL-32β促进Hela细胞中Bax、E-cadherin的表达,抑制Bcl-2、MMP-2的表达,其对宫颈癌Hela细胞的影响与DKK3恰好相反,提示DKK3可能是通过负调控IL-32β来影响宫颈癌细胞的生物学行为。进一步研究发现,过表达IL-32β可以逆转DKK3对宫颈癌细胞增殖凋亡、迁移和侵袭的影响。
