单唾液酸四己糖神经节苷脂对大鼠脑出血后PAPR-1/AIF通路的影响
2020-12-09张双邓华江张丽云刘洛同唐兴江梁雪梅
张双 邓华江 张丽云 刘洛同 唐兴江 梁雪梅
(西南医科大学附属医院 1老年病科,四川 泸州 646000;2神经外科;3健康体检中心;4神经内科)
目前,不论是显微手术的运用,还是临床药物、高压氧等的综合治疗,虽然一定程度上使脑出血病情得到改善,但是其神经功能的恢复效果仍不尽人意。如何更好地促进脑出血导致的神经功能障碍恢复仍是研究的重点及难点。研究证实,细胞凋亡程序的启动也参与了脑出血后的继发性损伤〔1,2〕。同时,多聚二磷酸腺苷核糖聚合酶-1/凋亡诱导因子(PARP-1/AIF)介导的含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)非依赖性的细胞凋亡通路在细胞凋亡过程中发挥着重要作用〔3~5〕。单唾液酸四已糖神经节苷脂(GM1)广泛存在于中枢神经系统灰质中,其参与了神经系统的发育过程,具有神经保护作用。当中枢、外周神经受损或内源性GM1不足时,通过补充外源性GM1可起到明显的早期脑保护作用〔6〕。当脑组织缺血再灌注损伤后,外源性GM1可起到抗凋亡作用〔7〕。但目前GM1抗凋亡作用机制尚不明确,同时其在脑出血损伤中的应用也未见报道。本研究探讨GM1对大鼠脑出血后神经功能障碍的影响及可能机制,为更好地治疗脑出血提供一定的实验依据,也为脑出血治疗提供新的途径。
1 材料与方法
1.1实验动物分组、药物及器材 80只健康SD大鼠(300~350 g)由西南医科大学动物实验中心提供,随机分为4个组:假手术组(n=5),脑出血组(n=25),小剂量组(n=25),大剂量组(n=25);单唾液酸四己糖神经节苷脂(山东齐鲁制药厂);WDT-V型大鼠脑立体定位仪(西南医科大学神经生物学教研室),50 μl微量注射器(上海市安亭微量进样器厂);Leica DM2500显微镜(德国Leica公司);石蜡切片机(德国Leica公司);一抗兔抗鼠凋亡诱导因子(AIF)多克隆抗体(巴傲得生物科技有限公司);一抗兔抗鼠PARP-1、Bax,Bcl-2抗体多克隆抗体(巴傲得生物科技有限公司);二抗快捷型酶标羊抗鼠/兔IgG聚合物(迈新生物技术开发有限公司);抗体稀释液(上海基因公司)。
1.2实验方法
1.2.1大鼠脑出血模型的建立 将大鼠麻醉后,置于36.5~37.5℃温台上,取俯卧固定于立体定位仪上,调整立体定位仪的水平定位针,大鼠头部至正中位,于头顶部正中切开长约8 mm纵行切口,分离头皮暴露颅骨,将微量注射针固定于立体定位仪上,调整位置,使针尖移动至大鼠颅骨中线右旁3 mm,前囟前方0.2 mm,骨钻开颅骨,断尾取血50 μl于微量注射针内,将针尖移动至已钻好的颅孔内,并向颅内进针6 mm,将血匀速注入大鼠脑尾状核,注血速度约10 μl/min,完成后留针5 min,之后缓慢退针(约1 min),封闭颅骨并缝合皮肤,手术整个过程均为无菌操作。假手术组:除不断尾取血注入脑组织外,其余步骤均一致。除假手术组外,其他各组又分别按处死时间分为6 h、1 d、3 d、5 d、7 d共5个亚组,小剂量及大剂量组大鼠于脑出血手术后即刻按体重分别经腹腔注射小剂量(15 mg/kg)和大剂量(30 mg/kg)GM1各一次,之后每天同一时间按相同剂量给药直至处死,假手术组和脑出血组大鼠于每天相同时间点腹腔注射等量的生理盐水。
1.2.2神经功能评分 依照Garcia等评分方法进行神经功能评分,分数越低则神经功能障碍越重〔8〕。
1.2.3脑组织细胞凋亡程度定量分析 采用TUNEL染色法对大鼠脑组织细胞凋亡情况进行检测,从每只大鼠中选取5张染色切片,然后置于400倍光学显微镜下,选取连续6个无重叠血肿周围组织的视野区进行观察,并对TUNEL染色阳性表达的细胞采用Image-Pro-Plus图像进行分析系统计数。
1.2.4Western印迹检测 大鼠在造模后72 h处死,并置于低温条件下快速提取大鼠脑组织蛋白,测定蛋白浓度,随后提取蛋白样品50 μg进行上样、电泳之后转移到聚偏氟乙烯(PVDF)膜上;以3%牛血清白蛋白(BSA)液封闭1 h,然后加入相关一抗于4℃孵育过夜;用PBST洗膜3次,每次洗膜约5 min;随后加入与一抗相对应的二抗,并在室温下轻摇孵育2 h;再次洗膜3次,以电化学发光(ECL)显影液将膜在ChemiDocXR+凝胶成像仪中予以曝光显影,采集相关信息,用Image Lab程序进行条带分析,检测PARP-1,AIF,Bcl-2 和Bax蛋白表达变化情况。
1.3统计学处理 采用SPSS17.0软件进行重复测量方差分析、LSD-t检验。
2 结 果
2.1GM1对大鼠脑出血后神经功能障碍的影响 除假手术组外,其余各组均在术后出现不同程度的神经功能损伤症状,如:血肿对侧肢体瘫痪、“追尾征”等行为学改变,且在术后神经功能评分逐渐下降,于术后第2~3天降至最低。与脑出血组相比较,治疗组在对应的各时间点大鼠神经功能障碍均得到显著缓解(P<0.05),且大剂量组显著优于小剂量组(P<0.05)。见表1。
2.2GM1对大鼠脑出血后细胞凋亡的影响 脑出血组及GM1治疗组镜下均可见明显的TUNEL阳性表达,凋亡细胞明显多于假手术组,且在术后第2~3天达到高峰,随后逐渐下降。经GM1治疗后细胞凋亡数量相对脑出血组减少,且存在量效关系(P<0.05)。见表1、图1。
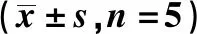
表1 各组脑出血术后细胞凋亡数量及各时间点神经功能评分

图1 各组脑组织TUNEL染色(×400)
2.3GM1对PARP-1及AIF表达的影响 假手术组脑组织中PARP-1及AIF蛋白表达量均较低。当脑出血后PARP-1、AIF蛋白表达量明显增加(P<0.05),且于术后第3天达到峰值,小剂量组和大剂量组中PARP-1、AIF的表达均出现不同程度的下调,且大剂量组下调程度大于小剂量组(P<0.05),见表2、图2。
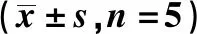
表2 脑出血后3 d PARP-1及AIF表达比较

图2 Western印迹检测PARP-1、AIF蛋白表达
2.4GM1对Bcl-2及Bax表达的影响 假手术组脑组织中Bcl-2蛋白高表达,而Bax低表达,Bax/Bcl-2比值(0.15±0.06)较低。当脑出血后Bax蛋白表达明显上调(P<0.005),且于术后第3天达到峰值,而Bcl-2表达趋势与之相反,Bax/Bcl-2比值(3.07±0.16)增高。但经GM1干预后大、小剂量组Bax蛋白表达出现不同程度的下调,而Bcl-2出现上调,Bax/Bcl-2比值(0.75±0.10、1.36±0.15)下降,且大剂量组变化程度大于小剂量组(P<0.05)。见图3。

图3 Western印迹检测Bcl-2、Bax蛋白表达
3 讨 论
脑出血后广泛存在着细胞凋亡现象〔9〕,细胞凋亡程序的启动参与了脑出血后的继发性损伤,加重脑出血后神经系统功能障碍,除了经典的含半胱氨酸的天冬氨酸蛋白水解酶(caspase)介导的死亡受体途径外,非半胱天冬酶介导的凋亡途径也是一条重要的细胞凋亡途径,其中包括经典的聚PARP-1/AIF介导的凋亡途径〔10〕。
PARP-1是一种含量丰富的核蛋白,广泛存在于细胞核内,在生理条件下具有调节细胞稳定和保护基因稳态性的作用,而当脑组织损伤、细胞缺血缺氧情况下,DNA大量损伤可促使PARP-1过度激活,导致神经元损伤及凋亡,最终导致严重的神经功能障碍。因此PARP-1的激活程度可能是调节DNA损伤后细胞死亡或存活的关键因素。研究发现,PARP-1过度激活可加重脑缺血缺氧性损害,PARP-1抑制剂或PARP-1基因敲除均可显著减轻神经元死亡〔11,12〕。AIF是PARP-1重要的下游因子,当神经元缺血缺氧后,PARP-1被大量激活,使细胞质内PAR聚集,并向线粒体内转位,促进线粒体内AIF释放,进入细胞核中,导致染色质凝集和DNA大片段断裂,导致细胞凋亡〔13,14〕。Bcl-2及Bax是bcl-2基因家族中具有代表性的凋亡相关蛋白,Bcl-2为抗凋亡蛋白,Bax则为促凋亡蛋白,Bax/Bcl-2的比值对细胞的凋亡进行调控,比值越小,则抑制细胞凋亡,比值越大,则促进细胞凋亡〔15〕。
本研究证实了脑出血后PARP-1/AIF介导的细胞凋亡途径被激活并在此病理生理过程中起到重要的作用。
神经节苷脂具有促进神经元再生和神经功能恢复作用,同时对受损细胞分化功能的维持和生存起重要作用。GM1是最重要的神经节苷脂之一。当脑组织缺血缺氧,GM1含量明显下降,而外源性GM1可透过血脑屏障,嵌入受损的神经细胞膜上,进而启动其神经保护作用〔16〕。本研究提示GM1对脑出血后PARP-1、AIF表达及Bax/Bcl-2具有一定的调节作用,且存在量效关系。
综上所述,GMI对大鼠脑出血后神经功能具有保护作用,其作用机制可能是通过调节PARP-1/AIF通路进而抑制脑出血后细胞凋亡途径。但关于GM1如何作用于PARP-1发挥神经保护作用,仍有待进一步研究。
