GDF-15与2型糖尿病视网膜病变的研究
2020-12-09赵海燕陈永生
赵海燕,陈永生
(山东省临沂市人民医院,山东 临沂 276003)
0 引言
研究结果表明,在糖尿病视网膜病变演变的过程中,巨噬细胞、白细胞等炎性细胞参与度较明显,且存在多种细胞因子在疾病发展中起到推动作用。本研究意在通过检测2型糖尿病患者血液及房水中的生长分化因子15(GDF-15)及超敏C反应蛋白(Hs-CRP)和DR之间的关系,进而为临床研究提供更多参考。
1 资料与方法
1.1 一般资料
1.1.1 实验组:选取2018年9月至2019年9月同期住院的T2DM患者,且均确诊为DR患者,共194例,男107例,女87例。在疾病诊断过程中主要以糖尿病视网膜诊断标准为依据(全国眼底病协作组制定),对患者实施眼底镜检查,并按照检查结果将患者分为以下几组:①无视网膜病变组(NDR)62例,男32例,女30例,年龄(58.5±6.9)岁,病程6个月至6年;②增殖期DR组(PDR)67例,男38例,女29例,平均年龄(65.6±5.8)岁,病程在5-20年之间。③背景期DR组(BDR)65例,男37例,女28例,平均年龄(60.3±5.4)岁,病程3-15年。
1.1.2 对照组:患者共50例,男25例,女25例,平均年龄(59.25±6.5)岁,且均为单纯老年性白内障,患者无其他过敏史或慢性病史。
1.1.3 标本采集:取空腹血及术中房水测GDF-15、Hs-CRP浓度。体重指数(BMI)=重(kg)/身高(m)2;血糖(FPG)测定用葡萄糖氧化酶法;糖化血红蛋白(HbA1c)用免疫比浊法;胰岛素测定用放免法(RIA);GDF-15、Hs-CRP为酶联免疫吸附法(ELISA)。
表1 实验组与对照组年龄、性别、病程、BMI、PBG、INS、HbA1c的比较( )
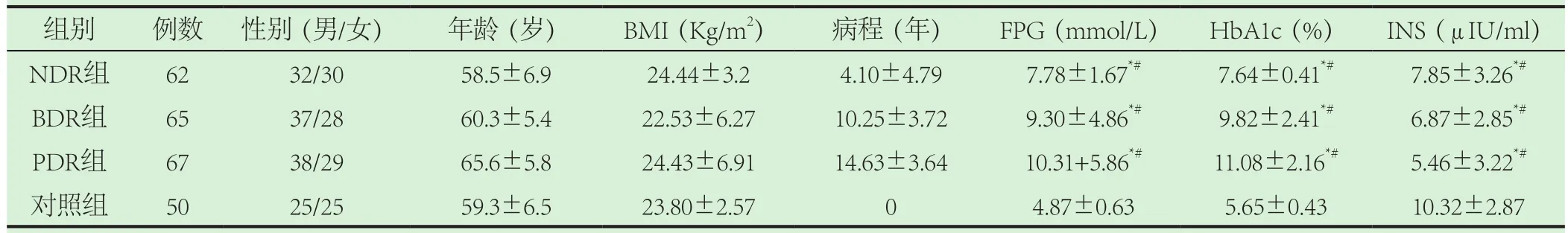
表1 实验组与对照组年龄、性别、病程、BMI、PBG、INS、HbA1c的比较( )
注:*NDRvsBDR P<0.01;BDRvsPDR P<0.01;NDRvsPDR P<0.01。#NDRvs对照组P<0.01;BDRvs对照组P<0.01;PDRvs对照组P<0.01。
组别 例数 性别(男/女) 年龄(岁) BMI(Kg/m2) 病程(年) FPG(mmol/L) HbA1c(%) INS(μIU/ml)NDR组 62 32/30 58.5±6.9 24.44±3.2 4.10±4.79 7.78±1.67*# 7.64±0.41*# 7.85±3.26*#BDR组 65 37/28 60.3±5.4 22.53±6.27 10.25±3.72 9.30±4.86*# 9.82±2.41*# 6.87±2.85*#PDR组 67 38/29 65.6±5.8 24.43±6.91 14.63±3.64 10.31+5.86*# 11.08±2.16*# 5.46±3.22*#对照组 50 25/25 59.3±6.5 23.80±2.57 0 4.87±0.63 5.65±0.43 10.32±2.87
1.1.4 对患者相关资料使用SPSS 21.0统计学软件进行处理,采用T检验,并以表示,若P<0.05,表示研究结果有意义。
2 结果
2.1 NDR、BDR、PDR三组患者血PBG、HbA1c及BMI、T2DM病程、PBG、HbA1c及BMI均高于NDR组;PDR组的T2DM病程、PBG、HbA1c及BMI均高于BDR组见表1。
2.2 实验组与对照组、GDF-15、Hs-CRP的比较见表2,DR严重程度与T2DM病程、PBG、HbA1c、GDF-15、Hs-CRP及BMI呈正相关;与INS呈负相关。GDF-15、Hs-CRP与T2DM病程、PBG、HbA1c及BMI呈正相关;GDF-15、Hs-CRP与INS呈负相关。
表2 实验组与对照组、GDF-15、Hs-CRP的比较( )
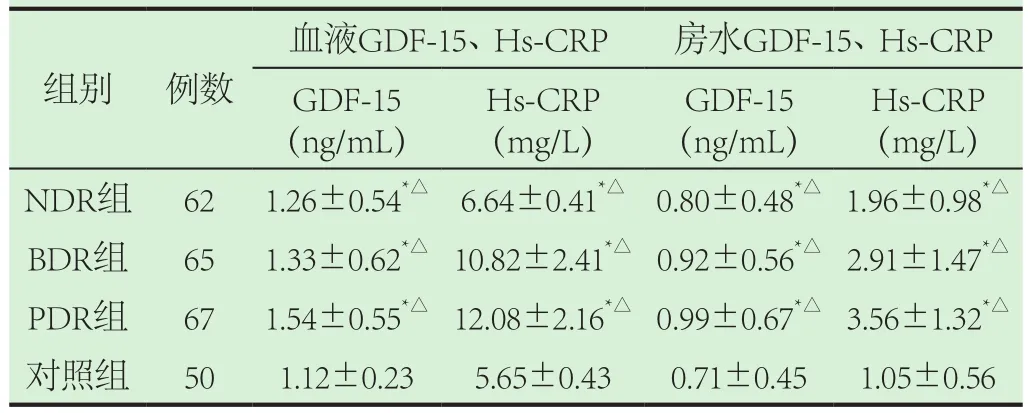
表2 实验组与对照组、GDF-15、Hs-CRP的比较( )
Hs-CRP(mg/L)NDR组 62 1.26±0.54*△ 6.64±0.41*△ 0.80±0.48*△ 1.96±0.98*△BDR组 65 1.33±0.62*△ 10.82±2.41*△ 0.92±0.56*△ 2.91±1.47*△PDR组 67 1.54±0.55*△ 12.08±2.16*△ 0.99±0.67*△ 3.56±1.32*△对照组 50 1.12±0.23 5.65±0.43 0.71±0.45 1.05±0.56组别 例数血液GDF-15、Hs-CRP 房水GDF-15、Hs-CRP GDF-15(ng/mL)Hs-CRP(mg/L)GDF-15(ng/mL)
2.3 相关性分析
2.3.1 DR严重程度与T2DM病程、PBG、HbA1c、GDF-15、Hs-CRP、BMI成正相关,与INS成负相关。
2.3.2 GDF-15、Hs-CRP与T2DM病程、PBG、HbA1c、BMI成正相关,与INS成负相关。
3 讨论
生长因子β超家族成员参与细胞增殖、程序性凋亡、细胞外骨架形成等。临床研究结果显示GDF-15是一个前体蛋白,其中氨基酸数量为308个,具有自分泌或旁分泌功能,对周围以及自身细胞具有一定影响。相关学者在研究GDF-15功能时发现,抗增殖、抗炎以及抗细胞凋亡与GDF-15功能具有极大相关性,在正常生理情况下,高表达GDF-15的唯一组织为胎盘,但在肝脏等其他相关器官中表现不明显,且水平较低。若GDF-15表达上调,表示组织处于缺血、缺氧、中毒、炎症、肿瘤进展、急性组织损伤等病理或应急条件下。除此之外,其高表达情况有可能出现在玻璃体视网膜疾病存在炎症组分情况,GDF-15主要分为两种,一种为玻璃体眼内起源,另一种则为眼外起源,由此可见,GDF-15蛋白表达与玻璃体视网膜的调节存在一定关系[1]。根据不同条件的变化及组织差异性,GDF-15表达也不同,受机体性别、健康状况以及年龄等因素的影响,所变现的蛋白结构形式、功能变会存在较大不同。相关研究结果显示,GDF-15也可以表现为保护性因子,其高表达主要变现在心肌缺血再灌注、新生血管形成以及肿瘤细胞增殖、等状况下,对相关炎症反应具有极高的抑制作用,防止肿瘤细胞增殖,对癌细胞凋亡具有推动作用。随后,有研究学者证实,GDF-15可以被视为新的心脏生物标志物,对肌细胞凋亡存在明显阻碍作用,防止患者机体出现心肌细胞肥厚情况。由此可见,GDF-15可以有效应用于心血管疾病的诊断、预后评估中,具有较高的临床价值[2]。除此之外,研究结果显示,糖尿病、高脂血症等疾病在高GDF-15的人群中发病率显著提升,表明二者可能存在一定关系,需要对其进行更深层次的探讨。
GDF-15相关研究中,表明GDF-15对血管内皮修复具有积极意义,可以作为其有效的保护屏障。当GDF-15超过50 ng/mL时,对血管内皮细胞具有控制作用,防止其快速生长;当GDF-15在5 ng/mL之下时,对血管生成具有一定推动作用,同时可以促进血管内皮细胞生长。在TT2DM、大血管病变过程中,由于处于高糖环境,会出现局部缺氧情况,进而引发基质金属蛋白酶9表达上调,胶原纤维糖基化,弹性蛋白分解,进而导致一氧化氮弥散能力出现一定障碍,是GDF-15的表达更加明显,引发机体功能出现失调状况[3]。
GDF-15作为应激反应蛋白,在氧化应激反应中表现的较为明显,进而使GDF-15在脂肪细胞分泌较多,对血管起到了很好的防护效果。当GDF-15表达增加,表示患者出现了出血相关疾病,此时主要是由于GDF-15在细胞应激盒细胞损伤时转录增多而形成的。而GDF-15可以有效控制血小板活化情况,进而对出血性疾病氧化应激反应产生一定影响。
相关研究结果表明,GDF-15在炎症反应中变现较为明显。患者存在动脉粥样硬化性疾病时,巨噬细胞表现较为明显,进而将趋化因子受体2磷酸化,磷酸化的趋化因子受体2余配体偶联减少趋化性细胞因子受体2/β依赖的炎症反应,对细胞出现局部浸润情况具有抑制作用,降低组织坏死的发生机率[4]。
GDF-15对血管生成具有极大影响,研究结果表明,血管生成数量较大时,对肿瘤、眼部疾病以及其他炎症性疾病的出现具有推动作用。Schulz等研究发现,GDF-15处于正常生理情况时,对内皮下拨在体外血管生成具有抑制效果。当患者处于缺氧情况时,GDF-15在心肌微血管内皮细胞中的表达上调。由此可见,GDF-15基因对血管生成以及心肌微血管内皮细胞具有一定相关性。
GDF-15对启动蛋白酶B信号通路具有一定作用,且对分裂原活化蛋白激酶信号通路影响较明显,以上均需在缺氧或炎症因子作用下。除此之外,有研究表明GDF-15与心血管疾病存在一定关联。[5]。
糖尿病患者视力消失后,会出现视网膜病变等情况,不仅对患者视力造成一定损伤,而且会严重降低患者生活质量。按照糖尿病视网膜病变国际分期,可以将其病变分为非增殖性视网膜(血-视网膜屏障损害)以及增殖性视网膜病变(新生血管生成、胶原纤维增生)两种。在后者病变中,炎症细胞浸润到脉络膜、视网膜或玻璃体中,新生血管增加了视网膜炎症组分,导致GDF-15出现上调现象。由此可见,GDF-15与糖尿病视网膜病变具有很大相关性。
