HPLC法测定排石颗粒中槲皮素和山奈素含量
2020-12-08刘彬果叶盛英
刘彬果 叶盛英


【摘 要】 目的:建立测定排石颗粒中槲皮素和山奈素含量HPLC法。方法:用ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;以甲醇-0.4%磷酸(55∶45)为流动相,检测波长为360 nm。结果:槲皮素在0.025~0.495 μg(r=0.999 9)的范围内呈良好的线性关系,加样回收率为97.1%,RSD值2.5%(n=6);山奈素在0.015~0.304 μg(r=0.999 9)的范围内呈良好的线性关系,加样回收率为100.2%,RSD值1.2%(n=6)。结论:该法快速、简便、准确、重复性好,结果可靠,可用于排石颗粒中槲皮素和山奈素的含量测定,为全面控制排石颗粒的质量提供可靠方法。
【关键词】 高效液相色谱法;槲皮素;山奈素;排石颗粒
【中图分类号】R284.1 【文献标志码】A 【文章编号】1007-8517(2020)19-0052-04
Abstract:Objective To establish an HPLC method for the content determination of quercetin and kaempferide in Paishi granules.Methods The content of Quercetin and Kaempferide was determined by HPLC with ZORBAX SB-C18 column(4.6 mm×250 mm,5 μm).The mobile phrase was composed of methanl-0.4% phosphoric acid solution(55∶45)and detected at 360 nm when the column temperature was 25 ℃.Results The linear range of quercetin was 0.025~0.495 μg.The average recovery was 97.1%, RSD 2.5%.The linear range of kaempferide was 0.015~0.304 μg;The average recovery was 100.2%, RSD 1.2%.Conclusion This methods is simple and reliable.It is suitable for the content control of Quercetin and Kaempferide in Paishi granules.
Key words:HPLC; Quercetin; Kaempferide; Paishi Granules
排石顆粒为第九八三医院多年的临床经验方,由金钱草、海金砂、车前草等9味药材组成的复方制剂,方中金钱草甘咸微寒,清热解毒,祛湿热,退黄疸,利胆排石,为君药。石韦、海金沙利水通淋,排石;车前草利水并能清下焦湿热;均为治疗淋病的常用药,为臣药,其有效成分为槲皮素和山奈素。白茅根凉血止血,清热利尿;川楝子苦寒性降,行气止痛;厚朴味辛行散,行气燥湿;枳壳行气宽中,化痰除痞,以上四味共为佐药[1-2]。甘草调和诸药,以为佐使。其现有的标准只有中药定性鉴别的方法,没有主要药味的含量测定方法,为了更好的控制排石颗粒的质量,采用高效液相色谱(HPLC)法以槲皮素和山奈素作为指标成分进行含量测定,经方法学考察,认为本法简便,准确,无干扰,可用于排石颗粒制剂的质量控制。
1 仪器与试药
Agilent 1260高效液相色谱仪,OpenLAB CDS色谱工作站,ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;槲皮素对照品(含量:99.6%,批号:120821-201212);山奈素对照品(含量: 99.8%,批号:120821-201212)购自中国食品药品生物制品检定所;水为超纯水(自制),甲醇为色谱纯,其余试剂为分析纯。排石颗粒(14430137,15260137,15040115,第九八三医院制剂室)。
2 方法与结果
2.1 色谱条件 色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5 μm);甲醇-0.4%磷酸(55∶45)为流动相;检测波长为360 nm,进样量:10 μL。
2.2 对照品溶液的制备 对照品溶液的制备 取槲皮素对照品、山奈素对照品各适量,精密称定,加80%甲醇溶解,定容,摇匀,制成每1 mL含槲皮素50 μg、山奈素30 μg的混溶液,即得。
2.3 供试品溶液的制备 取排石颗粒(15040115)约7 g,研细,精密称定,置具塞锥形瓶中,精密加入50 mL 80%甲醇,称定重量,超声处理60 min(功率250 W,频率40 kHz),放冷,用甲醇补足减失的重量,摇匀,滤过,取续滤液。精密量取续滤液25 mL,置50 mL量瓶中,加入盐酸(10%)5 mL,置90 ℃水浴中,水解1 h,取出,迅速冷却,用80%甲醇定容,滤过,取续滤液,即得。
2.4 空白溶液的制备 按处方比例及工艺制备不含金钱草的阴性对照样品,按2.1项下制备方法得空白溶液。
2.5 专属性试验 依据2.1项下色谱条件,分别精密吸取供试品溶液、对照品溶液及空白溶液各10 μL,测定。结果表明,在与对照品溶液色谱图相应保留时间处,供试品溶液有槲皮素和山奈素特征吸收峰,而阴性对照液无相应吸收峰,表明专属性良好。见图1。
2.6 线性关系的考察 分别精密称取山奈素10.2 mg(纯度:93.2%)、槲皮素对照品15.8 mg(纯度:98.0%),置50 mL容量瓶中, 80%甲醇溶解,定容至刻度,即得对照品储备液。精密吸取对照品储备液2 mL,置25 mL容量瓶中,制备对照品溶液(槲皮素:24.77 μg/mL;山奈素:15.21 μg/mL)。分别精密吸取1 μL、2 μL、4 μL、5 μL、6 μL、8 μL、10 μL、20 μL,依次进样,测定峰面积,以峰面积(Y)为纵坐标,进样量(X)为横坐标,绘制标准曲线,并进行线性回归,
得:槲皮素:Y =4263.5X-5.4208,r=0.999 9(n=8);
山奈素:Y =5942.8X-2.8272,r=0.999 9(n=8)。
结果表明,槲皮素在0.025~0.495 μg的范围内,山奈素在0.015~0.304 μg的范围内线性关系良好。
2.7 精密度试验 精密吸取同一对照品溶液,按2.1项下各色谱条件分别测定,连续进样6次,记录峰面积,槲皮素和山奈素的RSD值分别为1.1% 和0.6%(n=6),表明仪器精密度良好。
2.8 稳定性试验 同一供试品溶液(15040115),分别于0、2、4、6、8、9 h和10 h测定,得槲皮素和山奈素峰面积RSD分别为2.1%和1.5%,表明供试品溶液在10 h内稳定性良好。
2.9 重复性试验 同一批样品(15040115)6份,按2.3项下方法制备,依法测定。记录峰面积,计算槲皮素和山奈素的含量的RSD分别为1.7%和1.8%,表明该方法具有良好的重复性。
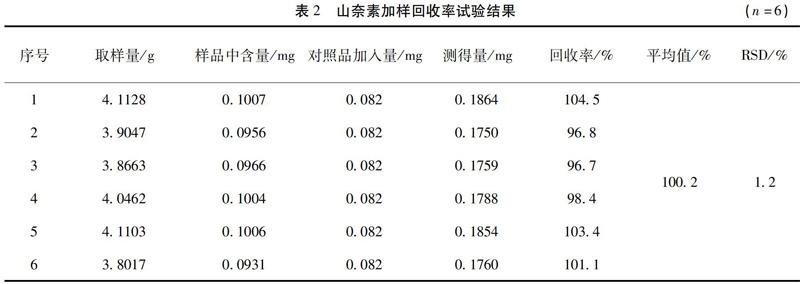
2.10 加样回收率试验 取已知含量的样品(15040115)6份,每份约4.0g,精密称定,精密加入槲皮素(0.196 mg/mL)和山奈素(0.041 mg/mL)对照品溶液各2 mL,按2.3项下方法制备,按2.1项下条件测定,记录峰面积,计算回收率,结果槲皮素的加样回收率为97.1%,RSD为2.5%(n=6);山奈素的加样回收率为100.2%,RSD为1.2%(n=6)。见表1、2。
2.11 樣品测定 取样品3批(14430137,15260137,15040115),按2.2项下方法分别制备供试品溶液,照2.1项下色谱条件测定,外标法定量。计算三个批次的样品中槲皮素和山奈素的含量,结果见表3。
3 讨论
3.1 指标成分的选择 排石颗粒中金钱草为君药,主要功效成分为黄酮类 [1-3],可作为中成药的质量控制指标,在本研究中,选用黄酮类水解产物槲皮素和山奈素作为指标成分测定,以其含量作为质量控制的考察指标。
3.2 测定波长的选择 参照中国药典中金钱草的含量测定方法[4],经光谱扫描,槲皮素和山奈素在360 nm处均有较大吸收,故选取360 nm作为检测波长。
3.3 提取条件的选择 在供试品的制备过程中, 采用超声提取的方法,该方法简单,便于操作。同时对于提取时间进行考察,考察了超声处理40 min、60 min、80 min,研究发现,60 min超声处理样品可达到提取完全的目的,采用超声提取60 min的方法制备供试溶液。
黄酮类化合物在植物体内常与糖结合成苷类或碳糖基的形式存在,为了准确测定其苷元的的含量,需进行水解去糖。参考相关文献及药典方法[5-7],采用酸水解法,考察了糖水解时的温度、盐酸含量、水解时间等,采用90 ℃水浴中加热水解1小时,甲醇与10%盐酸体积比为5∶1时,峰面积之和达到最大。因而,确定采用超声60 min,90 ℃水浴中加热水解1 h制备供试品溶液。
3.4 流动相的选择 因黄酮类成分含有酚羟基,呈弱酸性,故选择酸性缓冲系统,参照药典及相关文献[8-11]报道,采用甲醇-0.4%磷酸(55:45)为流动相;检测波长:360 nm;流速:1.0 mL.min-1;柱温:室温。可达到很好分离效果。
经方法学考察,本方法简单,结果准确,重复性好,无干扰,可用于排石颗粒的质量控制。
参考文献
[1]朱静,汪正宇.HPLC 测定八珍益母胶囊中槲皮素的含量[J].海峡药学,2015, 27(7):37-39.
[2]陈健.高效液相色谱法测定金钱草片中槲皮素和山奈素含量[J].中国药业,2016,25(6):62-64.
[3]杜勇,李琰,张小茜.金钱草质量标准的研究[J].中国中药杂志, 2006,31(5):438-440.
[4]国家药典委员会.中华人民共和国药典(一部)[S].2015年版.北京:中国医药科技出版社, 2015:219-220.
[5]刘译.HPLC测定利胆消食颗粒中槲皮素和山奈素含量[J].2015,12(1):27-29.
[6]赵艳丽,黄亦琦,胡珊梅,等.HPLC测定全蚕粉中槲皮素和山奈素的含量[J].中国实验方剂学杂志, 2012, 18(18):95-97.
[7]齐惠珍,周霞瑾,田培虹.银杏叶分散片中总黄酮醇苷的含量测定[J].河北医药,2015,37(20):3178-3180.
[8]马梅芳,吕文海.HPLC法同时测定南葶苈子饮片中槲皮素、山萘素与异鼠李素的含量[J].中国药事,2009, 23(5):65-67.
[9]姜帆,杨星刚,郭迎新,等.银杏叶制剂溶出度中槲皮素、山萘素与异山李素的HPLC测定方法研究[J].沈阳药科大学学报,2013,30(9):691-695.
[10]蒋俊春,孟建升,杨文文.HPLC法测定八味接骨胶囊中山萘素的含量[J].中国药事,2012,26(12):1374-1376.
[11]张燕芬.普乐安胶囊中槲皮素和山萘素的HPLC法含量测定研究[J].中国药物评价,2016,33(3):136-138.
(收稿日期:2020-05-09 编辑:刘 斌)
