PCR 快速检测食品中牛源性成分
2020-12-08肖明雅冯娜娜
肖明雅,冯娜娜,陈 阳,尹 锐
(吉林农业科技学院生物与制药工程学院 132101)
1 引言
食品中动物物种成分的正确标注,可提升食品安全、食品质量,增强消费者的消费信心、维护商业公平,保障食品行业的健康发展。 当今社会,食品生产、加工和流通链条较长,使得食品掺假的机会明显增多。 一些不法商家为了谋取暴利,将价格较低的肉掺入价格较高的肉制品中出售[1],如以鸡肉冒充猪肉,猪肉冒充牛羊肉[2]。 更为严重的是近几年频频曝出了“利用老鼠、狐狸、水貂肉添加明胶、胭脂红等冒充牛肉”[3]等。 因此,建立一种准确、快速、灵敏的食品中牛源性检测技术势在必行。
基于蛋白质[4-6]和基于DNA 技术[7-12]的检测是动物物种鉴定的主流方法。 蛋白质检测方法简单易行,但是食物中的蛋白质经深加工和热处理易发生变性而无法检出。与蛋白质相比,DNA 具有较高的热稳定性和物种特异性, 可对不同深加工方式的食物中的物种成分有效检出[13,14]。 因此,越来越多的检测手段开始着眼于DNA 水平检测的研究。
PCR 法和实时荧光定量PCR 技术由于检测快速、 灵敏性高、特异性好等优势,被更多的用于动物物种的检测研究[15-20]。 根据PCR 检测基本原理,本研究对待测引物及探针进行独特设计,以牛源性成分的快速检测为切入点, 建立了一种食品中牛源性成分PCR 快速检测方法。 该方法具有快速、灵敏度高、特异性强[21,22]等优点,以期成为一种新型的物种成分快速分子检测工具,在牛源性成分检测、掺假鉴定及物种溯源过程发挥重要作用。
2 材料与方法
2.1 仪器与试剂
2.1.1 材料与试剂
琼脂糖、DNA 分子量标准Marker A(25~500bp)、磁珠法动物基因组DNA 提取试剂盒、PCR 预混液 (上海生工生物工程股份有限公司)。
实验样本于长春某大型超市选购,包括牛肉、羊肉、鸡肉、猪肉、鸭肉、鱼肉及28 份商业样品。
2.1.2 主要仪器设备
TG16KR 台式高速冷冻离心机 (上海继谱电子科技有限公司);PCR-MGL96+普通PCR 仪(日本岛津公司);SCANDRPO 100超微量核酸蛋白测定仪 (德国耶拿分析仪器股份公司);E-Gel Imager 核酸凝胶成像系统(赛默飞世尔科技有限公司)。
2.2 实验方法
2.2.1 样品DNA 提取及纯度检测
将每个肉的样品切碎并精确称重; 每个样品按动物基因组DNA 提取试剂盒提取0.1g, 然后根据试剂盒说明书步骤进行样本DNA 的提取。 DNA 样品的完整性用1%琼脂糖凝胶电泳法鉴定; 样品的纯度用超微量核酸蛋白测定仪在OD260/OD280 处的吸光度值来确定,数值在1.7~1.9 的可用于PCR 反应。
2.2.2 引物的设计
从国家生物技术信息中心 (national center for biotechnology information,NCBI) 网站下载牛和其他动物物种的线粒体DNA 序列。 物种线粒体基因组Genbank 号如下:
Bos taurus (GU947021,AY126697,FJ997262,KR011113,NC_036020),Equus caballus (AP013085,AY584828,KT368757),Equus asinus (MK982180),Ovis aries (KU575248,KF312238,KX609626),Capra hircus (MK234706,MH229952),Sus scrofa(KY964306,MK251046,GU147934,MK248682),Canis lupus familiaris (CM016608,KT591870,EU408280),Gallus gallus (KX987152,GU261718),Pandalus borealis (FJ403244),Austruca lactea (NC_042401),Parasesarma affine(NC_039990),Anas platyrhynchos (MF069251,EU755252)。 对这些序列通过Vector NTI Advance11.0 进行分析(Ink/Thermo Fisher Scientific Carsbad,CA,USA),进行多序列比对,选用跨牛线粒体基因组的ND5-ND6基因(烟酰胺嘌呤二核苷酸(nicotinamide dinucleotide,NADH)脱氢酶亚基5 和NADH 脱氢酶亚基6 编码基因) 设计引物。 使用DNAStar 软件对候选引物的物理参数进行评估。 使用BLAST 工具(http://www.ncbi.nlm.nih.gov/blast)对引物的特异性进行验证。 引物由生工(上海)生物工程有限公司合成。 序列如表1。

表1 引物序列
2.2.3 PCR 扩增及电泳检测
PCR 反应体系25μL 包含5.2μL PCRMIX、 上下游引物各0.8μL(10μmol/L)、1μL 的DNA 模板和17.2μL 的ddH2O。 PCR反应条件:95℃预变 性5min,95℃变 性30sec;56℃退火30sec;72℃延伸30sec,40 个循环。 取5μL PCR 扩增产物用于2%琼脂糖凝胶电泳检测。 电泳条件为电压100V,电流80mA;30min 后凝胶成像仪分析结果。
2.2.4 检测的特异性
提取牛肉、羊肉、鸡肉、猪肉、鸭肉、鱼肉基因组DNA,以ddH2O 为阴性对照。应用牛源性成分特异引物进行扩增,琼脂糖凝胶电泳进行检测,实验重复3 次。 验证反应的特异性。
2.2.5 检测的灵敏度
研究采用琼脂糖凝胶电泳评价PCR 检测技术的灵敏度。将纯化的牛基因组DNA 进行梯度稀释, 呈1ng,100pg,10pg,1pg,100fg,10fg 和1fg 7 个浓度, 分别以各浓度的DNA 作为模板进行PCR 扩增; 通过琼脂糖凝胶电泳来确定该检测的灵敏度。 上述实验重复3 次。 验证检测的灵敏度。
2.2.6 实际样品的检测
从超市购买标明成分的25 份牛肉及猪肉制品,按2.2.1 方法提取其基因组DNA,通过牛源性PCR-电泳检测以评价其在实际样本检测中的适用性。
3 结果与分析
3.1 检测的特异性
分别提取牛、羊、猪、鸡、鸭、鱼的基因组DNA,各DNA 样本均稀释至10ng/μL,通过牛源性成分特异性引物进行PCR 扩增;通过琼脂糖凝胶电泳检测。 结果表明该方法对牛DNA 特异性检出,其他物种无交叉反应。 如图1。

图1 牛源性PCR-凝胶电泳特异性检测结果
3.2 检测的灵敏度
本研究采用琼脂糖凝胶电泳对PCR 检测方法的灵敏度进行了评价。 首先,通过PCR-凝胶电泳对10 倍梯度稀释牛DNA进行检测,其最低检测限达到10pg (图2)。 因此,本研究建立的PCR 检测方法的可以检测10pg 以上的牛源性DNA 成分。
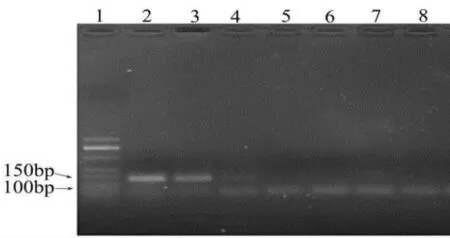
图2 牛源性PCR-凝胶电泳检测法的敏感度
3.3 商业样品的检测
提取25 份牛肉及猪肉待测样品DNA, 通过牛源性成分PCR-电泳检测,每个样品做了一个平行样。 所有的牛肉制品检测结果均为阳性,对猪肉样本检测均呈阴性,如表2。 因此,该方法可以用于商业样本中牛源性DNA 的检测。
4 结论
本研究跨牛线粒体基因组ND5-ND6 基因设计引物,建立了一种食品中牛源性成分快速检测方法。 该技术有望成为一种新型的物种成分快速分子检测工具,在牛源性成分检测、掺假鉴定及物种溯源过程发挥重要作用。
