右美托咪定与丙泊酚对颅脑外伤患者的镇静效果、血流动力学及脑保护作用比较
2020-12-08姜锋张莉梁冲
姜锋,张莉,梁冲
(东部战区总医院秦淮医疗区 1.麻醉科,2.神经外科,江苏 南京210002)
颅脑外伤是临床常见的危急重症,多因外力剧烈撞击而致颅脑损伤,病情进展快,直接威胁患者生命。手术是其主要治疗手段,但患者术后常表现为交感兴奋、躁动不安;同时患者术后存在再出血及脑水肿等导致脑疝形成的严重并发症。因此,选择一种既能快速达到镇静目标,又能使患者处于随时可被唤醒状态的安全有效药物,对于缓解患者疼痛程度、降低脑代谢水平、改善预后具有重要意义[1]。丙泊酚是一种重症加强护理病房(intensive care unit, ICU)常用的短效镇静剂,通过激活中枢神经系统的γ-氨基丁酸(γ-aminobutyric acid, GABA)受体氯离子复合物达到快速镇静止痛的作用,但其在临床使用过程中存在明显缺陷,如单独应用时麻醉效果有限,需要较大的使用量才能达到预期效果,且伴随着循环抑制等[2]。右美托咪定可直接作用于患者脑部α 受体,在产生良好的镇静效果前提下,可有效抑制疼痛信号传递,降低术后恶心、呕吐的发生率;同时右美托咪定产生的镇静效果可逆,对患者意识评估影响较小,有利于临床医师对患者状态进行判断[3]。本研究通过监测记录颅脑外伤患者各项实验指标变化,比较右美托咪定与丙泊酚的镇静效果、血流动力学及脑保护作用。
1 资料与方法
1.1 临床资料
选取2017年1月—2019年12月在东部战区总医院秦淮医疗区住院治疗的颅脑外伤患者76 例。其中,男性48 例,女性28 例;年龄24 ~63 岁,平均(46.28±13.68)岁;体重(57.03±16.07)kg;格拉斯哥昏迷评分(Glasgow coma scale, GCS)3 ~12 分。采用随机数字表法将患者分为对照组和观察组,每组38 例。对照组男性23 例,女性15 例;年龄24 ~61 岁,平均(45.17±12.38)岁;体重(58.42±16.39)kg;GCS 评分为4 ~12 分。观察组男性25 例,女性13 例;年龄24 ~63 岁,平均(47.04±12.17)岁;体重(56.93±15.37)kg;GCS 评分3 ~11 分。纳入标准:①符合颅脑损伤救治指南诊断标准[4],经MRI或颅脑CT 检查证实;②符合镇静镇痛药物使用指征;③符合美国麻醉师协会(American society of anesthesiologists, ASA)分级Ⅱ、Ⅲ级。排除标准:①重要脏器严重功能异常或障碍;②严重传染类疾病;③实验药物过敏史。本研究通过医院伦理委员会批准,患者及其家属知情同意。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
两组患者入手术室后检测心电图、血压及呼吸频率等,建立外周静脉通路,局部麻醉下桡动脉下穿刺检测动脉血压。术后转入ICU 行右颈内静脉逆行穿刺置管采集血气分析。观察组给予右美托咪定(江苏泰州扬子江药业集团有限公司,国药准字H20183219)负荷量1μg/kg,输注速率为0.3μg/(kg·h),持续泵入6 h;对照组给予丙泊酚注射液(广东清远嘉博制药有限公司,国药准字H20143355)负荷量0.5 mg/kg静脉推注,输注速率为0.5 mg/(kg·h),持续泵入6 h。
1.3 评价指标
监测患者用药前(T1)、用药后2 h(T2)、用药后6 h(T3)及用药后24 h(T4)的GCS 评分和面部表情分级评分(face rating scale, FRS)。GCS 评分越高,患者意识越清醒。FRS 评分越高,患者疼痛越明显。比较两组患者各时间点心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP)及血氧饱和度(oxygen saturation, SpO2),同时测定患者中心静脉氧饱和度(central venous oxygen saturation, ScVO2)、颈内静脉氧饱和度(oxygen saturation of internal jugular vein, SjVO2)、血乳酸(lactic acid, Lac)、血清神经元特异性烯醇化酶(neuron specific enolase, NSE)及血清中枢神经特异性蛋白(S100β)水平。记录患者用药期间不良反应发生情况。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用重复测量设计的方差分析;计数资料以率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者不同时间点的镇静效果比较
观察组与对照组在T1、T2、T3、T4时 的GCS、FRS 评分比较,采用重复测量设计的方差分析,结果:①不同时间点GCS、FRS 评分有差别(F=7.625 和8.316,均P=0.000);②两组GCS、FRS 评分有差别(F=6.382 和7.351,P=0.001 和0.000),观察组比对照组用药后GCS 评分高,而FRS 评分低,相对镇静镇痛效果较好;③两组GCS、FRS 评分变化趋势有差别(F=7.953 和8.016,均P=0.000)。见表1。
表1 两组患者不同时间点的镇静效果比较(n =38,分,±s)

表1 两组患者不同时间点的镇静效果比较(n =38,分,±s)
注:†与对照组比较,P <0.05。
组别 GCS FRS对照组T1 7.62±3.14 6.62±2.38 T2 5.14±1.47 3.63±1.18 T3 5.43±2.06 3.59±1.27 T4 5.73±1.84 3.43±1.42观察组T1 7.93±2.84 6.14±2.04 T2 7.64±2.31† 2.37±1.42†T3 7.54±2.18† 2.15±1.16†T4 7.73±2.74† 1.94±0.87†
2.2 两组患者不同时间点的HR、MAP 及SpO2比较
观察组与对照组在T1、T2、T3、T4时 的HR、MAP 及SpO2比较,采用重复测量设计的方差分析,结果:①不同时间点HR、MAP 有差别(F=8.659和8.527,均P=0.000),而SpO2无差别(F=1.628,P=0.764);②两组HR、MAP 有差别(F=8.965 和9.156,均P=0.000),而SpO2无差别(F=0.873,P=0.915)。观察组比对照组T2、T3时的HR、MAP 低;③两组HR、MAP 变化趋势有差别(F=7.632 和9.153,均P=0.000),而SpO2无差别(F=1.182,P=0.826)。见表2。
表2 两组患者不同时间点HR、MAP 及SpO2 比较(n =38,±s)
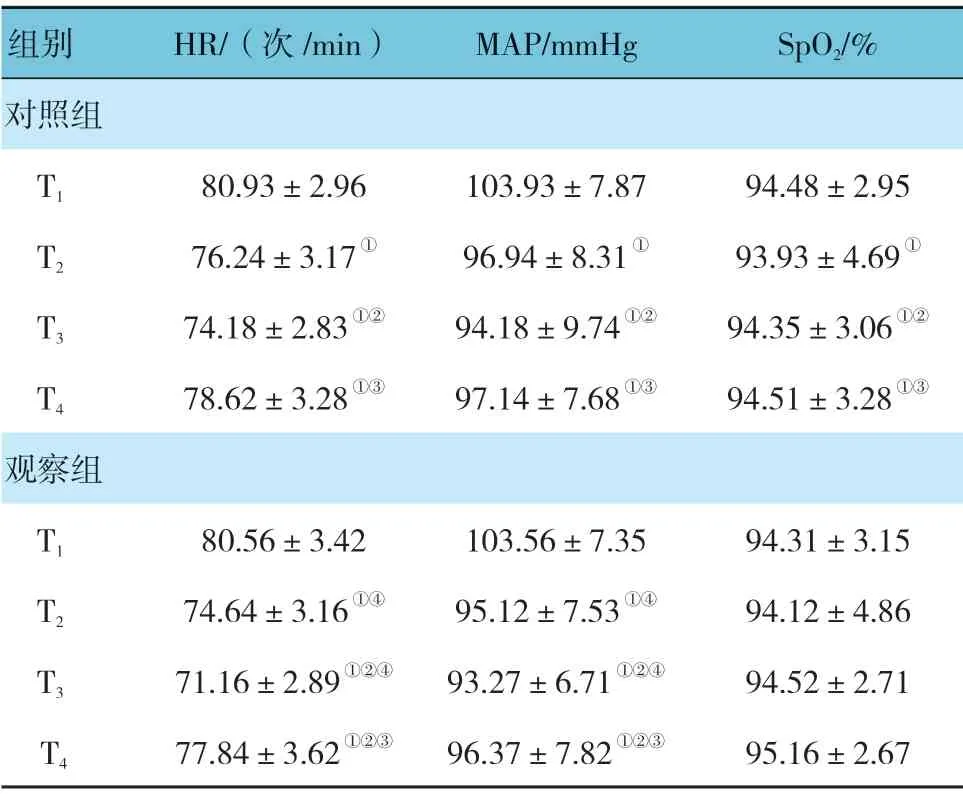
表2 两组患者不同时间点HR、MAP 及SpO2 比较(n =38,±s)
注:①与T1 比较,P <0.05;②与T2 比较,P <0.05;③与T3 比较,P <0.05;④与对照组比较,P <0.05。
组别 HR/(次/min) MAP/mmHg SpO2/%对照组T1 80.93±2.96 103.93±7.87 94.48±2.95 T2 76.24±3.17① 96.94±8.31① 93.93±4.69①T3 74.18±2.83①② 94.18±9.74①② 94.35±3.06①②T4 78.62±3.28①③ 97.14±7.68①③ 94.51±3.28①③观察组T1 80.56±3.42 103.56±7.35 94.31±3.15 T2 74.64±3.16①④ 95.12±7.53①④ 94.12±4.86 T3 71.16±2.89①②④ 93.27±6.71①②④ 94.52±2.71 T4 77.84±3.62①②③ 96.37±7.82①②③ 95.16±2.67
2.3 两组患者不同时间点脑组织代谢及损伤指标比较
观察组与对照组在T1、T2、T3、T4时的ScVO2、SjVO2、Lac、NSE 及S100β 蛋白比较,采用重复测量设计的方差分析,结果:①不同时间点ScVO2、SjVO2、Lac、NSE 及S100β 蛋白有差别(P<0.05);②两 组ScVO2、SjVO2、Lac、NSE 及S100β 蛋 白有差别(P<0.05),观察组比对照组用药后ScVO2、SjVO2水平高,而Lac、NSE 及S100β 水平低,相对脑保护效果较好;③两组ScVO2、SjVO2、Lac、NSE及S100β 蛋白水平变化趋势有差别(P<0.05)。见表3。
2.4 两组患者不良反应比较
观察组与对照组不良反应总发生率比较,经χ2检验,差异无统计学意义(χ2=1.047,P=0.746)。见表4。
表3 两组患者不同时间点脑组织代谢及损伤指标比较 (n =38,±s)
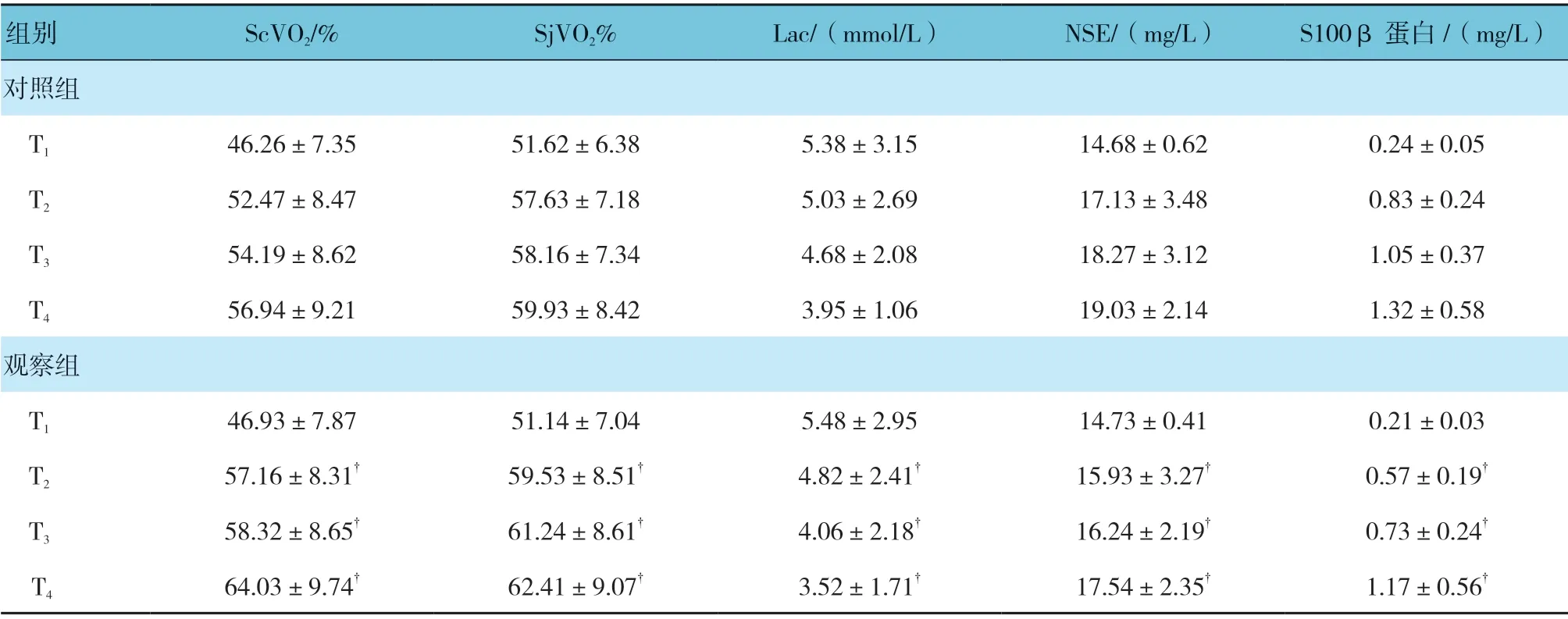
表3 两组患者不同时间点脑组织代谢及损伤指标比较 (n =38,±s)
注:†与对照组比较,P <0.05。
组别 ScVO2/% SjVO2% Lac/(mmol/L) NSE/(mg/L) S100β 蛋白/(mg/L)对照组T1 46.26±7.35 51.62±6.38 5.38±3.15 14.68±0.62 0.24±0.05 T2 52.47±8.47 57.63±7.18 5.03±2.69 17.13±3.48 0.83±0.24 T3 54.19±8.62 58.16±7.34 4.68±2.08 18.27±3.12 1.05±0.37 T4 56.94±9.21 59.93±8.42 3.95±1.06 19.03±2.14 1.32±0.58观察组T1 46.93±7.87 51.14±7.04 5.48±2.95 14.73±0.41 0.21±0.03 T2 57.16±8.31† 59.53±8.51† 4.82±2.41† 15.93±3.27† 0.57±0.19†T3 58.32±8.65† 61.24±8.61† 4.06±2.18† 16.24±2.19† 0.73±0.24†T4 64.03±9.74† 62.41±9.07† 3.52±1.71† 17.54±2.35† 1.17±0.56†

表4 两组患者不良反应比较 (n =38)
3 讨论
颅脑外伤患者早期机体处于交感神经兴奋性增强的状态,脑组织由于受伤或手术刺激,常出现不同程度的激惹、躁动。处理或施救不及时,常会导致患者病情加重,增加并发症发生概率,严重时甚至可危及患者生命[5]。镇静、镇痛类药物的使用,让患者在保持镇静状态的同时,能有效降低患者氧耗量及代谢,从而缓解交感神经兴奋,达到镇痛抗焦虑的作用。但颅脑外伤患者又需保留唤醒系统功能,以便临床早期判断患者意识和是否发生并发症[6]。因此,对颅脑外伤患者选择镇静镇痛类药物的原则是既能减轻患者躁动又能在保持镇静的同时被唤醒,兼顾稳定患者血流动力学和保护脑组织的功能[7]。
丙泊酚作用时间较短并且见效快,是临床常用的短效静脉用脂溶性全身麻醉药物,可用于全身麻醉或成人患者手术时的清醒镇静及辅助通气时的镇静。但临床治疗过程中单独使用此药物进行镇静时,存在明显的镇痛作用不足及对心血管的抑制性等缺陷,且用药量越大对呼吸的抑制性越强烈[8];同时,丙泊酚在镇静期间对患者意识影响较大、催眠效果强,进而导致患者不易唤醒无法准确判断患者状态,干扰医师判断。右美托咪定是一种高效的选择性α 受体激动剂,具有镇静效果的同时易被唤醒。其作为平衡麻醉的辅助药物时,可以明显降低其他药物使用量,减少术后出现谵妄、呼吸抑制和呕吐的概率,具有预防神经元损伤的作用,对预后具有积极意义[9]。研究显示,右美托咪定起效快,除了具有确切有效、易被唤醒的镇静作用外,还可以降低术后恶心、呕吐的发生率及炎症反应,有支持动力学稳定和保护脑组织的潜在作用[10]。
本研究结果中,用药后观察组GCS 评分较对照组高,且镇痛效果更好。患者处于随时可被唤醒的状态,有利于临床医师对病情变化进行评估。右美托咪定除镇静外的麻醉与镇痛作用,还对儿茶酚胺的释放有着良好的调控作用,有助于控制患者血压水平,有效维持心血管稳定状态,预防因缺血而造成的心肌损伤[11]。本研究结果中,用药后观察组不同时期HR、MAP 较对照组降低,但变化仍处于正常范围内,且SpO2水平无较大变化。说明右美托咪定在患者术后镇静过程中,镇静效果好,利于患者恢复,能够激活血管平滑肌上的受体,收缩外周血管,维持心血管及相应血流动力学的稳定状态,对患者呼吸无明显影响[12]。
观察脑血流灌注情况及脑组织耗氧量的变化可通过监测患者ScVO2、SjVO2及Lac 水平[13-14]。而血清NSE 和S-100β 蛋白水平可间接反映脑组织损伤程度的严重性[15-16]。S-100β 蛋白在正常情况下由于血脑屏障的存在,无法在血液中检测到,但在脑外伤、蛛网膜下腔出血、血-脑脊液屏障受损等情况下,血清NSE 及S100β 蛋白水平会显著升高,且随着损伤严重程度的增加而升高。本研究中两组用药后,观察组上述指标均优于对照组。说明右美托咪定较丙泊酚能够更加有效地减轻对中枢神经及神经胶质细胞的损伤,具有更强地降低脑代谢及保护脑细胞的作用[17]。本研究结果还显示,两组患者不良反应发生情况无差异,说明右美托咪定用于颅脑外伤术后在一定程度上降低患者的应激反应,镇静、镇痛效果显著,在临床应用中安全可靠[18]。
综上所述,右美托咪定可以有效地提升颅脑外伤患者的镇静、镇痛效果。其在维持血流动力学稳定的同时,能够有效降低脑代谢、保护脑细胞,安全性高,具有重要的临床应用价值。
