甲状腺乳头状癌并发桥本氏甲状腺炎患者BRAF-V600E基因表达及T淋巴细胞亚群分析
2020-12-08孟凡萍
孟凡萍,郝 坡,范 慧
(1.重庆三峡中心医院 ,重庆 404000;2.重庆三峡医药高等专科学校 ,重庆 400020)
甲状腺癌(thyroid carcinoma,TC) 是头颈部最常见的内分泌腺恶性肿瘤,其中最多的是甲状腺乳头状癌(papillary thyroid carcinoma,PTC),占TC的70%~80%,在过去的十年中,PTC的发病呈上升趋势,严重危害人类健康。由于PTC患者中很大一部分并发桥本甲状腺炎(Hashimoto’s thyroiditis,HT),故学者们认为HT与PTC存在很大的相关性。HT属于器官特异性免疫性甲状腺疾病,近年来发病已高达(22.5~40.7)/10万。该病有癌变的可能性,但其发病机制尚不清楚,目前多数人认为该病的癌变与患者的基因突变与免疫状态等多种因素相关。BRAF基因在人体7号染色体上,是人类最重要的原癌基因之一,大约8%的人类肿瘤发生BRAF突变, V600E是BRAF基因最常见的一个突变位点,主要发生在甲状腺癌、结肠癌、黑色素瘤、非小细胞肺癌中,该突变导致下游MEK-ERK信号通路持续激活,对肿瘤的生长增殖和侵袭转移至关重要。大量的研究证实,BRAF-V600E基因突变与甲状腺癌的诊断、治疗和判断预后都有重要联系。BRAF-V600E基因诊断PTC的特异度几乎可达100%。HT是细胞免疫功能紊乱导致,T淋巴细胞亚群代表着机体的细胞免疫状态,故本次研究通过研究PTC,PTC并发HT,单纯HT患者BRAF-V600E基因的表达以及外周血T淋巴细胞亚群的变化特征,探讨其BRAF-V600E基因的突变率以及机体的免疫状态,旨在为二者之间的联系提供一些实验依据。
1 材料与方法
1.1 研究对象 选取2018年9月~2019年8月于本院就诊的单纯PTC患者(PTC 组)45例、单纯HT患者(HT组)55例、PTC并发HT患者(PTC-HT组)42例,以健康体检者(NC组)患者50例为对照,年龄21~72岁,平均年龄45.7岁。所有病例均经过病理证实,临床资料完整,排除其他肿瘤,以及对本研究所涉及疾病有影响的其他疾病,患者亦未接受过免疫治疗。
1.2 试剂和仪器 核酸提取试剂、人类BRAF基因V600E突变检测试剂盒(荧光PCR法)为厦门艾德生物医药科技公司产品,紫外分光光度计购自美国life公司,淋巴细胞亚群分析试剂盒、BD FAS CALIBUR 流式细胞分析仪以及FCAP CELLQUEST分析软件为美国BD公司产品。
1.3 方法
1.3.1 人类BRAF-V600E基因突变的检测:样本总DNA的提取:192例患者均经穿刺取新鲜甲状腺组织,经5 g/dl福尔马林固定后,用吸附柱法提取样本总DNA,用紫外分光光度计测定浓度,确保其A260nm/A280 nm在1.8~2.0内。
聚合酶链反应(polymerase chain reaction,PCR)测定:PCR操作、反应过程及结果判定按照标准操作程序进行,并设立阳性质控品和阴性对照,共同进行检测和分析。
1.3.2 人T淋巴细胞亚群的检测:采集各组受试者静息状态下外周血标本2ml,经EDTA-K2抗凝后上机检测,用流式细胞术来分析各组受试者T淋巴细胞亚群分布,用CD3+(PE标记)、CD4+(PerCP标记)、CD8+(FITC标记)分别设门,分别圈出阳性细胞后,对数据进行采集和分析,计算CD4+T细胞数、CD8+T细胞数,以及CD4+/CD8+比值。
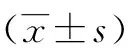
2 结果
2.1 PTC组、HT组、PTC+HT组和NC组 BRAF-V600E突变率 PTC 组、HT组、TC-HT组BRAF-V600E的突变率分别为48.15%(26/54),1.81%(1/55),66.67%(28/42),而NC组BRAF-V600E未突变。
2.2 PTC组、HT组、PTC+HT组和NC组T淋巴细胞亚群分析结果 见表1。 通过三个观察组与NC组的比较和观察组之间的比较可知,三个观察组CD8+均比NC组显著升高,CD4+均比NC组显著降低,差异有统计学意义(P<0.05),PTC组患者CD4+显著低于HT组(P<0.05)和PTC-HT组,PTC-HT组CD4+又显著低于HT组,差异均有统计学意义(P<0.05)。三个观察组CD4+/CD8+均比NC组显著下降,其中PTC组下降最显著, 其次是PTC-HT组、HT组,差异均有统计学意义(P<0.05)。
3 讨论
PTC是内分泌系统最常见的恶性肿瘤,且患病率逐年上升。其发生机制可能与机体内分泌失调、免疫功能紊乱和基因突变有密切关系[1]。有报道,近年来,HT伴PTC发生率高达58.3%,可见桥本氏甲状腺炎与癌变有非常大的关系[2-3]。HT是常见的自身免疫性甲状腺疾病,其主要特征是体内出现特异性甲状腺抗体,甲状腺组织中存在着大量淋巴细胞、浆细胞浸润,最终引起甲状腺组织结构破坏,造成甲状腺功能低下。HT的癌变问题是近年来医学界的研究热点,但发病机制尚不明确,有学者认为HT是PTC的危险因素[4],也有学者认为HT对于PTC是一种保护因素[5]。本研究就是基于PTC的发病机制,通过研究PTC,PTC-HT,单纯HT患者的BRAF-V600E基因的突变率以及T淋巴细胞亚群的变化,探索HT与PTC之间的相互关系。
BRAF基因是一个非常重要的原癌基因,该基因位于人类7号染色体上,编码RAF家族丝氨酸/苏氨酸蛋白激酶,是MAPK/ERK信号通路的关键分子,与PTC、结肠癌、非小细胞肺癌以及黑色素瘤等相关[6],BRAF-V600E在甲状腺其他肿瘤中几乎未见突变,而仅在PTC中有突变,可以说BRAF-V600E基因突变是PTC诊断的特异性标志物[7]。有研究报道,BRAF-V600E位点的突变与PTC的侵袭性、转移和复发相关,BRAF-V600E不仅可启动正常的甲状腺滤泡细胞肿瘤发生,还能维持和促进PTC的侵袭性[8]。本研究显示,PTC 组患者BRAF V600E突变率48.15%,PTC并发HT组为66.67%,PTC并发HT后,突变率高于单纯PTC组,而单纯HT组患者BRAF-V600E突变率仅为1.81%,这与大部分学者研究结论相符,提示BRAF-V600E突变与HT是否发生癌变有关,BRAF-V600E可能是HT发生癌变的危险因素。该基因位点不仅可作为甲状腺肿瘤良恶性的鉴别,还有助于后续综合治疗,以及以该基因为靶点的药物研发。
注:a与NC相比较;b与HT组比较;c与PTC-HT组比较。
HT是一种免疫性疾病,在人类自身免疫过程中,T细胞所介导的细胞免疫与PTC以及HT的发生发展有着密不可分的关系[9-10]。辅助性T细胞(Th)和细胞毒性T细胞(Ts)是T细胞的两个亚型,前者表达CD4+,后者表达CD8+,二者共同维持机体的免疫稳定性,常用CD4+/CD8+的比值来衡量机体的免疫状态,一般此比值维持在1.5~2.5之间,此值的高低,代表了机体细胞免疫水平。CD4+T细胞与CD8+T细胞二者中的一方升高或降低,或者出现比值倒置,表明机体正常的免疫平衡状态被打破,细胞免疫功能被抑制,免疫细胞的活化和增殖速度减慢,分泌细胞因子减少,对肿瘤的识别和杀伤能力也随之下降,从而增加了肿瘤的发病风险。机体发生HT时,在环境等因素的诱导下,B细胞受到CD4+T细胞活化后,被募集至甲状腺并产生甲状腺自身抗体,导致该器官的自身免疫性损害。同时,活化的CD4+T细胞进一步活化CD8+T细胞,产生抗体依赖的细胞介导的细胞毒作用(antibody-dependent cell-mediated. cytotoxicity,ADCC)效应,使甲状腺细胞进一步受到损害。因此,HT的发病机制有体液免疫和细胞免疫的共同参与[11]。近年来,PTC并发HT的病例逐年增多,HT患者相比其他甲状腺疾病来说,更容易发生癌变,而癌变后绝大多数为PTC。有研究发现HT与PTC之间存在免疫方面的相互联系[12-13]。PTC体内CD4+T细胞持续下降,而CD8+T细胞持续增多,CD4+/CD8+比例持续降低,而在HT体内有CD4+T细胞减少,而CD8+T细胞增多现象,说明在HT与PTC机体有相似的免疫状态。本研究显示,HT,PTC,PTC并发HT三组的CD8+均比NC组升高,CD4+均比NC组降低.CD4+/CD8+均比NC组显著下降,说明PTC及PTC+HT,HT患者T淋巴细胞亚群均分化异常,机体存在免疫功能障碍,尤以PTC为甚。提示甲状腺癌变与机体免疫功能异常有关,HT并发PTC过程中,免疫因素起着关键作用,其癌变可能由于机体长期处于持续免疫功能异常的环境而导致。希望能通过检测患者外周血T淋巴细胞亚群,达到对PTC风险的预测和评估,CD4+,CD8+,CD4+/CD8+也将作为HT,PTC,PTC并发HT 患者免疫治疗的靶点。
