基于RNA-seq分析戊型肝炎病毒感染HepG2细胞后的差异表达基因
2020-12-07唐媚娜肖卫红饶亚华胡志敏
唐媚娜,何 伟,肖卫红,熊 银,饶亚华,胡志敏
戊型肝炎病毒(Hepatitis E virus, HEV)是引起戊型肝炎(Hepatitis E,HE)的病原体,经粪-口途径传播。在发展中国家,戊型肝炎是一个重要的公共卫生问题,我国是HEV的流行区。HEV是单股正链RNA病毒,呈球形、直径27~34 nm,无包膜,核衣壳呈二十面体立体对称。基因组长约7.2 kb,3′端有poly A尾,有3个开放阅读读框(Open Reading Frame, ORF)。HE是一种自限性传染病,主要导致隐性感染及急性肝炎,一般不发展为慢性肝炎。戊型肝炎在15~39岁的青年和成人高发,孕妇罹患率高,且病情严重,在妊娠的后3个月发生感染病死率可达20%[1]。有研究表明,它与器官移植患者、免疫抑制患者以及老年人的戊型肝炎慢性化有关[2-3]。
RNA-Seq,即RNA测序,又称转录组测序,是最近发展起来的利用深度测序技术进行转录组分析的技术。通过Illumina高通量测序平台,将RNA反转录为cDNA进行测序,再通过直接比对该基因组区域的reads数来衡量其转录水平。近年来,随着大规模测序技术的不断发展,RNA-Seq技术被广泛应用于各类研究领域,极大地改变了转录组研究的前景[4-5]。与基因芯片相比,RNA-Seq技术可定量研究RNA的表达水平,其结果更为准确,且方便在实验结果间进行直接比较。通过RNA-Seq技术可准确测定特异基因的表达水平、差异剪接和等位基因转录本的特异表达,来说明许多生物相关的问题[6]。目前RNA-Seq技术广泛应用于差异表达基因的筛选,并且可用于健康组织与疾病组织之间基因表达差异的研究[7]。
为了更好地了解感染后发生的即时变化,本研究基于RNA测序 (RNA-Seq),在基因水平上对HEV感染前后HepG2细胞的差异表达基因进行研究,旨在筛选出与HEV感染相关的候选基因,从而为今后深人研究HEV感染相关的基因及其功能提供理论依据。
1 材料与方法
1.1病毒株与细胞 HepG2细胞株购自上海中科院细胞库。HEV genotype-3 Kernow-C1/p6病毒株来自武汉大学基础医学院医学病毒研究所,滴度约为3×108pfu/mL。
1.2试剂与耗材 DMEM (Dulbecco’s Modified Eagle Medium)培养基、 胎牛血清(Fetal Bovine Serum)及胰蛋白酶 (Trypsin)均购自GIBCO公司(Grand Island, NY, USA);总RNA提取Trizol Regent购自Thermo公司(Waltham, MA, USA);反转录试剂盒PrimeScriptTMRT reagent Kit with cDNA Eraser购自Takara公司(Shiga, Japan);mRNA纯化试剂盒(Dynabeads mRNA direct Purification Kit)购自Thermo公司;NanoDropND-1000分光光度计购自Thermo公司。
1.3样品获取、处理与测序 感染前,将HepG2细胞均匀种植于48孔板,培养基为含10%胎牛血清的DMEM高糖培养基(10% FBS/DMEM),37 ℃,5% CO2环境下培养。感染组4孔,对照组4孔(约 5×104cells/孔)。当细胞汇合度达到60%~70%后,感染组接种5×103GE(genome equivalents)/细胞的HEV genotype-3 Kernow-C1/p6病毒,对照组用等量4% PEG8000处理;感染4 h后,弃去培养基,以1×PBS洗涤3次后,加入新鲜10% FBS/DMEM 维持培养24 h[1 dpi(day(s)post infection)]后,收取第1批RNA;继续培养48 h(3 dpi)后,收取第2批RNA;继续培养48 h(5 dpi)后,收取第3批RNA;继续培养48 h(7 dpi)后,收取第4批RNA。使用分光光度计检测RNA的OD260/OD280及浓度。将符合纯度及浓度要求的15 μg RNA用干冰保存送测序。
利用第二代高通量测序技术Illumina Hiseq 2000对HEV感染前后(感染前、后各4组)的HepG2细胞RNA进行转录组测序,测序由本实验室自行完成。其中HEV-1、HEV-2、HEV-3、HEV-4为感染组,Mock-1、Mock-2、Mock-3、Mock-4为对照组。具体测序程序包括:提取总RNA并纯化mRNA,将所得到的mRNA随机打断成片段,再用随机引物和逆转录酶合成cDNA片段,再对cDNA片段进行末端修复,并连接测序接头,富集纯化的cDNA模板后用Agilent Technologies 2100 Bioanalyzer对文库进行质检,最后上机测序。
1.4免疫印迹和免疫荧光检测感染细胞病毒表达 使用 2×SDS Sample buffer 裂解上述感染组及对照组(感染4 h后,弃去培养基,以1×PBS洗涤3次后,加入新鲜10% FBS/DMEM 维持培养24 h)细胞 10 min,超声 5 s×3 次(无需 100 ℃变性)。使用 BCA 蛋白定量试剂盒进行定量,取 20 μg 总蛋白上样(20 μg/孔)。根据分子克隆所示方法制备 8% SDS-PAGE 分离胶,5%堆积胶,以 80 V 恒压电泳。290 mA,转膜 2 h,封闭液(5%脱脂牛奶/PBS)封闭 1 h。5%BSA/PBS 稀释的 Anti-pORF2 antibody 室温孵育 1 h(1∶5 000)。0.1% Triton X-100/PBS 洗膜10 min×2次。5% BSA/PBS 稀释的Anti-IgG-HRP antibody室温孵育1 h。0.1% Triton X-100/PBS 洗膜 10 min×3 次,按 ECL 说明书配制 ECL 液,孵育膜 5 min。暗室中显影,根据发光强弱调节压片时间使条带更清晰。
将细胞种植在加有灭菌圆形盖玻片的 24 孔板中(约 1×105cells/孔),按1.3中方法感染细胞,用 10% FBS/DMEM 培养于 37 ℃,5% CO2培养箱中。感染4 h后,弃去培养基,以1×PBS洗涤3次后,加入新鲜10% FBS/DMEM维持培养24 h后,吸去培养基,用4%多聚甲醛/蔗糖/PBS固定15 min,PBS洗5 min×2次,0.1% Triton X-100/PBS 透化10 min,PBS洗10 min×2次;5% BSA/PBS封闭30 min;5% BSA/PBS稀释的Anti-pORF2 antibody室温孵育1 h(1∶500);PBS洗5 min×5次;5% BSA/PBS 封闭20 min;5% BSA/PBS稀释的Anti-IgG-cy2 antibody(1∶400)室温孵育1 h;PBS洗5 min×7次;加入1 μg/mL的DAPI染核2 min;PBS洗5 min×2次;H2O洗1次。在载玻片上滴60%甘油4 μL,将盖玻片从一侧轻轻粘在载玻片上,在荧光显微镜上观察pORF2的表达情况,用激光共聚焦显微镜扫描和照相。
1.5数据处理与分析 用FastQC分析软件(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)对RNA-seq中测得的Raw data进行质量控制和过滤,并去除带接头、含有poly-N以及低质量reads形成纯净序列(Clean reads);将得到的Clean Reads采用STAR软件对RNA-seq数据进行比对(http://bioinformatics.oxfordjournals.org/content/),mapping至人的参考基因组(GRCh38.p6 assembly of the human reference from NCBI, ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF),所得的mapped Reads为有效测序量。
1.6差异表达基因筛选及基因功能和通路分析 对mapped reads进行基因表达定量,使用HTSeq (http://www-huber.embl.de/users/anders/HTSeq/doc/count)分别对感染组样本和对照组样本进行reads计数。使用DESeq2(http://genomebiology.com)对感染组和对照组进行基因表达量比较,以差异倍数(Fold change)绝对值≥2且Padj<0.05(Padj是P值经过多重校验校正后的值)为标准计算出感染组样本和对照组样本的差异表达基因,并在DAVID(https://david.ncifcrf.gov/)数据库对差异表达基因进行GO功能富集分析通路富集分析,采用Fisher检验计算每个GO的P值,筛选出差异基因富集的显著性通路(P<0.05)。
2 结 果
2.1质量控制和短序列比对 感染组细胞成功感染HEV genotype-3 Kernow-C1/p6病毒(图1)。
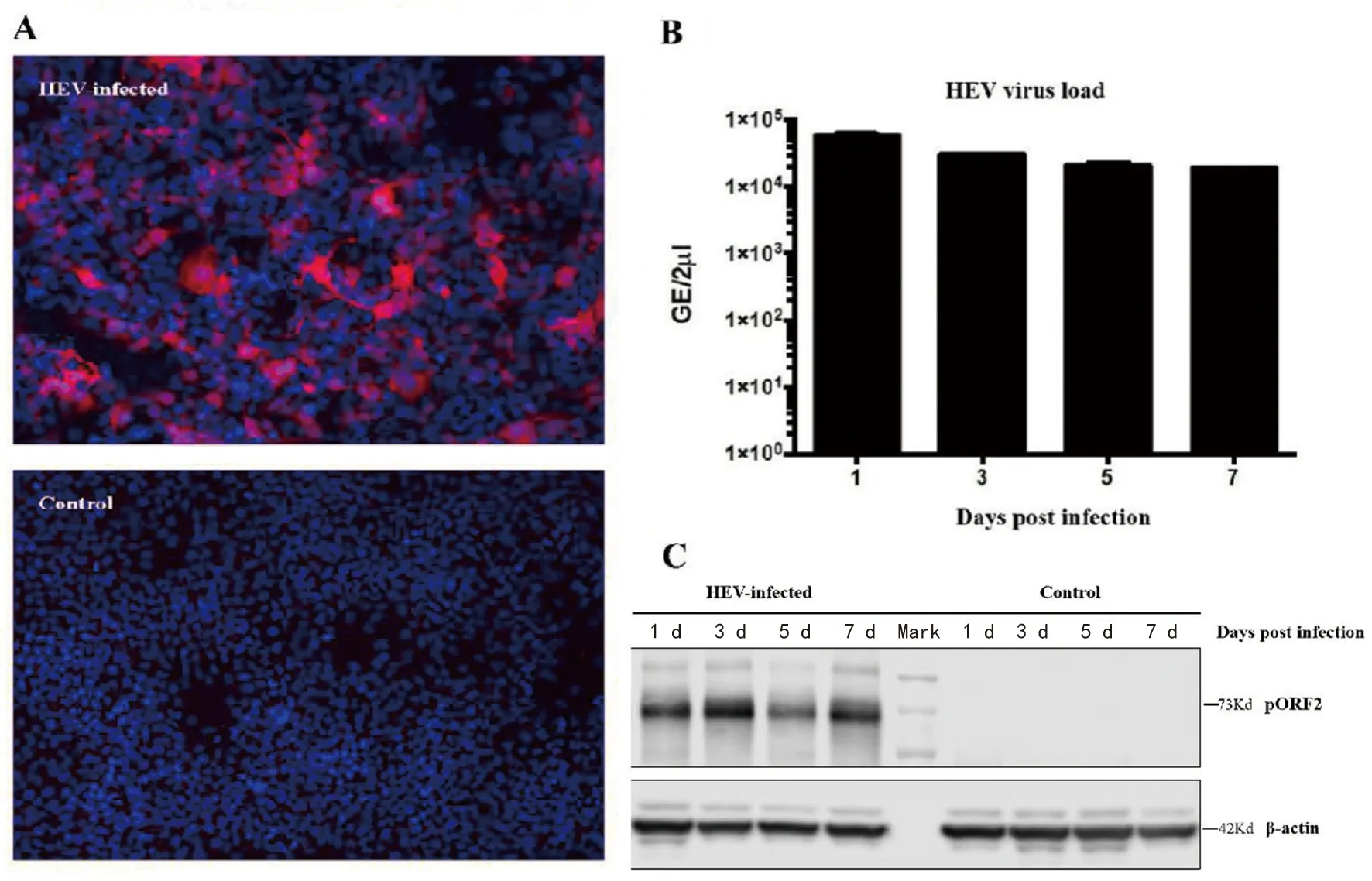
A为HEV感染组和对照组细胞免疫荧光,感染组成功感染病毒;B为感染组细胞感染后,1~7 d内的HEV病毒载量;C为 Western Blot检测细胞内病毒pORF2表达情况。
从质控结果可知,8个样本测序结果均合格,可用于后续生物信息学分析。应用STAR软件对预处理后的reads进行Genome mapping,将所得到的reads与人的参考基因进行比对(表1)。
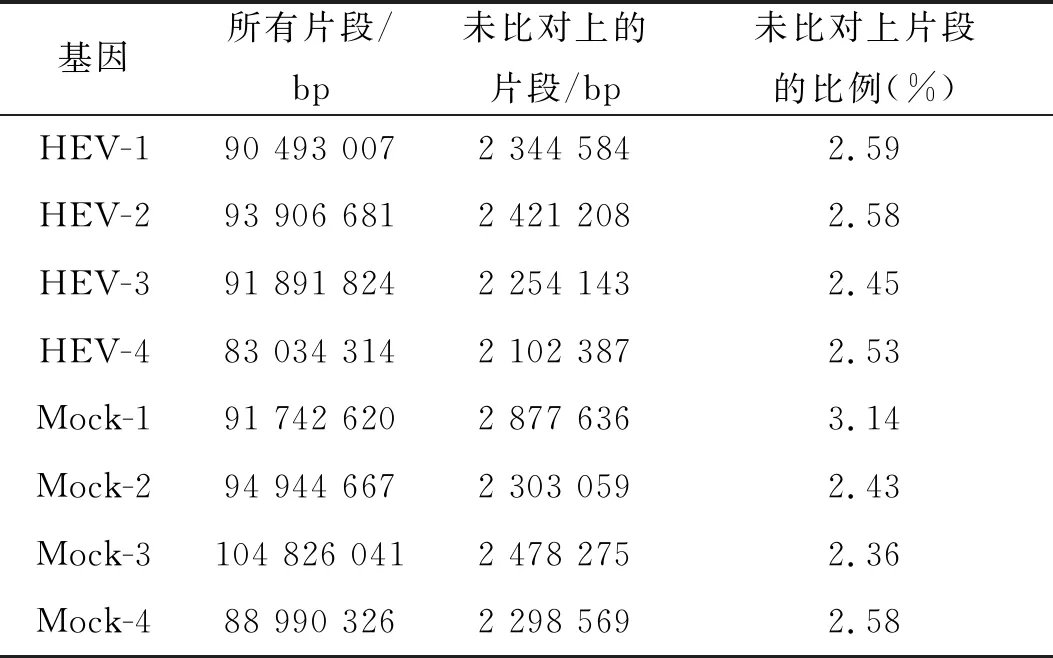
表1 感染组与对照组测序reads比对
对mapped reads进行基因表达定量,使用HTSeq分别对实验样本和对照样本进行reads计数,制作密度散点图R-I (Ratio-intensity,图2A),显示HEV感染组和对照组基因表达水平。
2.2差异表达基因筛选 由主成分分析图(Principal Component Analysis,PCA,图2B)可以看出,感染组和对照组在转录水平上具有明显的差异。图2C显示,以FDR<0.1 (FDR是对P-value的校正值)且差异倍数绝对值≥2(Log2FC≥1或Log2FC≤-1)为条件进行筛选,共得到132个差异基因,其中,上调表达基因127个,下调表达基因5个。表2列出了差异倍数排名前10的基因列表。

A为密度散点图,红点表示HEV感染组的整体表达水平,黑点表示对照组的整体表达水平;B为主成分分析图,蓝点表示戊型肝炎感染组,红点表示对照组;C为戊型肝炎病毒感染细胞与对照细胞差异基因表达的火山图
2.3基因GO功能富集分析 如图3A(生物学过程)和3B所示(分子功能),显示了部分差异表达基因功能富集结果。其中,横轴代表功能显著性水平(Padj)的-Log10P值;纵轴代表Gene Ontology数据库中对应GO的条目名称。由结果可知,在对差异表达基因进行的富集功能分类中,在生物学过程条目中排名前15位的GO分类分别为:病毒防御、I型干扰素信号通路、病毒基因组复制的负调控、抗病毒、IFN-γ介导的信号通路、固有免疫应答、IFN-α应答、I型干扰素产生的负调控作用、IFN-β应答、IFN-γ应答、免疫反应、炎症反应、ISG15蛋白共轭、IFN-α的细胞应答及病毒转录的负调控等;在分子倍数改变代表感染组和对照组基因表达量的差异倍数,校正后P值即该基因是否为差异表达基因的概率,P<0.05表示基因表达差异有统计学意义。

表2 差异倍数排名前10的基因列表
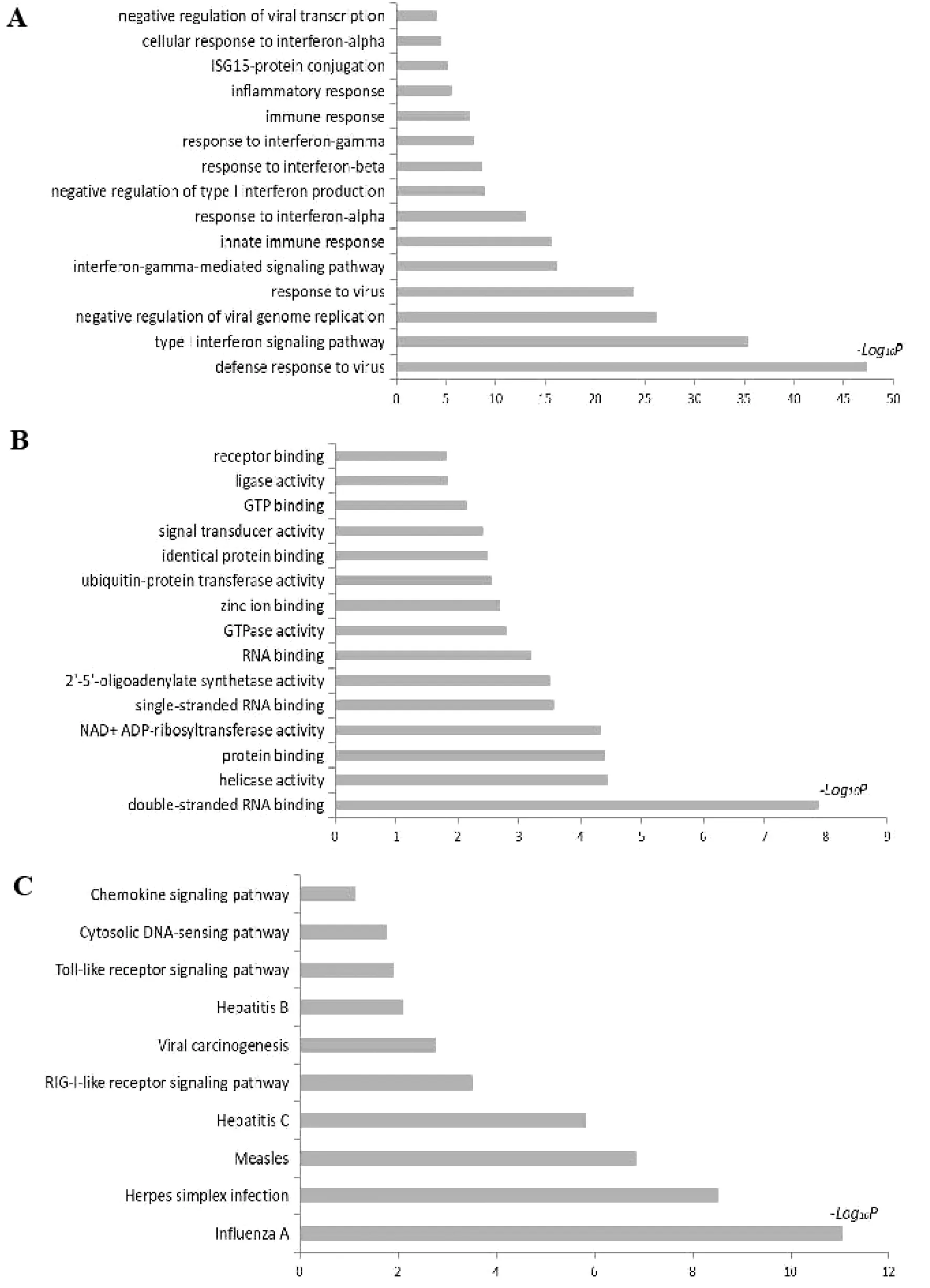
A为差异表达基因功能富集GO分析(生物学过程)结果示意图;B为差异表达基因功能富集GO分析(分子功能)结果示意图;C为通过DAVID 和KEGG数据库获取的差异表达基因的通路富集分析。
功能条目中排名前15位的GO分类分别为:双链RNA结合、解旋酶活性、蛋白结合、NAD+ADP-核糖基转移酶的活性、单链RNA结合、2′-5′-寡腺苷酸合成酶活性、RNA结合、GTP酶活性、锌离子结合、泛素蛋白转移酶活性、同一蛋白结合、信号转导活性、GTP结合、连接酶活性及受体结合等。
2.4信号通路分析 对差异表达基因通过DAVID及KEGG数据库进行信号通路分析,以更深入地了解该基因的生物学功能。基于DAVID数据库进行通路注释,采用Fisher检验筛选差异基因富集的显著性通路(P<0.05)。如图3C所示,在对差异表达基因进行的富集功能分类中排名前10的信号通路分别为:甲型流感、单纯疱疹感染、麻疹、C型肝炎、RIG-I样受体信号、病毒致癌、乙型肝炎、Toll样受体信号、胞质DNA传感和趋化因子信号转导通路。
3 讨 论
HEV感染会引起机体产生免疫应答,免疫应答是机体的重要防御机制,也是导致宿主细胞损伤继而产生临床症状的关键因素。戊型病毒性肝炎的临床表现从自限性急性病毒性肝炎(AVH)至急性肝功能衰竭(ALF),病理变化包括免疫细胞浸润和肝细胞坏死、溶解。人类和动物的研究结果均表明,HEV对肝细胞无直接病变作用,肝细胞的损害并非病毒复制所致,而是由宿主免疫反应引起的宿主细胞损伤,病毒诱发的细胞免疫参与了戊型肝炎病毒感染的发病机制[8]。同时临床上观察到戊型肝炎急性期, 患者外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMCs)在受到ORF2抗原刺激时反应增强,CD4+T细胞数量升高,产生干扰素-γ (IFN-γ) 的量明显高于对照,推断CD4+T细胞,可能参与了戊型肝炎急性患者的肝细胞损伤;此外,临床患者在出现转氨酶升高、黄疸等症状时,伴随抗体上升和病毒载量下降等现象,也表明了肝细胞损伤与体液免疫和细胞免疫反应有关[9]。
本实验通过转录组测序技术,对HEV感染前后HepG2细胞的差异表达基因进行分析,共筛选得到差异表达的基因132个,上调表达基因127个,下调表达基因5个。通过差异表达基因筛选、GO功能富集分析以及KEGG通路分析,筛选出几个与抗病毒免疫相关的基因,与对照组相比,在HEV感染组表达显著上调,这些基因可能与HEV感染相关,参与了宿主抗病毒过程,可作为候选基因,作为进一步深入研究的基础。
3.1DDX58和IFIH1 (RIG-I和MDA5) DDX58基因编码一种RNA解旋酶,与许多细胞过程有关,包括RNA结合和RNA二级结构的改变。它参与病毒双链RNA的识别和免疫应答的调节,相关通路为DDX58/IFIH1 (RIG-I/MDA5)诱导的IFN-α和IFN-β通路。IFIH1,是DDX58的旁系同源基因,与DDX58协同作用诱导I型干扰素产生,发挥抗病毒作用。IFIH1和DDX58与中国汉族人群的慢性丙型肝炎发生相关,是RNA病毒感染天然免疫应答的重要启动子,可能在丙型肝炎病毒(HCV)感染结局中起重要作用[10]。结合本文的研究结果,猜测IFIH1和DDX58可能参与HEV感染过程。RIG-I样受体(RLRs)DDX58和IFIH1是天然抗病毒反应的关键因子。一旦识别出病毒RNA,它们与MAVS相互作用,可能诱导产生I型干扰素[11]。DDX58、IFIH1和IFN调节因子1(IRF1)是抗HEV的关键基因,DDX58的基础表达可抑制HEV感染天然配体5′-三磷酸核糖核酸对RIG-I途径的激活可能抑制戊型肝炎病毒的复制,激活DDX58可刺激细胞通过IFN诱导的JAK-STAT级联信号,产生对HEV的天然免疫[12]。
3.2STAT1和STAT2 STAT家族成员被受体相关激酶磷酸化,形成同源或异源二聚体,转位到细胞核,作为转录激活因子发挥作用。 I型干扰素(IFN-α和IFN-β)与细胞表面受体结合后,通过蛋白激酶导致Jak 激酶(Tyk2和JAK1)活化,以及STAT1和STAT2的酪氨酸磷酸化,磷酸化的STATs二聚体化并与IRF-9 形成一个复合体,称为ISGF3转录因子,进入细胞核。ISGF3结合干扰素刺激反应元件(ISRE),激活干扰素刺激基因的转录(ISG),促进细胞进入抗病毒状态。
3.3TLR3 戊型肝炎病毒感染诱导细胞免疫应答主要是通过病原体识别受体(PRRs)实现,包括维甲酸诱导基因I(RIG-I)样受体和Toll样受体(TLRs)[13-14]。TLRs在启动固有抗病毒反应中发挥重要作用,识别病毒RNAs后,激活下游级联信号,涉及各种信号分子,如线粒体抗病毒信号蛋白(MAVS)、干扰素调节因子3(IRF3)、IRF7和核转录因子κB(NF-κB)[15-16]。TLRs的特异性配体刺激PBMCs,可以诱导I型干扰素的产生[17]。
I型干扰素,主要包括 IFN-α、IFN-β、 IFN-ε、IFN-κ、FN-ω和IFN-ν等[18-19],是细胞内抗病毒免疫的第一道防线。一旦细胞内发生HEV感染,病毒基因组被病原体识别受体识别,导致细胞内信号级联快速激活。Ⅰ型干扰素的表达诱导一系列干扰素-刺激基因,帮助细胞对付病毒感染。在感染的细胞中,I型干扰素可直接对抗病毒的感染和复制,并激活其他免疫细胞,如自然杀伤细胞,树突状细胞和Kupffer细胞。在此次研究中,IFI6、IFITM1、IFIH1、IFNL1、IRF9、ISG20、IFI35及IFIT1等多种干扰素诱导蛋白、干扰素诱导跨膜蛋白、干扰素λ1、干扰素调节因子及干扰素刺激基因表达上调,说明HEV感染后,这些基因参与了抗病毒免疫。
TLR3是单次跨膜细胞表面受体,它识别与病毒感染有关的核酸RNA,介导有效免疫所需要的细胞因子的产生,是先天免疫与适应性免疫的关键组成部分。通过TRIF/TICAM1,诱导NF-κB的活化和I型干扰素的生产,刺激细胞因子分泌并促进炎症反应。因此,TLR3可能在宿主防御病毒方面发挥作用。
TLR3和IFN-γ在戊型肝炎发病机制中起重要作用。能高水平表达TLR3和IFN-γ的患者能够控制疾病和康复;而TLR3和IFN-γ低表达的患者倾向于发展为ALF[20],与ALF患者相比,AVH患者的TLR3基因表达、抗炎和促炎细胞因子的含量均较高;IFN-γ、TNF-α、IL-10和TGF-β在PBMC培养上清液检测中也较高。沉默TLR3后,在PBMC培养上清液中IFN-γ的水平显著降低[20]。在此次研究中,TLR3表达上调,说明HEV感染后,HEV的RNA会被细胞内的模式识别受体中的TLR3识别,激活MyD88-非依赖途径信号通路,激活IRF9,调节炎性细胞因子IFN-α及IFN-β的表达,产生抗病毒作用。
3.4CXCL8(IL-8)和CXCL10 CXCL8基因编码的蛋白CXCL8是一种趋化因子,属CXC趋化因子家族的成员,主要参与炎症反应。炎症反应中,CXCL8招募中性粒细胞、嗜碱性粒细胞和T细胞到炎症部位,发挥抗感染作用。CXCL10是抗菌基因编码的趋化因子,也属CXC家族成员,是受体CXCR3的配体。结合受体CXCR3后,可刺激单核细胞、自然杀伤细胞和T细胞迁移,调控粘附分子的表达。
NF-κB 作为炎症反应的重要转导通路,参与对免疫反应及炎症反应的调控,包括介导机体对病原体入侵的天然免疫及适应性免疫应答,T、B细胞的发育、增殖及炎症反应等生物过程。NF-κB 还可调控CXCL8的表达,在本次研究中,炎性细胞因子CXCL8表达上调,说明HEV感染后,NF-κB通路激活,促进CXCL8表达上调,促进机体免疫相关蛋白合成、生长抑制、树突状细胞及NK细胞活化、CTL细胞分化以及抗体产生,并最终造成感染细胞凋亡。
3.5EIF2AK2(PKR) 该基因编码的蛋白质是一种丝氨酸/苏氨酸蛋白激酶,结合dsRNA后可通过自磷酸化激活,活化后可以磷酸化翻译起始因子(EIF2S1),使其活化从而抑制蛋白质的合成,在病毒感染的固有免疫反应中起着关键作用。EIF2AK2可选择性调节免疫应答基因的转录[21],也可通过磷酸化EIF2S1的α亚基,最终导致细胞和病毒蛋白质的合成停止,抑制病毒的复制。作为一个衔接蛋白和/或通过其激酶活性,都可以调节多种信号通路(p38-MAP激酶,NF-kB和胰岛素信号通路)和转录因子(JUN、STAT1、STAT3、IRF1,ATF3),这些转录因子参与编码促炎性细胞因子和干扰素的基因的表达。
3.6IRF-9 (ISGF3G) I型干扰素与细胞表面受体结合后,通过蛋白激酶作用导致Jak激酶(Tyk2和JAK1)活化,并使STAT1和STAT2的酪氨酸磷酸化。磷酸化的STATs二聚体化与IRF-9形成一个复合体,称为ISGF3转录因子,进入细胞核。ISGF3结合干扰素刺激反应元件(ISRE),激活干扰素刺激基因的转录,促进细胞进入抗病毒状态,发挥抗病毒效应。此外,IRF-9还可抑制细胞内HEV RNA的复制[22]。与此次研究结果类似,在一项研究中,急性HEV感染患者的细胞中,IRF-9、STAT1、IFNα和TNFα等基因表达增加[23],这些结果有助于了解HEV感染的潜在炎症过程,后续研究将关注IRF-9 在抗病毒免疫中的作用。
本研究结合mRNA转录组测序和生物信息学方法,研究了HEV感染前后HepG2细胞的差异表达基因,筛选出可能参与抗病毒免疫的基因,为研究HEV感染提供了目标,也为进一步研究HEV感染的防御反应机制和理解宿主反应提供新的见解。
利益冲突:无
