蓝氏贾第鞭毛虫α-19贾第素的单克隆抗体制备与亚细胞定位研究
2020-12-07李汶霖李淑凝沈海娥章曾思琦田喜凤
李汶霖,李淑凝,沈海娥,章曾思琦,田喜凤,王 洋
蓝氏贾第鞭毛虫(Giardialamblia,简称贾第虫),是一种世界性分布的条件致病性原虫,属于双滴虫目,六鞭毛科,贾第虫属,具有2个细胞核,是一种非常原始的单细胞真核生物,具有较大的研究价值[1]。贾第虫通过具有抵抗力但无运动能力的包囊经粪口传播感染宿主,在小肠转变为具有运动能力的滋养体,滋养体依靠鞭毛在肠腔中游动,依靠腹吸盘吸附在肠粘膜上并不断增殖,损伤肠绒毛,影响宿主的消化吸收,引起蓝氏贾第鞭毛虫病(Giardiasis,简称贾第虫病),主要症状为腹泻[2]。贾第虫病有较强的传染性以及较高的发病率,在医疗卫生条件差的国家和地区常呈暴发性流行,常引起旅行者产生腹泻,被称为“旅行者病”[3]。在我国南方患病率更高,近年相关报道南方人群贾第虫总体感染率为1.20%,慢性腹泻和饲养宠物是蓝氏贾第鞭毛虫感染的危险因素,由于卫生水平的提高,我国贾第虫感染率总体上处于较低水平[4]。贾第虫具有极其复杂的细胞骨架系统,是与致病相关的关键结构——鞭毛和腹吸盘的主要蛋白成分,因而贾第虫复杂的细胞骨架系统与贾第虫的致病性相联系[5-8]。
贾第素是贾第虫一种特有的骨架蛋白[9-10],分为α、β、γ、δ 4大类,其中α贾第素家族是其中数量最多的一族,有21个成员,按照发现时间命名,从α-1到α-19(α-7 细分为 3 种变体)[11-13]。目前认为,目前α贾第素是高等真核生物膜联蛋白Annexin的类似物[14],膜联蛋白是一种保守的钙依赖性磷脂结合蛋白,该蛋白广泛存在于各种动植物中,被认为有可能参与细胞骨架运动、细胞信号转导、细胞繁殖与分裂、膜的融合等多种的细胞生理活动。但是大多数真核生物仅有一种或几种膜联蛋白家族成员,作为一种低等真核生物,贾第虫拥有如此众多膜联蛋白类似物成员,这些成员在具体功能和发挥作用的方式上有何不同,至今尚无解释。明确未知功能蛋白的亚细胞定位,对于推测理解其功能具有很大的意义。α-19贾第素是α贾第素家族研究较少的一个成员[15],是该家族中为数不多未被定位的贾第素,国内也没有相关的研究。本研究拟从α-19贾第素蛋白的克隆表达入手,制备α-19贾第素特异性单克隆抗体并鉴定其亚细胞定位,从而为α-19贾第素相关功能以及疾病防治的研究提供材料。
1 材料与方法
1.1材料 C2株第贾第虫、小鼠骨髓瘤细胞系(Sp2/0)、原核表达质粒pET-28α(+)、大肠杆菌E.coliRosetta(DE3)菌株均由实验室保存;大肠杆菌E.coliTOP10菌株购自昂羽上海生物技术有限公司;兔抗His-Tag多克隆抗体、HRP标记的山羊抗兔IgG抗体、Alexa Fluor 488标记山羊抗兔IgG抗体、Ni—NTA预装柱和Protein G Sefinose预装柱购自上海生工生物技术有限公司;T4 DNA连接酶、限制性内切酶NcoⅠ、XhoⅠ购自宝生物工程(大连)公司;2×Pfu PCR MasterMix、血液基因组DNA提取试剂盒、DNA片段凝胶回收试剂盒、质粒小量快速提取试剂盒、BCA蛋白定量试剂盒、DAB显色试剂盒购自天根生物科技公司; PAGE凝胶快速制备试剂盒购自雅酶生物公司;弗氏完全佐剂、弗氏不完全佐剂、融合用PEG1450、HT和HAT培养基购自Sigma-Aldrich公司;引物合成及测序工作、抗原肽合成和KLH偶连工作由生工生物工程(上海)股份有限公司完成。
1.2仪器 奥林巴斯CKX31倒置显微镜、上海智诚ZHJH—C1112B超净工作台、Sigma 3K30台式低温高速离心机、Heraeus X1R台式低温高速离心机、HH—W恒温水浴箱、SHELLAB2406 CO2孵箱、9512AA2Y低温循环水浴、伯乐iMARK酶标仪、Omega Lum W 化学发光多色荧光成像系统、Scandrop2000超微量核酸蛋白测定仪、伯乐T100PCR扩增仪、DYY一6C稳压稳流电泳仪、雅马拓SQ510C高压蒸汽灭菌锅、ZHWY一100D气浴振荡摇床、Leica SP8 STED 3×激光扫描共聚焦显微镜。
1.3 方 法
1.3.1α-19贾第素的原核表达[16-17]根据GenBank上WB株贾第虫α-19贾第素基因序列(XM_001704791.1)设计上游引物(5′-CATGCCATGGCCATGGGTTGTGCCGCATCAACTC-3′) 和下游引物(5′-CCGCTCGAGGTCGCCGCGGGGAGTC-3′),上、下游引物分别含有NcoⅠ、XhoⅠ酶切位点(为下划线部分)。提取贾第虫全基因组DNA,以其为模板, PCR扩增目的序列,反应条件为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 30 s,重复30个循环;72 ℃延伸10 min。胶回收试剂盒回收目的片段PCR产物。胶回收产物经NcoⅠ和XhoⅠ双酶切后与同样酶切的 pET-28α(+)载体按摩尔比 4∶1混合,16 ℃连接反应 4 h。连接产物转化E.coliTOP10感受态细胞,通过卡那霉素抗性平板筛选阳性克隆,阳性克隆提质粒,进行双酶切鉴定,鉴定结果正确的克隆送生物公司测序。
1.3.2α-19贾第索重组蛋白的诱导表达和鉴定 将测序鉴定正确的质粒转化原核表达菌株E.coliRosetta(DE3),涂于卡那霉素和氯霉素的双抗平板上,37 ℃过夜培养,挑取阳性单菌落转接于含双抗的液体LB培养基中。37 ℃震荡培养过夜,再将所得菌株进行检测,序列正确者进行接下来的操作,按1%的接种量转移到3管3 mL新鲜双抗LB培养基中,置于37 ℃震荡培养,当OD600值达到0.6时3管分别加入终浓度0.1 mmol/L、0.5 mmol/L和1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)于30 ℃诱导表达5 h。12 000 r/min离心1 min收集菌液,用无菌水重悬,按比例加入4×SDS 上样缓冲液煮沸裂解获得全菌体蛋白,以未经诱导的转化菌为对照,Western blot和SDS-PAGE双重鉴定目的蛋白表达结果是否正确。Western blot以兔抗 His-Tag兔源多克隆抗体(1∶1 000)为一抗, 以HRP标记的羊抗兔IgG(1∶5 000)为二抗,经DAB显色观察结果。
1.3.3α-19贾第素抗原肽的设计[18]根据GenBank提供的α-19贾第素的蛋白序列,通过Clustal_X软件将α-19贾第素的氨基酸序列与其他α贾第素家族成员进行同源性比较,选择同源性最低的区段,采用DNASTAR、SYFPEITHI,Bcepred等生物学软件和网站分析所选肽段的抗原活性, 应用BLAST比对分析抗原肽与其他贾第虫蛋白的同源性。设计好的抗原肽由生工生物公司合成并与KLH偶联。
1.3.4小鼠免疫 取3只7周龄左右健康雌性BALB/c小鼠,首次免疫时将合成抗原肽与KLH偶联,用等体积的弗氏完全佐剂混合乳化,以50 μg/只剂量对小鼠进行多点皮下注射。初此免疫后每间隔2周免疫1次,共免疫5次。在第5次免疫后1周后,断尾采血,收集少量血清进行效价测定。然后对血清效价最高的免疫小鼠进行加强免疫。在进行加强免疫3 d后,取脾脏细胞准备融合[19-21]。
1.3.5细胞融合及杂交瘤细胞株的筛选 以PEG1450为融合剂,将小鼠脾细胞与处于对数生长期的骨髓瘤细胞(Sp2/0)按照10∶1比例进行细胞融合。以BALB/c小鼠腹腔巨噬细胞作为饲养细胞,分装于96孔板,在HAT选择培养基中于5% CO2、37 ℃条件下培养。5 d后更换新鲜HAT营养液,8 d后用HT培养基更换HAT培养基。待细胞覆盖孔底面积约1/4~1/3时,用合成抗原肽0.5 μg包被酶标版,间接ELISA法检测培养上清中抗体效价,阳性判断标准(OD阳/OD阴>2.5∶1),以Sp2/0的培养上清与正常BALB/c小鼠的血清作为阴性对照。对检出的阳性孔进行2~3轮有限稀释亚克隆培养,直至所有克隆化细胞孔检测阳性率达100%时,即可确定获得分泌特异性单抗的杂交瘤细胞株,及时扩大培养并冻存。
1.3.6含mAb腹水的制备及纯化 选取效价最高的3株阳性杂交瘤细胞,用不含血清的培养液混匀,腹腔注射BALB/c小鼠,每只5×105个。接种杂交瘤细胞后约10~15 d,抽取腹水,用Protein G预装柱通过亲和层析纯化抗体。
1.3.7mAb结合力和特异性的验证 将α-19贾第素原核表达质粒转化E.coliRosetta(DE3),经最适浓度IPTG诱导表达后全菌体裂解物上样,对照组为未诱导的转化菌裂解物,通过 Western blot验证所制备抗体的结合能力;利用贾第虫滋养体全裂解物通过Western blot 验证具有较好结合力的抗体的抗原特异性。
1.3.8免疫荧光鉴定α-19贾第素的亚细胞定位[21-22]将对数生长期的贾第虫滋养体接种于放有无菌盖玻片和改良TYI-S-33培养基的12孔板中,37 ℃培养4 h,取出盖玻片,室温条件下用4% 的多聚甲醛固定,PBS洗涤后再滴加 0.5% 的聚乙二醇单辛基苯基醚(Triton X 100)室温透化,5% BSA溶液室温封闭1 h。加入1∶200稀释的小鼠抗α-19贾第素单克隆抗体,置于湿盒中4 ℃过夜孵育。次日用PBS洗涤后放入1∶2 000稀释的Alexa Fluor 488标记山羊抗鼠IgG中,室温避光孵育1 h。DAPI封片剂封片后共聚焦显微镜观察荧光定位。
2 结 果
2.1α-19贾第素基因的克隆和原核表达载体构建
以贾第虫基因组DNA为模版克隆a-19贾第素编码区,PCR扩增产物经琼脂糖凝胶电泳分析,可见约1 260 bp的特异性条带,与预期大小相符(图1)。将α-19贾第素双酶切后连入原核表达质粒pET-28α(+),提取质粒NcoI和XhoI酶切鉴定后电泳结果显示可见约1 260 bp的α-19贾第素目的片段、5 300 bp的载体pET28α(+)2条电泳条带(图2),与预期结果一致。
2.2α-19贾第素的诱导表达和鉴定 转化有重组质粒的菌液加入终浓度0.1、0.5、1.0 mmol/L 的IPTG 30 ℃诱导5 h后取少量菌液进行SDS-PAGE电泳,结果显示诱导组在约49 kD处出现目的条带,在0.5 mmol/L的IPTG诱导下,重组蛋白表达最明显,而未加IPTG 诱导的pET28α(+)-α-19转化菌则无此条带(图3),Western blot证实该条带为α-19-His tag重组蛋白(图4)。
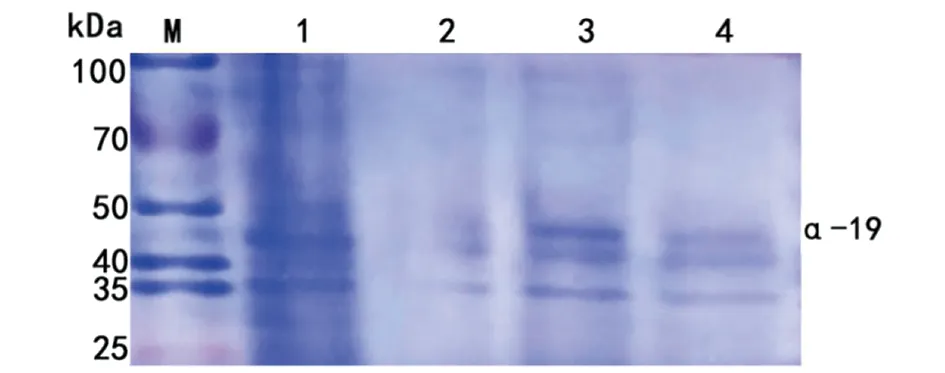
1为未诱导转化菌;2、3、4分别为IPTG为1 mmol/L、0.5 mmol/L、0.1 mmol/L诱导的转化菌;M为蛋白分子量标准
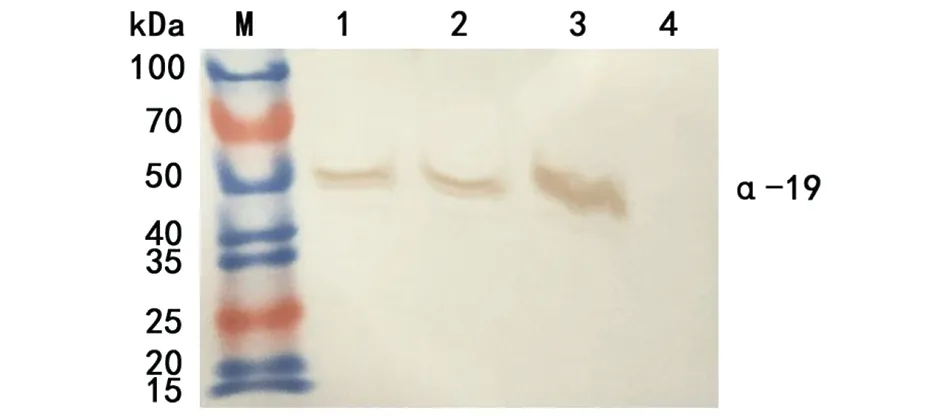
1、2、3分别为IPTG为1 mmol/L、0.5 mmol/L、0.1 mmol/L诱导的转化菌;4为未诱导转化菌;M为蛋白分子量标准
2.3α-19贾第素mAb的制备 采用多种生物信息学软件和网站对α-19贾第素蛋白序列进行分析,最终选定一段18aa的短肽(364-381aa)作为抗原肽,序列为IDRPKDPAAGPEAENGPA。将该段合成抗原肽与KLH偶联后,免疫BALB/c小鼠,4 次免疫结束后,间接 ELISA 法检测小鼠血清抗体效价最高达1∶64 000,满足细胞融合条件。细胞融合后经多轮亚克隆筛选获得3株产生抗体效价比较高的单克隆细胞株α-19-3-7-3-5、α-19-3-14-3-2、α-19-3-17-1-1。将3株杂交瘤细胞分布接种小鼠腹腔获得腹水,亲和层析纯化获得3种单克隆抗体用于下一步结合力和特异性验证实验。
2.4α-19 mAb结合性和特异性鉴定 采用原核表达的α-19贾第素蛋白验证mAb的结合能力,贾第虫滋养体全裂解物验证α-19 mAb的特异性。结合性实验结果显示3-7-3-5、3-14-3-2、3-17-1-1杂交瘤产生的抗体均能和α-19贾第素重组蛋白结合;特异性实验显示3-7-3-5杂交瘤产生的抗体特异性良好,与贾第虫滋养体裂解物反应仅出现α-19贾第素单一条带,3-14-3-2杂交瘤产生的抗体出现非特异条带,3-17-1-1杂交瘤产生的抗体未能与贾第虫裂解物中的天然α-19贾第素蛋白发生反应(如图5、图6),故选择3-7-3-5用于定位研究。

M为蛋白分子量标准; 1、2为3-14-3-2及其对照组;3、4为3-7-3-5及其对照组;5、6为3-17-1-1及其对照组;1、3、5为0.5 mmol/L IPTG诱导5h的转化菌;2、4、6为未经诱导的转化菌

M为蛋白分子量标准; 1、2、3为贾第虫滋养体裂解物;1为α-19-3-7-3-5;2为α-19-3-14-3-2;3为α-19-3-17-1-1
2.5α-19贾第素在贾第虫滋养体的亚细胞定位 贾第虫滋养体爬片用α-19mAb 3-7-3-5的一抗和Alexa Fluor 488标记山羊抗鼠的二抗处理后,在共聚焦显微镜下观察贾第素α-19贾第素的分布。结果显示,绿色荧光集中分布于滋养体的一对腹鞭毛上(图7)。

1为绿色荧光显示α-19贾第素定位;2为DAPI染色;3为2和3叠加;4为光镜下视野;5为荧光与光镜叠加
3 讨 论
本研究首先对α-19贾第素进行了原核表达,但表达出来的重组α-19贾第素蛋白并未直接用作免疫原去制备单克隆抗体,而是用于α-19 mAb体外结合能力的验证。为了保证产生的抗体能够用于免疫荧光实验,我们通过多种生物信息学网站和软件对α-19贾第素蛋白的天然抗原决定簇部位以及空间构象进行分析,选出了几段备选肽段。但α贾第素家族成员之间具有很高的同源性,为了避免交叉反应,我们又将备选肽段在各贾第素家族成员间进行序列比对,最后确定出了这个最理想的抗原肽用于mAb的制备。相对于多克隆抗体,单克隆抗体在诸多方面有着明显的优势,其特异性高、不易产生交叉反应或假阳性反应,背景染色较浅,制备成功后可获得恒定的再生源,是进行定位研究的首选,但其制作过程繁琐、制备技术要求高、稳定性差、成本高、周期长也增加了单克隆制备的难度。本实验主要应用免疫荧光技术进行亚细胞定位,所需抗体特异度较高,抗体用量较多,要求定位结果的一致性和标准化,而单克隆抗体正是最优的选择[19-22]。
贾第虫的骨架蛋白中的α-贾第素家族是一类含有酸性磷脂的钙依赖性膜结合蛋白,共有21个成员,其在蛋白表达水平、亚细胞定位以及生物学功能上有很大差异[23-24],某些α贾第素如α-4、α-8、α-11等因表达过量可以影响细胞的分裂增殖分化而导致细胞死亡[25-26],说明α贾第素家族成员都具有至关重要的生物学功能,但是各种成员间的功能又不完全相同,明确每一种贾第素的具体功能将是一个非常有有趣的工作,对于全面理解膜联蛋白成员的功能具有重要意义。随着α-19贾第素定位的确立,α-贾第素家族21种贾第素定位基本被阐述清楚,其中腹鞭毛定位的贾第素种类最多,包括α-5、α-9、α-10、α-17以及我们鉴定的α-19贾第素[27]。鞭毛是贾第虫滋养体最重要的运动器官,参与虫体的吸附和脱离小肠粘膜表面的过程,甚至还被证明参与虫体的摄食[28]。为何如此众多的α贾第素成员定位于腹鞭毛,而其它鞭毛定位的α贾第素成员相对较少?这些定位相同的贾第素在功能上有何差异?目前这些问题的答案均无相关报道,有待于进一步研究。
在本研究中,我们成功制备了针对α-19贾第素的特异性单克隆抗体,并利用免疫荧光技术证实α-19贾第素定位于一对腹鞭毛,这些结果为该贾第素的功能研究提供了必要的实验材料和支持。
利益冲突:无
