人工诱变利福平抗性布鲁氏菌转录组测序分析
2020-12-07杨晓雯赵鸿雁朴东日田国忠
杨晓雯,赵鸿雁,朴东日,田国忠,姜 海
布鲁氏菌(Brucella)是一种兼性胞内寄生菌,易造成宿主持续性感染,引起全球性人兽共患流行性疾病—布鲁氏菌病。该病主要表现为发热、多汗、乏力、关节疼痛等症状,严重者丧失劳动能力,影响公共卫生安全以及经济发展[1]。基于生化鉴定和宿主偏好性,国际上将布鲁氏菌分为12个种[2-6]。人感染布鲁氏菌若诊疗不及时,容易引起各种并发症,如脊柱炎、心内膜炎、脑炎等[7]。全球人间布鲁氏菌病发病率年平均超过50万例,一些流行国家每百万人口的布鲁氏菌发病率超过100[8],但据世界卫生组织(WHO)调查表明,实际发病率是报告的10~25倍[9]。2019年我国人间布鲁氏菌病发病数为45 406例,较2018年略有下降(39 296例)。我国过去流行的主要种型是羊种布鲁氏菌1型和3型[10],近几年主要分离株为羊种3型[11]。
临床治疗布鲁氏菌病常用利福平、链霉素等[12],氟喹诺酮类和大环内酯类药物可以作为替代药物[13]。1989年,世界卫生组织推荐的布鲁氏菌病治疗方案为强力霉素—利福平联合用药6周,或者强力霉素服用6周,结合链霉素联合用药2~3周[14],目前该方案仍在使用。目前,土耳其[15]、埃及[16]等国家和地区[17-22]已经出现利福平抗性布鲁氏菌,我国近年来也有相关利福平抗性分离株的报道[23]。利福平抗性基因rpoB突变后能够产生抗性菌株。布鲁氏菌基因组中是否有其他基因参与利福平代谢尚无报道。本研究选择羊种3型代表菌株,利用人工诱变技术获得利福平抗性菌株,通过转录组测序筛选利福平代谢相关基因,预测利福平代谢的主要代谢途径。旨在为布鲁氏菌耐药相关基因的筛选提供新思路,为布鲁氏菌耐药菌株的防控提供基础性数据。
1 材料与方法
1.1布鲁氏菌菌株和基因组 羊种布鲁氏菌3型标准菌株于中国疾病预防控制中心传染病所BSL-3实验室内传代培养,其基因组序列及其氨基酸序列于NCBI Refseq数据库中下载(https://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/000/740/355/GCF_000740355.1_ASM74035v1/),rpoB基因序列参考NCBI Gene数据库中Gene ID: 29593532序列。
1.2MIC值检测 划线培养羊种布鲁氏菌1型和3型菌株,取3~5个单菌落利用生理盐水调整布鲁氏菌比浊度为0.5个麦氏单位,利用96孔凝集板倍比稀释利福平至0.125~256 μg/mL,加入100 μL稀释的待检菌液(布鲁氏菌量为1×105CFU/孔),37 ℃培养48 h,质控菌株为肺炎链球菌 ATCC 49619(参考CISL_M45(2016)),同时设置阴性、阳性对照。
1.3利福平抗性菌株诱导 配置含利福平0.125~256 μg/mL的布氏琼脂培养基,划线培养布鲁氏菌后,取单菌落接种于含0.125 μg/mL利福平的布氏琼脂培养基中,待其长出单菌落后于相同浓度利福平培养基中传代培养,多次传代,待其抗性表型稳定后再接种于高利福平浓度的培养基中,同时利用未添加利福平的布氏琼脂培养基做对照,检测单菌落生长速度。
1.4纸片法药敏检测 划线培养羊种3型布鲁氏菌菌株,取3~5个单菌落利用生理盐水调整布鲁氏菌比浊度为0.5个麦氏单位,取调整后布鲁氏菌菌液100 μL溶解于含0.7%琼脂的半固体布氏琼脂培养基,使菌液均匀分布于整个培养基中,选择利福平药敏片(OXID)贴于培养基表面,37 ℃培养48 h,检测抑菌圈大小。
1.5RNA提取及转录组测序 培养至对数生长期早期的菌株中加入2倍体积RNAprotect Bacteria Reagent (Qiagen),混匀后室温孵育5 min,5 000 ×g离心10 min收集沉淀,Trizol法抽提细菌总RNA;利用DNA酶消化提取的样品总RNA,利用NanoDrop检测总RNA OD260/280(≥1.8)和OD260/230(≥1.8)、Algilent 2100检测总RNA浓度(≥40 ng/μL)、23S/16S(≥1.0)、RIN值(≥7.0),检测合格后送交华大基因有限公司测序。每个样品重复3次后混合。检测合格的样品利用磁珠法去除样品中的rRNA后,然后进行片段化处理。随后合成双链cDNA并进行末端修复、加A尾并连接测序接头,将构建好的测序文库使用HiSeq测序。
1.6转录组测序分析 将获得的原始数据过滤掉低质量、接头污染以及未知碱基N含量过高的reads,得到可用数据。使用Bowtie2[24]软件将可用数据比对到参考基因,之后再使用RSEM[25]软件包计算基因的表达水平,筛选差异表达基因,并对差异表达基因做深入的聚类分析和功能富集分析等。
1.7RpoB基因突变检测 针对rpoB基因全长序列和高变位点利用primer 5设计引物进行PCR扩增,扩增体系为50 μL,扩增条件为95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min(高变位点)/4 min(全长),30个循环;72 ℃ 10 min。扩增产物跑胶检测大小无误后送样测序。
1.8数据统计 利用excel2016对数据进行初步统计,利用R3.4.3程序绘制热图、venn图等,利用R或者SPSS23.0对数据进行单因素方差分析(ANOVA),P<0.05差异有统计学意义。
2 结 果
2.1人工诱导获得利福平抗性菌株 利用稀释法检测羊种布鲁氏菌3型标准菌株利福平MIC值,结果为0.5 μg/mL,表明该菌株没有利福平抗性。经多次传代诱导,最终获得了能够在256 μg/mL利福平布氏琼脂培养基上生长的布鲁氏菌菌株(图1)。该菌株利福平抗性表型稳定,与标准菌株相比,在布氏琼脂培养基上生长状态及速度差异不明显。扩增rpoB基因高变区测序结果表明,rpoB基因1606位点由C变为T,基因全长测序表明,除1 606位点外,rpoB基因其余位点未出现变异。以上结果表明,通过不同浓度的利福平人工诱变,能够获得抗性表型稳定的布鲁氏菌变异菌株。
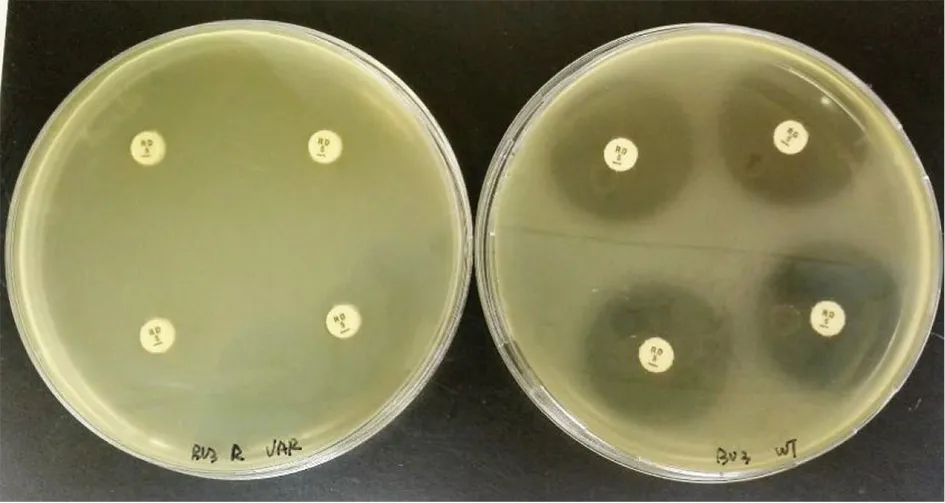
(左)人工诱变布鲁氏菌利福平抗性菌株和(右)布鲁氏菌标准菌株
2.2转录组测序分析 本研究利用转录组测序分析标准菌株和利福平抗性菌株全基因组水平的基因表达量变化。原始测序数据经过滤后获得对照菌株(BM3T)6 845 213条reads,抗性菌株(BM3256)7 324 536条reads,覆盖基因组分别为98.64%和98.38%。检测基因的表达量可知,与标准菌株相比,利福平抗性菌株中121个基因表达量上调,197个基因表达量下调(图2)。
图2 利福平抗性菌株差异表达基因聚类热图
2.3差异基因功能分析 将差异表达的基因进行GO(gene ontology)和KEGG功能聚类分析。121个表达量上调的基因中,85个能够比对到GO数据库中,分子功能占84.7%,细胞成分占47.1%,生物过程占57.6%。分子功能中主要集中于催化活性和结合功能;细胞成分中主要集中于膜、膜成分和细胞;生物过程主要集中于代谢过程和细胞过程。197个表达量上调的基因中,144个能够比对到GO数据库中,分子功能占76.4%,细胞成分占51.4%,生物过程占57.6%。GO功能分类基本与上调基因功能类似,但部分功能如细胞器、细胞器组分、结构分子活性未在表达量上调的基因中发现(图3)。
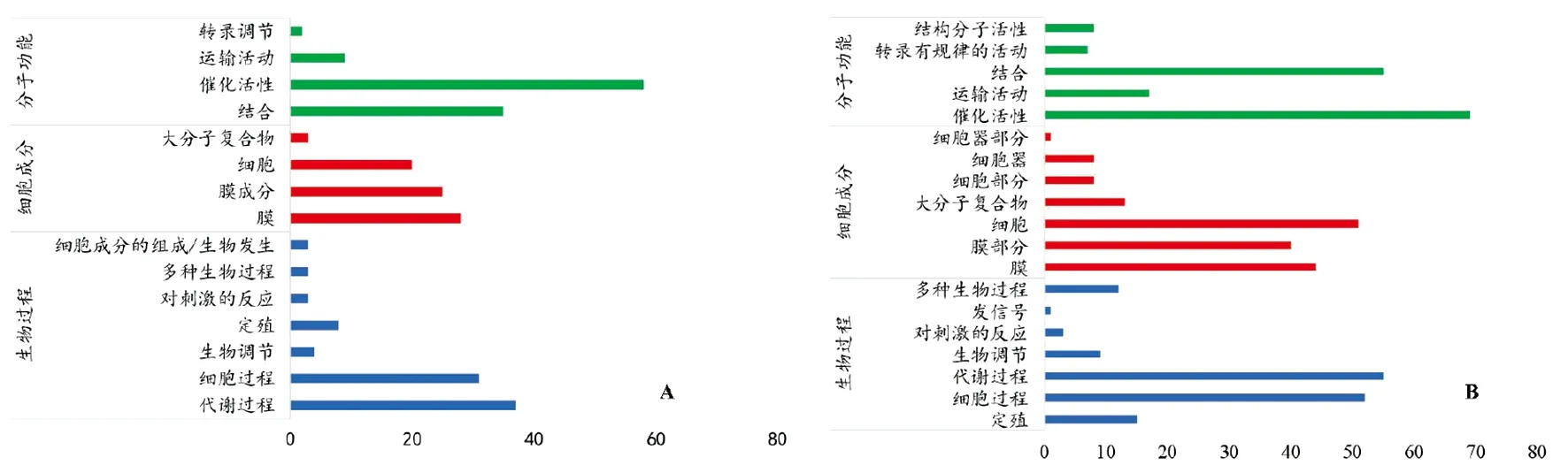
注:A为表达量上调基因的GO功能分析,B为表达量下调基因的GO功能分析。
KEGG功能聚类分析中,表达量上调的基因参与的KEGG代谢通路主要集中于不同环境中的微生物代谢、碳代谢和抗生素的生物合成;表达量下调的基因参与的KEGG代谢通路则主要集中于细菌分泌系统、磷酸肌醇代谢和ABC 转运(图4)。

注:A为表达量上调基因的KEGG功能分析,B为表达量下调基因的KEGG功能分析。
参与催化活性、结合、细胞成分、膜和细胞成分、代谢过程和细胞过程的基因在利福平存在的条件下差异表达,这些基因参与碳代谢、抗生素的生物合成、细菌分泌系统、磷酸肌醇代谢和ABC 转运蛋白等代谢通路。以上结果表明,布鲁氏菌通过多种代谢途径来代谢/抵御利福平的作用。
2.4差异基因相关性分析 将差异表达基因比对至STRING数据库,利用与已知蛋白的同源性获得基因间的互作关系。结果发现,表达量下调的基因中,存在互作相关蛋白,经同源筛选发现11个互作基因,属于virB操纵子,编码IV型分泌系统(图5)。
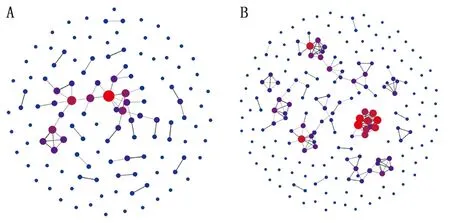
注:A为表达量上调基因的互作关系图,B为表达量下调基因的互作关系图。
3 讨 论
利福平属于利福霉素抗生素组,通过阻断细菌RNA和蛋白质合成引发其杀菌作用,布鲁氏菌利福平抗性相关基因rpoB基因编码DNA依赖性的RNA聚合酶β亚基,该基因突变后导致菌株对利福平的亲和力降低[26]。对羊种和牛种布鲁氏菌的研究表明,rpoB基因存在影响利福平抗性水平的高变位点(1 560-1 740位点)[27]。本研究的结果与前人研究结果[27]类似,人工诱变的利福平抗性布鲁氏菌rpoB基因1 606位点出现单核苷酸突变。由于针对布鲁氏菌的研究需要生物安全三级实验室(Biosafety Level-3,BSL-3),因此,常规的耐药研究很少涉及布鲁氏菌。目前的研究表明,布鲁氏菌耐利福平与rpoB基因突变相关[27],其他基因的表达量变化是否影响布鲁氏菌利福平抗性表型尚无报道。本研究通过转录组测序发现,virB操纵子等基因与利福平抗性相关。
IV型分泌系统是多蛋白复合物,存在于许多革兰氏阴性菌中,如根瘤菌、幽门螺旋杆菌、嗜肺军团菌和布鲁氏菌等[28]。IV型分泌系统允许底物通过细胞膜,将分泌性蛋白释放到宿主细胞中,同时,在接合、DNA摄取和释放等方面也发挥重要作用,是布鲁氏菌重要的毒力因子,是由virB操纵子编码[29]。本研究中转录组测序结果表明,virB操纵子在利福平抗性菌株中表达量下调。virB操纵子包括12个基因,即virB1-12,与细菌在细胞内复制和形成持续性感染有关[30]。布鲁氏菌侵入宿主细胞后,形成含有布鲁氏菌液泡(Brucella-containing vacuole,BCV),BCV与溶酶体融合,大约90%的BCV被吞噬溶酶体降解,剩余10%的BCV可能通过酸化机制逃避宿主免疫机制,随后触发virB操纵子释放大量分泌性蛋白进入宿主细胞质中[31]。virB操纵子中不同的基因功能不同,virB1可能影响着其它virB蛋白,virB6、virB7和virB10蛋白是细菌跨膜蛋白的传送信号,VirB4和VirB11蛋白与VirD4蛋白偶联使ATP酶从表面跨膜进入细胞质,virB2和virB5蛋白可能是细菌表面菌毛结构蛋白,virB8在IV型分泌系统中起主要作用, 主要是与virB9和virB10在细胞膜上形成群体[32],virB3和virB12功能尚不明确,推测可能与复合体的装配有关[33]。IV型分泌系统是布鲁氏菌毒力的重要组成部分,对于布鲁氏菌的胞内寄生和逃逸宿主免疫具有重要的作用。当前对于IV型分泌系统的组成及编码相关基因的功能研究较为明确。本研究中发现,利福平抗性菌株中virB操纵子的表达量降低,推测布鲁氏菌virB操纵子与利福平抗性相关,通过降低virB操纵子基因的表达来抵御利福平的作用。
综上,本研究通过不同浓度的利福平人工诱变,能够获得抗性表型稳定的布鲁氏菌变异菌株。同时,利用转录组测序方法发现利福平抗性菌株中121个基因表达量上调,197个基因表达量下调,差异基因功能主要集中于催化活性、结合、细胞成分、膜和细胞成分、代谢过程和细胞过程;主要参与碳代谢、抗生素的生物合成、细菌分泌系统、磷酸肌醇代谢和ABC转运蛋白等代谢通路。包括virB操纵子在内的涉及碳代谢等代谢通路的基因,通过表达量的改变参与抵抗利福平的作用。本研究通过人工诱变菌株的全转录组检测为布鲁氏菌耐药相关基因的筛选提供新思路,筛选出的差异表达基因作为布鲁氏菌利福平抗性候选基因,为布鲁氏菌利福平抗性的研究奠定了基础,同时为布鲁氏菌耐药菌株的防控提供基础性数据。
利益冲突:无
