人源性肿瘤组织异种移植模型的建立及应用
2020-12-07尹振宇刘乾李晓梅齐文博刘乐白玉萍马延龄陈昊
尹振宇 ,刘乾,李晓梅,齐文博,刘乐,白玉萍,马延龄,陈昊
0 引言
肿瘤是严重影响人类健康的一类疾病。据统计,2018年有1810万例肿瘤新发病例和960万例肿瘤死亡病例[1]。随着人口数量及年龄的增长和生活方式的改变,肿瘤的发病和死亡人数预计会进一步增长[2]。因此医学研究者亟需对肿瘤的治疗方式进行更深入的研究。由于伦理和道德原因,在人体内进行的肿瘤学研究仅限于分析和观察性研究,而以治疗为重点的临床试验在人体内进行是受限的,因此临床前小鼠肿瘤模型作为不可或缺的中间实验模型体系,承担起将体外研究与人体研究有效结合起来的任务[3]。
传统的肿瘤异种移植模型是指细胞系来源的肿瘤异种移植(cell line-derived tumor xenografts,CDTX)模型,是将体外培养的肿瘤细胞系注射到免疫缺陷小鼠体内而形成的一种动物模型。单一肿瘤细胞株经过体外反复传代,适应了外界培养环境[4],此外,由于缺乏肿瘤相关基质和血供等原因,体外细胞系的微环境与原发性肿瘤完全不同。不能预测由细胞系产生的遗传变异和肿瘤异质性,不能准确判断药物在临床试验中的作用,从动物荷瘤模型到临床肿瘤患者的试验进行转化的平均成功率低于8%[5],原因可能是该模型无法忠实地反映在人类中的致癌过程。体外培养的高度间变性癌细胞代表了高度晚期癌症的极端衍生物,与原发性肿瘤基质无关,而原发性肿瘤基质被认为是肿瘤转移的关键因素[6],且人类和小鼠之间关键的基因、分子、免疫和细胞差异阻碍了该模型成为癌症个体化治疗的有效手段[7-8]。
为了克服这些局限性,医学研究者们迫切需要更加精准、有效预测评估药物疗效的方法,而PDTX模型可以部分解决上述问题。
1 PDTX模型的特点
1.1 PDTX模型与原代肿瘤相似
PDTX模型最重要的优点是与原代肿瘤相似,目前研究人员已经建成了胃癌、结直肠癌、肝细胞癌、胰腺癌、小细胞肺癌、非小细胞肺癌、乳腺癌、卵巢癌、子宫肉瘤、前列腺癌、肾细胞癌、黑色素瘤等多种肿瘤的PDTX模型[9-10],并且从组织病理学、基因学等多角度分析,证实移植瘤保持了原发肿瘤的病理学、组织学等特性,还原了肿瘤细胞的基质和干细胞特性,反映了患者“体内原发性”肿瘤的遗传多样性。全基因组基因表达分析研究表明,PDTX在原发性肿瘤中维持了大部分关键基因和全局通路的活性。Fichtne等[11]研究表明在非小细胞肺癌(NSCLC)PDTX模型中,全基因组基因表达谱分层聚类显示,17个原发肿瘤中有9个直接与移植的PDTX模型相同,相关系数在0.78~0.95之间。重要的是,17对原发性和PDTX肿瘤中有10对的相关系数大于0.90,表明原发性肿瘤与相应的PDTX模型之间具有高度的相似性。
1.2 PDTX模型能够提供充足的肿瘤样本
PDTX模型较好地弥补了某些肿瘤研究中样本量不足的问题。PDTX模型的建立取材于新鲜的肿瘤组织,较少的样本量即可成功建立PDTX模型,并且第一代模型建成后即可用于下一代模型,迅速放大了样本量,这给难以获取肿瘤组织的肿瘤如胰腺腺泡细胞癌、小细胞肺癌、肠癌肝转移等提供了新的并且有说服力的研究手段。
1.3 小部分PDTX模型与原代肿瘤产生较大差异
PDTX模型与原代肿瘤保持高度的一致性,是转化医学的一次重大突破,然而人鼠毕竟有区别,并且肿瘤的形成是从一个肿瘤细胞开始逐渐发展而来,涉及了众多病因引起多种病理改变,是一个极其复杂的过程。研究中发现少部分PDTX模型与原发肿瘤产生了组织病理学差异。Zhu等[10]用NOD/SCID小鼠建立的63例胃癌的PDTX模型中,原发性肿瘤与异种移植瘤的分化符合率为90.5%(57/63),异种移植瘤不同传代(P1、P2、P3)的分化符合率为98.4%(62/63)。3例原发性肿瘤中分化而异种移植物低分化,1例原发性肿瘤与P2分化差的患者由P2转变为淋巴瘤。Chijiwa等[12]在8例PDTX模型(占全部PDTX模型的7%)中,观察到由大的单一非上皮细胞组成的可移植性异种肿瘤,其形态与原肿瘤不同,导致差异的原因需要进一步探索。Merk等[13]在一组25例原发性非转移性肺癌患者的PDTX最初几代模型中观察到较少的异质性,认为是由于用小鼠基质组织替换了人类辅助细胞所致。Gu等[14]在与患者肿瘤相关的异种移植下调的基因中,观察到丰富的编码细胞外基质成分、细胞黏附分子和免疫系统调节因子的基因,认为异种移植物中的基因表达差异是由于人类基质成分的丢失和小鼠基质细胞的浸润。PDTX模型组织中与细胞周期和DNA复制相关的基因表达上调,可能是致瘤细胞群的富集。
2 PDTX模型的制备
2.1 取材
建立PDTX模型需获取新鲜的肿瘤组织并及时移植入免疫缺陷小鼠,其方式有手术标本取材和活检取材。然而,在很多情况下,研究人员难以获取手术标本,特别是分期较晚、失去手术机会的患者,如晚期胃癌患者,获取肿瘤样本的主要方法是胃镜活检取材,活检取材的少量肿瘤组织即可用做建立PDTX模型。
手术标本取材的方法:首先将青霉素:链霉素按1:100加入培养基199(或RPMI 1640)中,制备培养基工作液[5]。然后将肿瘤转移到足量的含有培养基199(或RPMI 1640)和青霉素/链霉素的无菌培养皿中。最后把肿瘤切成5 mm×5 mm×5 mm大小的组织块。应注意使组织块尽可能均匀,确保所有不能用于移植的坏死组织都被切除。坏死组织在不同的肿瘤类型中有不同的状态,但通常表现为大肿瘤中心的暗色液化物[15]。活检标本取材的方法:从患者的肿瘤组织中取新鲜活检的组织块四个,均为2 mm×2 mm×2 mm[10],应确保活检取得的肿瘤组织可以用于移植。然后将其保存于上述配制好的培养液中。将取得的手术和活检标本置于4℃的环境中等待下一步的移植。标本应在离体后2小时内进行移植[16]。一部分组织用于移植,另一部分组织样本立即快速冷冻并保存在-80℃下进行遗传、基因组和蛋白质分析。
2.2 选择小鼠
裸鼠于1962年出现,无毛,无胸腺,缺乏成熟T细胞,B细胞和NK细胞功能正常。1980年缺乏巨噬细胞、NK细胞及补体活性的NOD小鼠出现,但人的肿瘤细胞无法移植到NOD小鼠体内[17]。1983年SCID小鼠的出现为人肿瘤细胞的植入提供了条件。该小鼠因其Prkdc基因功能缺失突变,使得体内T细胞、B细胞表面受体失活[18]。1995年NOD/SCID小鼠诞生,因其DC、T、B、NK、巨噬细胞及补体功能缺失,人细胞及组织的移植成功率较前增高,这在小鼠模型史上具有里程碑式的意义[19-20]。随后,1996年出现了第1只IL-2Rγ突变小鼠,特异性抑制了NK、T、B细胞活性,同时降低了淋巴瘤的转化率[20-21]。2002年日本选育的NOG小鼠及2005年Jackson实验室选育的NSG小鼠[22-24],其胸腺淋巴瘤转化率低,无淋巴细胞残留,具有固有免疫及适应性免疫的双重免疫缺陷,且具有较长的寿命及较高的移植成功率。2015年我国自主研发了NCG小鼠,与NOG、NSG小鼠具有相似的特性,且NCG小鼠具有更高的产子率等优势。目前,NOG、NSG及NCG小鼠成瘤率较高。
2.3 移植
取到离体手术或内镜活检的胃癌组织标本后,需在2 h内将胃癌组织种植到免疫缺陷小鼠体内。具体步骤如下:
2.3.1 皮下移植 部分肿瘤手术标本组织块切成2 mm×2 mm×3 mm薄片,活检组织块切成2 mm×2 mm×2 mm薄片,用上述培养液洗涤3次。在异氟醚麻醉下,从5~6周龄雌性免疫缺陷小鼠背部下方或腹股沟两侧各做一个小切口和皮下袋,在每个切口内放置一个肿瘤块[15];将一滴1:100青霉素:链霉素溶液滴入手术切口中。移植完成后缝合肌层和皮肤。通过游标卡尺测量肿瘤长度(a)和宽度(b),每周至少监测两次已建立的异种移植肿瘤的生长。肿瘤体积计算为(a×b2)/2。
2.3.2 肾筋膜下移植 将一部分手术标本和活检组织块切成1 mm×3 mm×3 mm的薄片。在无菌条件下,沿着已麻醉的NOD/SCID小鼠背部皮肤中线切开约2 cm的切口。用食指和拇指对肾脏的一侧施压,将肾脏从体腔中滑出。外周肾靠在体壁上,用5#细镊子轻轻地将肾包膜从肾实质上夹起,用细弹簧剪刀在肾包膜处切开2~4 mm的切口。然后通过钝性剥离在肾脏和肾包膜之间形成一个口袋(注意不要损伤肾实质,以免出血)。移植物用钝端钳转移到肾表面。用一把细镊子提起肾包膜的切缘,用抛光玻璃吸管将移植物插入包膜下的口袋。在肾包膜下可以放置两到三个移植物,而对小鼠没有明显的不良影响。移植手术完成后,轻轻地将肾脏放回体腔,缝合体壁和皮肤[16]。我们团队尝试腹部入路的方法,见图1,切开小鼠腹部皮肤和肌肉,暴露一侧肾脏,用显微镊子仔细分离小鼠肾筋膜,形成一个口袋,将切片的肿瘤组织放入其中,将肾脏恢复到原来的位置,缝合肌肉和皮肤。
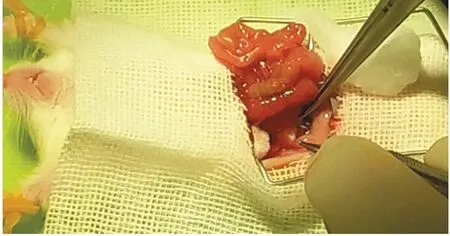
图1 肿瘤组织筋膜下移植:腹部入路将肿瘤组织移植到肾筋膜下Figure 1 Renal capsule transplantation of tumor tissue:opening the abdomen and implanting the tumor tissue into renal capsule
2.3.3 原位移植 Hiroshima等[25]首次建立了软组织肉瘤的原位移植模型。肿瘤组织是从一个腹膜后软组织肉瘤患者的活检中获得的,切片(3 mm3)移植至裸鼠左肾后腹膜。通过皮肤和肌肉在裸鼠左侧腰椎区域做一个6~10 mm的小切口。裸鼠左肾后腹膜后脂肪,与患者体内原肿瘤生长的位置相对应,通过这个切口分离出间隙。将肿瘤薄片植入该间隙,使用8-0尼龙外科缝线缝合。完成后,切口用6-0尼龙外科缝线封闭。同样大小的肿瘤块也用标准技术移植到裸鼠皮下。田树红等[26]采用包埋法进行胃癌原位移植,操作步骤如下:用1 ml一次性无菌注射器往动物胃浆膜层轻轻注入0.1 ml 0.9%(g/ml)氯化钠注射液,使浆膜层形成一个小皮丘,然后用小镊子轻轻捏住皮丘一侧边缘,用眼科剪剪一个约3 mm长的小口,再用小镊子将肿瘤块送入皮丘内即可。这样肿瘤组织不会与其他组织粘连,对胃的损伤也较小。最后逐层缝合好腹腔,安尔碘消毒创口,小心饲养。
2.3.4 肌内移植 Read等[27]采用基质凝胶包被的肿瘤组织切片,分别在免疫功能低下的小鼠侧腹皮下或背部肌肉内进行移植。新鲜和冷冻保存的活检肿瘤组织均成功地建立了食管和肛管癌的PDTX模型,见图2。与皮下植入相比,肌内移植的植入率更高,肌内移植和皮下移植的手术组织标本成瘤率分别为95%和25%,活检组织成瘤率分别为48%和7%。此外,肌内肿瘤比皮下PDTX肿瘤生长更快。肿瘤分化状态、蛋白表达、突变谱和对化疗的反应与原发肿瘤一致。
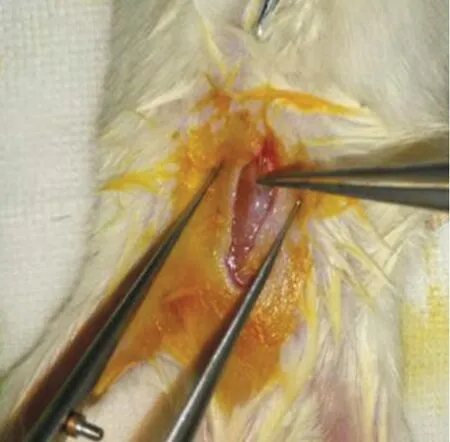
图2 肿瘤组织的肌内移植:将肿瘤组织植入小鼠背部肌肉Figure 2 Intramuscular transplantation of tumor tissue:implanting tumor tissue into the dorsal muscles of mice
2.4 活体动物内光学成像技术在胃癌小鼠模型中的应用
活体成像技术是指用非侵入性手段对活体状态下的生物进行组织、细胞和分子水平的定性和定量研究;目前,动物活体成像技术主要分为光学成像(optical imaging)、核素成像(PETSPECT)、核磁共振成像(MRI)、计算机断层扫描(CT)成像和超声(ultrasound)成像五大类。其中活体动物内光学成像[28-29]主要包括生物发光(bi-oluminescence,BLI)和荧光(fluorescence)两种技术。这两种光学成像技术主要用于细胞系肿瘤异种移植模型中肿瘤是否移植成功和大小的检测。而对于PDTX模型中判断是否移植成功和大小的检测,目前用MRI来判断。与人体相似,移植成功的肿瘤组织在MRI平扫中表现为明显的异常信号影,通过检测肿瘤的大小,从而判断是否可传代。我们团队获得手术胃癌标本后对NOD/SCID小鼠行肾筋膜下移植术,8天后MRI可见肾筋膜下肿瘤组织生长,见图3,表明移植成功。术后16天MRI示肾筋膜下肿瘤较前增大,见图4。

图4 术后16天MRI增强结果:右肾筋膜下肿瘤较前增大(箭头处为肿瘤组织)Figure 4 An 16-day postoperative MRI enhancement:the right renal subfascial tumor was larger than before (arrow:tumor tissue)
2.5 肿瘤组织传代
当肿瘤生长到大小约为750 mm3时可以进行传代移植[10]。荷瘤小鼠用乙醚麻醉,颈椎脱臼处死。小鼠冰水浴2 min,然后置于75%乙醇中 2 min,在无菌环境中进行解剖。在无菌条件下切碎肿瘤,组织块大小3 mm×3 mm×3 mm[9]。然后移植到免疫缺陷小鼠体内,如上所述。移植后肿瘤传代不超过10次。
2.6 低温保存与复苏
早期传代的大量样品应保存在组织库中,在液氮中冷冻保存并用于进一步实验。将新鲜制备的异种移植瘤组织的一半浸入莱博维茨-L-15培养基中,添加10%胎牛血清和10%二甲基亚砜(DMSO)。在-80℃下过夜后,将冷冻瓶转移到液氮中。
再次移植到裸鼠体内时,肿瘤组织在37℃下迅速解冻,用含上述补充物青霉素:链霉素为1:100的RPMI 1640培养基清洗,并如上文所述进行皮下移植。Zhang等[30]用非小细胞肺癌的冷冻活检组织植入到SCID小鼠中,实现了与新鲜肿瘤组织相近的成功率(32%)。Anderson等[31]则进一步证明,利用冷冻保存后的小细胞肺癌活检组织建立的PDTX模型与原发肿瘤具有高度一致的组织学特征。
3 PDTX模型成功建立的关键因素
肿瘤离体时间和种植时间是影响成功率的最重要因素,肿瘤应在离体后2 h内进行移植。Chijiwa等[12]认为术后2天或2天以上移植到NOG小鼠体内的肿瘤的成瘤率(61%)高于手术当天或术后第2天移植的肿瘤成瘤率(51%),但差异无统计学意义。
移植的部位及原发肿瘤的类型也是影响成瘤率的重要因素,见表1~2。恶性程度高、分化程度低的肿瘤移植成功率较高。Okada等[39]认为,肾筋膜下和原位移植的成瘤率高于皮下移植。Chijiwa研究[12]表明呼吸系统肿瘤(67%)、胃肠道肿瘤(58%)和泌尿系肿瘤(57%)的成瘤率较高。转移性肿瘤比原发性肿瘤成瘤率高,分别为65%和27%,化疗前获取的肿瘤组织成功率优于化疗后。Zhu等[10]的研究表明,化疗前活检组织的移植率(52.1%)高于化疗后活检组织的移植率(21.9%)。
4 PDTX模型的临床应用
4.1 用于指导临床个体化治疗
肿瘤的临床治疗过程中,存在患者的个体化差异,但治疗方案往往是常规的[17],造成了治疗时间和费用上的浪费。PDTX模型临床前实验取得的结果往往与临床实际高度吻合,有助于寻找适合患者的个体化治疗方案。美国霍普金斯大学的一项研究[40]成功建立了14例晚期难治性肿瘤的PDTX模型,用涉及63种药物的232种方案进行测试,其中12例患者通过PDTX模型找到了有效的治疗方案,1例在接受治疗前死亡,另外11例患者无论是在耐药性还是敏感度方面,通过PDTX模型推测的预期与真实临床结果之间显著一致。Villarroel等[41]报道了1例老年男性胰腺癌患者,手术后2月,在开始辅助治疗之前,发现有经活检证实的锁骨上淋巴结转移,CA19-9为10132 u/ml。患者接受单药吉西他滨治疗,但4月后出现明显的疾病进展,CA19-9为98405 u/ml。在此期间取患者肿瘤组织建立PDTX模型,根据PDTX模型对丝裂霉素C的反应,患者接受丝裂霉素C治疗后,CT扫描结果示肿瘤转移性病灶减小,CA19-9水平正常化。由于异种移植物对顺铂也表现出敏感,于是患者接受了3周期的顺铂治疗。在最后一次随访中,即手术切除3年后,患者CA19-9为39 u/ml,无其他临床症状。这是采用PDTX模型成功获得肿瘤个体化治疗方案的典型案例。对于个体化化疗,需要临床相关的NSCLC模型来快速预测最有效的治疗方案。Dong等[36]建立了NSCLC的第一代肾筋膜下异种移植,以确定对常规化疗方案的反应,并选择对个别患者最有效的治疗方案。结果表明在保留原癌主要生物学特性的基础上,建立了所有NSCLC的异种移植模型(成瘤率为90%)。整个药物评估过程耗时8周。方案A、B和C(A:顺铂+长春瑞滨,方案B:顺铂+多西紫杉醇,方案C:顺铂+吉西他滨)的有效率分别为28%、42%和44%。从而得出结论,PDTX模型适用于快速评估(6~8周)患者癌症的化疗敏感度和选择最有效的治疗方案,有望应用于非小细胞肺癌患者的个体化治疗。
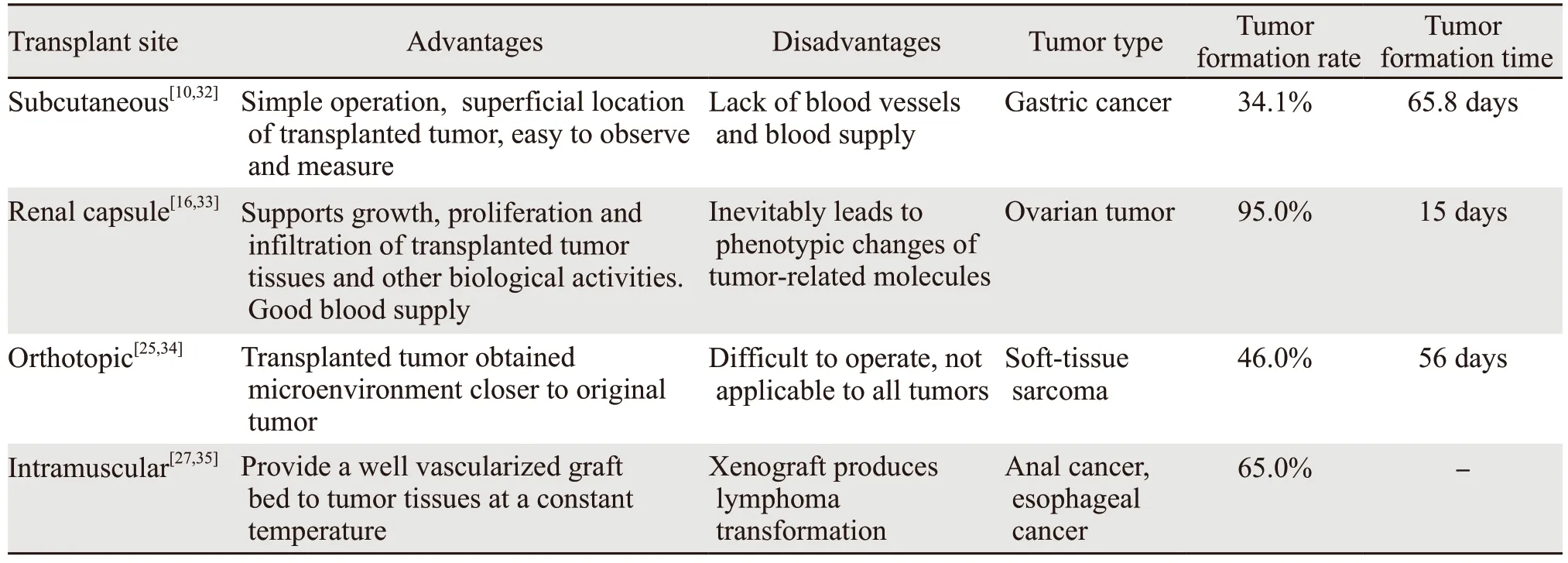
表1 不同的移植部位PDTX建模特征比较Table 1 Characteristics of PDTX models among different transplant sites
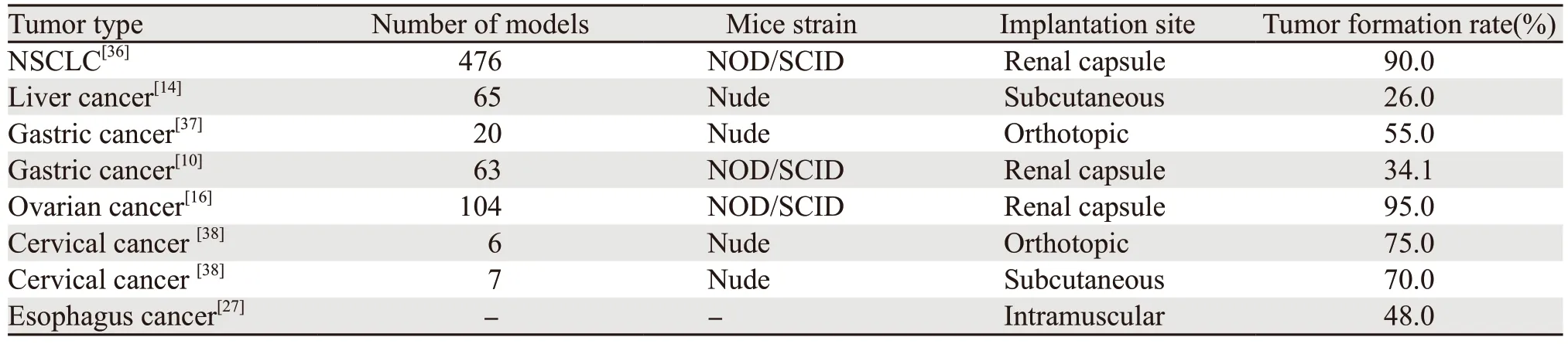
表2 多种肿瘤类型在不同移植部位和不同小鼠品系中PDTX移植成功率Table 2 Success rate of PDTX for various types of cancers grafted on different sites and mice strains
4.2 用于药效评估和生物标志物的研究
评价药物的抗癌活性时,以动物体内实验结果为主,同时参考体外实验结果。传统的动物体内实验是将相应的细胞系移植到小鼠体内建立模型,由于细胞系无法与原发肿瘤保持一致性,因此所得出的剂量范围、药物疗效将与患者有较大出入。PDTX模型则避免了这一缺陷,使得药物抗癌活性的评价更具有可靠性。PDTX模型对体内抗肿瘤耐药活性实验和抗肿瘤转移药物实验也同样具有重要的作用。Bertotti等[42]成功建立了85例转移性结直肠癌PDTX模型,研究发现HER2扩增在抗西妥昔单抗、KRAS/NRAS/BRAF/PIK3CA野生型病例中特异性存在。并且HER2和EGFR抑制剂(西妥昔单抗)联合使用具有显著的抗肿瘤作用,这意味着对昔妥西单抗耐药的转移性结直肠癌患者及K-Ras野生型伴随HER2扩增且临床治疗无效的患者或可通过HER2抑制剂与EGFR抑制剂联合使用获益。Kim等[43]评价了新中药配方BP10A的抗肿瘤作用及其对抗癌药物奥沙利铂和伊立替康(CPT-11)在结肠癌异种移植模型中的作用。在所有PDTX模型中,口服BP10A可使肿瘤生长延迟34%~70%。同样,腹腔注射奥沙利铂或CPT-11也分别抑制肿瘤生长31.8%~60.5%或24.3%~50.4%。此外,BP10A与奥沙利铂或CPT-11联合治疗可显著提高各抗癌药物的抗肿瘤活性,延缓肿瘤生长,抗肿瘤活性可分别提高47.1%~74.6%和74.4%~82.9%。从抗肿瘤活性来看,BP10A与抗癌药物联合治疗及BP10A、奥沙利铂、CPT-11联合治疗均能降低肿瘤细胞增殖标志物Ki-67和血管生成标志物CD31的表达,显著增加肿瘤细胞凋亡标志物TUNEL染色。因此BP10A对结肠癌有较强的抑制作用,且与抗癌药物具有协同作用,提示BP10A可作为治疗结肠癌的理想药物。Ho等[44]通过研究慢性乙型肝炎病毒(HBV)引起的肝细胞癌(HCCs)中雷帕霉素(mTOR)信号级联靶点的突变情况,探讨mTOR过度激活在肝癌发生中的突变依赖机制。他们发现并证实了多个mTOR组分在HBV相关HCC中反复突变,并且在HCC样本中检测到TSC1和TSC2基因的频繁突变。在肝癌细胞系和PDTX模型中也观察到TSC1和TSC2基因的突变中断。在雷帕霉素作用下,TSC突变细胞的集落形成能力下降。结果提示了HBV相关HCC中的突变依赖性mTOR过度激活和频繁的TSC1/2突变的重要性。Bulle等[45]在吉西他滨诱导人胰腺导管腺癌异种移植瘤上皮间质转化的研究中,建立了两种行为不同的PDTX模型(低分化肿瘤PAC010,中分化肿瘤PAC006)来研究吉西他滨或吖啶(HIF抑制剂)单药对两种PDTX肿瘤模型的疗效作用。基因和蛋白质分析显示,在PAC010模型中,间充质标志物(如VIM、SNAI2)表达较高。吉西他滨治疗导致两种模型肿瘤体积缩小和增殖减少。吉西他滨治疗显著增强了支持转移行为和生存途径间充质标志物的表达,特别是在非侵袭性PAC006模型中。在两种模型中,吖啶对肿瘤生长几乎没有影响。
PDTX模型在预测生物标志物中也起到了重要作用。目前研究发现,PLK1对细胞分裂和维持基因组的稳定性有重要作用,包括有丝分裂、纺锤体组装和DNA损伤反应。Dang等[46]通过分析建立的胃癌PDTX模型,发现BI6727(一种PLK1抑制剂)抑制PLK1活性后,与对照组相比,胃癌PDTX模型中肿瘤体积和重量明显下降。发现PLK1对胃癌细胞的存活有显著影响,它可能成为一个判断预后或预防性的胃癌生物标志物,也可能成为胃癌潜在的治疗靶点。circRNAs是一类新的非编码RNA,近年来已被证实能调节肿瘤的发生和侵袭性。然而,circRNAs在结直肠癌(CRC)转移中的作用尚不清楚。Yang等[47]首先通过qPCR分析评估了circPTK2(hsacirc 0005273)在大肠癌新鲜组织和相应邻近组织中的表达,建立了一个PDTX模型来评估shRNA特异性靶向circPTK2对肿瘤转移的影响,在PDTX模型中,尾静脉注射特异性靶向circPTK2的shRNA可以抑制肿瘤转移。表明circPTK2在大肠癌生长和转移中起着重要作用,可能是大肠癌转移的潜在治疗靶点,也有望成为早期诊断转移的生物标志物。
4.3 用于肿瘤微环境的研究
在临床实践过程中,不同患者对于肿瘤免疫治疗的效果差异较大。越来越多的证据表明,由于肿瘤微环境的异质性造成了不同个体的抗肿瘤免疫应答反应不尽相同[48]。由此可见,肿瘤微环境对于肿瘤免疫药物的评价非常重要。PDTX模型可模拟人体内肿瘤微环境,目前,通过在高度免疫缺陷小鼠体内移植来源于人的骨髓、外周血或胚胎组织的造血干细胞,使小鼠体内表达人类的免疫系统,可获得重建人免疫系统(human immune system,HIS)小鼠模型[49],用于临床前的药效和毒理实验,为免疫毒性的评价提供更多信息。已有研究报道,将体外扩增的人造血干细胞或人干细胞祖细胞,经骨髓腔注射至经过辐照(如60Coγ射线)后的NSG小鼠体内,可建立重建HIS的小鼠模型,之后再将头部及颈部肿瘤患者的肿瘤组织经手术切除后,皮下移植至构建的重建HIS的小鼠侧面体表,以研究人干细胞祖细胞与移植的人源肿瘤之间的相互作用[50]。Gunnarsdóttir等[51]描述了如何将黑色素瘤细胞的单细胞悬液注射到免疫缺陷的NOD-scid IL2R(NSG)小鼠中。另外,他们将肿瘤细胞和免疫细胞联合注射,使用Winn试验研究癌症免疫治疗的可能性。Sun等[52]在研究无创液态饮食法向小鼠深部代谢网络示踪模型中输送稳定同位素时,发现肝脏通过血液向PDTX供应葡萄糖来源的Gln,以促进Glu和谷胱甘肽的合成。将PDTX与体外肿瘤培养物进行比较,发现不同的葡萄糖代谢可以反映不同的肿瘤微环境。
5 展望
尽管人源化肿瘤动物模型的建立已经取得了很大的进步,研究者仍面临着很多问题需要解决:(1)模型的保真性仍有缺陷。鉴于肿瘤微环境在肿瘤生物学的许多方面起着重要作用,PDTX肿瘤基质成分从最初的人类转变到荷瘤小鼠,使PDTX肿瘤基质成分发生改变,这可能是这些模型的一个相关缺陷。这一局限性在以微环境为靶点的特异性抗癌药物(如贝伐单抗)的药效评估中表现得尤为明显。(2)人体免疫微环境的缺失。因建模小鼠均无成熟的免疫系统,PDTX模型不能用于免疫抑制剂、免疫调节剂的疗效评估。为了克服人体免疫微环境缺失的问题,可通过重建人的免疫系统来弥补人体免疫微环境的缺失。目前人体免疫微环境的重建也有待完善。如何构建与原代肿瘤相似度更高的模型动物,是需要不断努力解决的问题。(3)平均成瘤时间较长,不利于提供晚期患者精准的治疗方案。对于肿瘤发展迅速、生存期短的患者而言,有些未能获得药敏结果就已经死亡。(4)深部器官成瘤判断手段困难。目前判断深部器官PDTX成瘤的方法有待完善。有望借助MRI、CT、PET-CT等手段来判断,但难以适应大量PDTX模型成瘤情况的判断。
