腹腔镜下头尾侧联合入路治疗右半结肠癌的疗效分析
2020-12-07鲍新民王日玮张开华刘奇盛万焱华廖强明
鲍新民,王日玮,张开华,刘奇盛,万焱华,廖强明
0 引言
结肠癌是最常见的恶性肿瘤之一[1-2],其发病率及死亡率逐年上升[3]。结肠癌的主要治疗方法是手术切除[4]。自从美国外科医生Jacobs首次报道使用腹腔镜结肠切除术治疗结肠癌以来[5],腹腔镜结肠切除术越来越多地被作为结肠癌的治疗方法之一[6],已成为结肠癌的标准外科治疗方法。与开腹结肠切除术相比,许多大型前瞻性研究显示出短期效果显著、术后恢复更快和生活质量明显得到改善等优点[7-9]。目前,腹腔镜下右半结肠癌根治术手术入路没有统一标准,常见的有外侧入路、中间入路、尾侧入路法及联合入路等,循肠系膜上静脉自尾侧向头侧游离的中间入路是目前主流的手术路径[10]。结合当前腹腔镜右半结肠癌切除的各种手术入路,提出了头尾侧联合入路并进行了实践探讨,现报道如下。
1 资料与方法
1.1 一般资料
搜集我院2019年1月—10月收治的60例右半结肠癌患者的临床资料。按照不同的手术方式分为两组:观察组30例采用腹腔镜下头尾侧联合入路法右半结肠癌切除术,其中男13例、女17例,中分化腺癌22例,低分化腺癌8例;对照组30例采用腹腔镜下中间入路法右半结肠癌切除术,其中男17例、女13例,高分化腺癌1例,中分化腺癌22例,低分化腺癌7例。两组间年龄、性别、体重指数、肿瘤部位和疾病分期差异均无统计学意义(均P>0.05)。两组一般临床资料见表1。
1.2 纳入与排除标准
纳入标准:(1)T1~T4a期肿瘤;(2)无术前新辅助治疗;(3)无远处转移及广泛腹腔转移;(4)心肺功能良好,能耐受手术。排除标准:(1)T4b期肿瘤;(2)腹腔广泛粘连;(3)肿瘤直径>6 cm及中转开腹者;(4)淋巴结明显肿大融合并与周围组织广泛浸润;(5)心肺功能不能耐受手术。
1.3 方法
1.3.1 观察组手术步骤 (1)将患者置于头高足低30°,于胃网膜血管弓外(肿瘤位于结肠肝曲或横结肠右半部分于弓内,距幽门约10 cm处横断胃网膜右血管)切开胃结肠韧带,逐步暴露胰头及胰腺钩突,进入横结肠系膜后间隙,显露胃网膜右静脉(right gastroepiploic vein,RGEV)及肠系膜上静脉(superior mesenteric vein,SMV),解剖出Henle干及上右结肠静脉(superior right colic vein,SRCV)、胰十二指肠前上静脉(ASPDV),Hem-O-Lock夹闭SRCV并离断(如需扩大根治则离断RGEV,清扫第6组淋巴结)。向右、向下分离结肠系膜,显露十二指肠水平部及降部,放置一块纱布条为指引,顺势将肝结肠韧带分离。于胰腺下缘SMV处解剖出结肠中静脉并离断,SMA处解剖出结肠中动脉,并清扫No.223组淋巴结,离断右侧分支(如需扩大根治则离断主干)。(2)此时将患者置于头低足高30°、左侧倾斜15°,将小肠、网膜等腹腔内容物移置左上腹,充分暴露近端小肠系膜与后腹膜的“黄白交界线”。切开并进入融合筋膜间(Toldt′s间隙),适当拓展Toldt′s间隙,右侧至生殖血管,内侧至SMV左侧,上侧显露胰头、十二指肠各段,找到纱布条,头尾侧汇合。由尾侧至头侧解剖并分离SMV及其属支,翻转至右结肠系膜前方,充分暴露SMV在系膜表面的投影,在外科干远端右侧切开腹膜,并与已游离的右结肠后间隙贯通,在系膜前方由尾侧向头侧解剖SMV/SMA及其属支,并分别结扎相应血管;分离升结肠侧韧带,从而完成整个右半结肠及系膜的游离;取上腹部正中切口约6 cm(视肿瘤大小),取出游离后肠管(含肿瘤),完成消化道的重建,并在腔镜下关闭肠系膜裂孔。
1.3.2 对照组手术步骤 将大网膜和横结肠向头侧方向推,小肠拨向左侧腹腔,暴露升结肠系膜及血管在术野内。以回结肠血管解剖投影为起点,沿SMV为主线解剖血管。于SMV左右侧分别高位结扎切断回结肠动脉、右结肠动脉、回结肠静脉、右结肠静脉。超声刀沿Toldt's间隙锐性分离,显露十二指肠水平部,充分游离升结肠系膜,将胰头表面及十二指肠表面结缔组织剥离,继续向头侧游离右侧横结肠系膜至根部并离断。离断胃结肠韧带,继续向右游离结肠肝曲。继续向右向下分离至肾前筋膜表面和回肠末端系膜,自上而下打开升结肠右侧腹膜,与内侧已游离的系膜间隙会师,这样升结肠系膜完整地从后方的肾前筋膜上游离下来。取右侧经腹直肌切口,长约6 cm左右,将肠管(包括肿瘤)提出体外并完成消化道的重建。
1.4 观察指标
手术指标:中位手术时间、估计失血量、淋巴结数目、系膜完整性分级[11];术后恢复指标:术后疼痛VAS评分(术后第1、3、5天)、术后第一次排气时间(d)、术后腹腔引流量(术后第1、3、5天)、住院时间(d);肿瘤指标:CEA、CA19-9(术前及术后6月);术后近期并发症:肺部感染、吻合口瘘、切口疝、肠梗阻等(术后随访半年)。
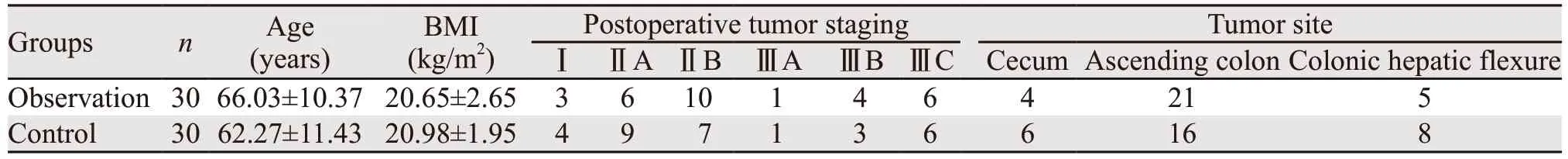
表1 观察组与对照组患者一般临床资料Table 1 General clinical data of two groups
1.5 统计学方法
所有资料均采用SPSS17.0统计软件处理,非正态分布计量资料描述采用中位数±标准差,正态分布计量资料描述采用均数±标准差,计数资料两组间比较采用χ2检验,计量资料两组间比较采用t检验或秩和检验,P<0.05为差异有统计学意义。计数资料的描述采用率或构成比。
2 结果
2.1 手术指标的比较
两组在手术时间方面差异无统计学意义(P>0.05),但观察组出血量少于对照组,获取淋巴结清扫较对照组多,系膜完整性优于对照组,差异均有统计学意义(均P<0.05),见表2。

表2 观察组与对照组患者手术指标比较Table 2 Comparison of surgical indicators between two groups
2.2 术后恢复情况的比较
两组患者在术后第一次排气时间、术后住院天数、术后疼痛评分及术后引流量方面差异均无统计学意义(均P>0.05),见表3。
2.3 肿瘤标志物的比较
两组患者术前及术后6月CEA、CA19-9比较差异均无统计学意义(均P>0.05),见表4。
2.4 术后近期并发症比较
观察组出现肺部感染2例,淋巴漏1例,肠梗阻1例,术后谵妄1例。对照组出现肺部感染1例,切口感染2例,吻合口瘘1例,吻合口出血1例,肠梗阻1例。两组比较差异无统计学意义(χ2=0.111,P=0.739)。
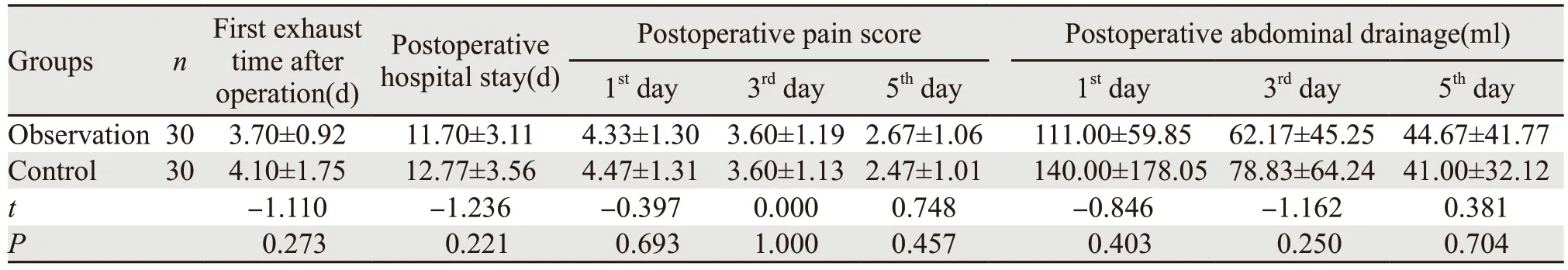
表3 观察组与对照组患者术后恢复情况Table 3 Postoperative recovery of two groups

表4 观察组与对照组患者术前及术后6月CEA、CA19-9的比较Table 4 Comparison of CEA and CA19-9 between two groups before and 6 months after treatment
3 讨论
全球共识认为全直肠系膜切除(total mesorectal excision,TME)是直肠癌手术的标准:该手术侧重于直肠系膜完整切除,实现肿瘤和淋巴引流区域淋巴结的清扫[12]。它可以减少肿瘤的局部复发率,提高直肠癌患者的生存质量及生存率。Hohenberger等[13]基于TME理念,于2009年首次提出完全结肠系膜切除术(complete mesocolic excision,CME),CME可减少结肠局部复发的发生率,提高结肠癌患者的远期生存率。近年来,结肠癌根治手术理念有两种:欧洲学者提出的CME与中央血管结扎术(central vascular ligation,CVL)和日本学者提出的D3根治术[14]。CME的核心是按照解剖层面,在壁层和脏层筋膜间分离,高位结扎肿瘤供应血管,完整切除标本并获取尽可能多的淋巴结[15]。相对于传统的结肠癌根治术,CME切除沿着肾前筋膜这一外科手术平面,结合CVL,可以彻底清扫区域淋巴结,在局部复发率、无疾病生存和总生存率方面具有更好的肿瘤学结果[16]。右半结肠癌D3根治手术要求清扫右半结肠滋养血管根部的淋巴结,即需要裸化肠系膜上动脉(superior mesenteric artery,SMA)并清扫其右侧区域淋巴结[17]。
右半结肠血管变异较多,手术难度相对较大,对于手术入路的选择,国内学者一直在积极探索。目前主流的手术方式有:(1)中间入路法。李国新等[18]提出腹腔镜辅助右半结肠切除术的中间入路解剖法,是以SMV为解剖学标志和主线,以融合筋膜间隙为主要外科平面,血管解剖明确、淋巴清扫彻底、外科平面清晰的手术方式。并成为腹腔镜右半结肠手术的标准入路。(2)尾侧入路法。邹瞭南等[19]提出了尾侧入路法,暴露小肠系膜根与后腹膜愈着形成的“黄白交界线”,切开腹膜,进入Toldt’s间隙(右结肠后间隙),充分暴露胰头、十二指肠、SMV/SMA及其右则部分属支的后方,清扫相应淋巴结,显露范围右侧至生殖血管,左侧至SMV/SMA左侧,上侧至十二指肠球部。以SMV/SMA在腹膜后的体表投影为航标,于回结肠血管远心侧解剖SMV/SMA,与之前游离的右结肠后间隙贯通。由尾侧向头侧沿SMV/SMA解剖回结肠血管、右结肠血管、中结肠血管及胃结肠共同干,并清扫相应的淋巴结。但对于胃结肠干(Henle干)解剖不熟识的初学者来说,具有一定的难度,此处血管解剖变异复杂,极易大出血,出血后止血困难。(3)头侧入路,首先切开胃结肠韧带,先暴露Henle干,再循中间入路法完成血管的离断及淋巴结的清扫。(4)传统开腹手术的外侧入路,由于有直接接触肿瘤之嫌,被认为不符合肿瘤手术的No-touch原则,逐渐被摒弃。
结合头侧入路及尾侧入路的优势,我们提出了腹腔镜右半结肠切除术的头尾侧联合入路法,遵循CME+D3手术原则。右半切除的难点是胃结肠干的处理。切开胃结肠韧带,显露胰腺后,更容易暴露Henle干,结扎右结肠静脉或副右结肠静脉,减少静脉损伤而导致的出血风险。本研究显示了术中出血量观察组少于对照组。分析中间入路组法术中出血量多的病例皆因Henle干或其属支损伤导致。暴露十二指肠水平部进入横结肠后间隙后,垫以纱布作为指引。此时头侧游离完成,将体位改为头低15°,转到尾侧,显露“黄白交界线”,进入右侧结肠后间隙,分离平面至纱布处,贯通整个右结肠右间隙与横结肠后间隙,系膜的完整性可以很好的得到保证。中间入路法腹腔镜右半结肠切除术存在一定技术难点,特别对于初学者,在回结肠血管下方进入右结肠后间隙时,体瘦患者容易直接穿破结肠系膜,而肥胖患者由于系膜肥厚,血管隆起不明显,解剖标志寻找困难,而较难进入正确的外科平面,易导致系膜的缺损。系膜完整性分级:(1)系膜平面:手术标本由完整的肠系膜包被,系膜表面光滑;(2)系膜内平面:肠系膜在远离肠管方向有明显的撕裂等破损;(3)固有肌层平面:明显的肠系膜撕裂或破损至肠壁固有肌层。我们将系膜平面评为2分,系膜内平面评为1分,固有肌层平面评为0分。头尾侧联合入路组评分达1.73±0.45,高于中间入路组(1.27±0.45),P<0.05,显示了其平面优势。头尾侧联合入路法以动脉为导向,显露SMA,而中间入路法限于SMV的显露,因此联合入路法能获得更多的淋巴结(23.90±7.32vs.18.30±6.43,P<0.05)。肿瘤标志物CEA及CA19-9在术后均明显下降,提示两种手术入路的安全性。腹腔镜手术术后切口较小,加之ERAS理念的深入发展,患者术后疼痛感受大为改善,两组间无差异。目前手术理念提倡膜解剖[20],大多能进入正确的手术平面,术后血性引流量不多见,多为创面炎性渗出液,随着时间推移,引流量逐渐减少,两组间无差异。手术后并发症几乎不可避免,两组患者均出现了肺部感染及粘连性肠梗阻,术后早期下床活动能减少此类并发症的发生。联合入路法循SMA清扫淋巴结,容易导致淋巴漏的发生,术中仔细辨认淋巴管并夹闭,有助于降低淋巴漏的发生率。
综上,腹腔镜右半结肠切除术采用头尾侧联合入路安全、可行。对于初学者来说更容易暴露胃结肠干,避免不必要的血管损伤出血,快速、准确的进入右侧结肠后间隙,保持系膜的完整性。
