免疫治疗研究进展及其在三阴性乳腺癌中的应用
2020-12-07郑红梅冯尧军许娟程洪涛金立亭钟伟吴新红
郑红梅,冯尧军,许娟,程洪涛,金立亭,钟伟,吴新红
0 引言
2013年,Science杂志将肿瘤免疫治疗列为前十的科学突破之一[1]。免疫治疗是目前癌症治疗的新模式,主要包括两种方式:被动免疫治疗和主动免疫治疗。被动免疫治疗是通过注射已知肿瘤抗原的特异性单克隆抗体从而刺激机体产生免疫反应,达到抑制肿瘤的目的;主动免疫治疗是通过给予一种治疗性疫苗来激活患者自身的免疫系统,从而达到主动抑制肿瘤发生或复发的目的。最近,探索宿主免疫系统清除癌细胞内在机制的研究取得一定进展,针对侵袭性强的恶性肿瘤,在免疫治疗领域产生了很多潜在的新治疗策略[2]。癌症免疫治疗的分类总结,见图1。

图1 癌症免疫治疗分类Figure 1 Classification of cancer immunotherapy
乳腺癌是全球女性首位癌症死亡原因,近年发病率有明显升高趋势[3]。三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体、孕激素受体和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)均呈阴性表达的特殊类型乳腺癌,占所有乳腺癌的15%~20%。其缺乏有效的内分泌治疗和靶向治疗手段,目前证实有效的全身治疗方式主要为化疗,患者化疗结束后往往短时间内即出现复发或远处转移,预后差[4]。因此探索有效的、可与化疗药物联用以提高疗效的靶向药物和分子靶标成为临床需要重点解决的问题。三阴性乳腺癌是与肿瘤免疫微环境联系最为紧密的乳腺癌亚型。根据基因测序结果三阴性乳腺癌可分为不同亚型,其中较常见的一种亚型为免疫调节亚型,该亚型与肿瘤免疫反应密切相关,为寻找三阴性乳腺癌有效的化疗与免疫靶向药物联用的治疗手段提供了突破口[5]。近年来,免疫检查点抑制剂在各类实体瘤中疗效显著,在三阴性乳腺癌中也初显疗效,与化疗、放疗和其他靶向治疗手段联用可进一步提高疗效[6-7]。本文将对癌症免疫治疗研究进展及其在三阴性乳腺癌中的应用,尤其是免疫检查点抑制剂的临床试验设计及其与化疗、放疗和靶向治疗联合使用的疗效等进行综述分析。
1 癌症免疫治疗
1.1 肿瘤疫苗
肿瘤疫苗是利用肿瘤细胞、肿瘤抗原或其他相关生物学成份来刺激宿主产生有效的抗肿瘤免疫反应。肿瘤疫苗包括肿瘤细胞疫苗、肿瘤抗原疫苗、树突状细胞(dendritic cell,DC)疫苗、抗个体基因型抗体疫苗、DNA疫苗和抗肿瘤相关的病原体疫苗。肿瘤细胞疫苗用于治疗非小细胞肺癌已经产生了初步疗效[8];肿瘤抗原疫苗(Theratope)是一种包含MUC1的合成抗原疫苗。一项包含了1028例转移性乳腺癌的Ⅲ期临床试验表明,Theratope与内分泌治疗联用可以减缓疾病进展提高总生存[9];DC疫苗已在恶性黑色素瘤、前列腺癌、肺癌、儿童恶性肿瘤中开展临床试验和研究,并且取得初步疗效[10];DNA疫苗已经用于治疗恶性黑色素瘤、乳腺癌、前列腺癌、宫颈癌等[11]。
1.2 以T细胞为基础的治疗
继发性细胞转运治疗(adoptive cell transfer,ACT)是针对个体患者自身免疫细胞(主要为T细胞)的转运性治疗。ACT中运用的免疫细胞包括:淋巴因子激活的杀伤细胞(lymphokineactivated killer cells,LAK)、肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)、细胞因子激活的杀伤细胞(cytokine-activated killer cells,CIK)和巨噬细胞激活的杀伤细胞(macrophageactivated killer cells,MAK)。CAPRI(Cascadeprimed immune,CAPRI)免疫细胞治疗是一种新型的ACT方式,由于其疗效显著和广阔的实用性,其使用超过其他ACT方式。CAPRI免疫细胞治疗可以破坏不同类型的肿瘤细胞,包括乳腺癌、结肠癌和胃癌等[12]。嵌合体抗原受体(chimeric antigen receptor,CAR)是一种天然T细胞受体,无主要组织相容性复合体(major histocompatibility complex,MHC)限制性。基因修饰过的CAR-T细胞已经广泛用于各种肿瘤的治疗,包括淋巴瘤、恶性黑色素瘤、脑胶质瘤等,显示有效的靶向性、较大的毒性和疗效持久性[13]。
1.3 治疗性抗体
治疗性抗体特异性靶向白细胞分化抗原CD3/19/20/22/30/33/52、上皮细胞黏附分子、细胞毒性T细胞相关抗原(cytotoxic T lymphocyte associated antigen 4,CTLA-4)、PD-1和PD-L1等。免疫检查点是人类免疫系统保护性效应因子[14]。肿瘤细胞可以过表达免疫检查点分子来抑制机体的免疫反应,从而逃避免疫监视。通过阻碍免疫抑制性信号通路的传递,检测点抑制剂可以逆转免疫抑制的肿瘤微环境,恢复细胞毒性T细胞的杀伤功能,具体机制见图2。目前,研究最多的是PD-1、PD-L1和CTLA-4抑制剂。其他免疫检查点包括淋巴细胞激活基因3 (LAG3)、TIM-3、CD160、糖基磷脂酰肌醇蛋白(glycosylphosphatidylinositol,GPI)、T细胞免疫球蛋白和黏蛋白-3等。
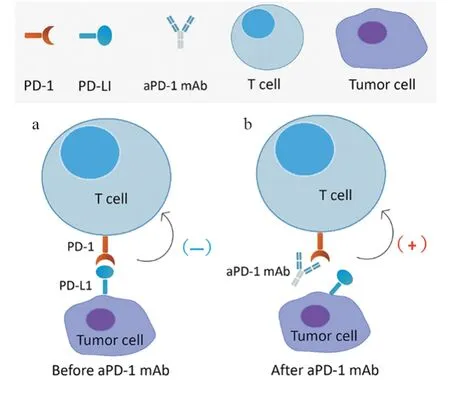
图2 抗PD-1单克隆抗体(aPD-1mAb)治疗三阴性乳腺癌的作用机制示意图Figure 2 Schematic diagram of aPD-1mAb in treatment of triple negative breast cancer
1.4 细胞因子治疗
细胞因子治疗是通过提高细胞因子(cytokines,CKs)的水平和促进其生物学功能来预防和治疗疾病。用于临床治疗的CKs主要包括胸腺素、IL-2、IFN等,并且它们中有很多为重组产物[15]。IL-2是一种研究的最多的CKs,通过正向免疫调节功能,促进T细胞增殖,诱导NK、CTL和其他免疫效应细胞的激活,促进B细胞增殖,分化和抗体形成[16]。CK治疗与其他治疗手段的联合可能成为癌症免疫治疗的一种重要方式。
2 三阴性乳腺癌免疫治疗进展
2.1 免疫检查点抑制剂
三阴性乳腺癌由于其较高的基因不稳定性和突变负担导致新生抗原产生,使其很容易被免疫系统识别,从而成为适合进行免疫治疗干预的瘤种之一[17]。三阴性乳腺癌有较高水平的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)和PD-L1蛋白的表达,提示其免疫反应的活跃性[18-19]。通过TILs计数或免疫标记进行评分,发现具备高水平TILs表达的三阴性乳腺癌患者展示出较好的预后,甚至于在那些没有接受化疗的三阴性乳腺癌患者也是如此[20-21]。这些结果为免疫治疗在三阴性乳腺癌中的使用提供了强有力的理论依据。
JAVELINⅠ期临床试验研究了PD-L1单抗avelumab在不同恶性肿瘤中的疗效,其中有168例乳腺癌患者,该临床试验入组的并不是选择性的PD-L1阳性表达患者,研究结果表明,总体缓解率为4.8%[6]。在三阴性乳腺癌亚组,当PD-L1阳性表达阈值选取为10%时,阳性表达患者的缓解率达到44.4%[22]。在KEYNOTE012临床试验中(ⅠB期),PD-1抑制剂Pembrolizumab单药用于三阴性乳腺癌,剂量10 mg/kg,每两周给药一次。在该临床试验中,PD-L1的阳性阈值定义为≥1%,采用22C3抗体进行IHC检测。在111例三阴性乳腺癌中,65例(58.6%)为PD-L1阳性,总体缓解率为18.5%,26%为疾病稳定[23]。另外两项用于PD-L1阳性表达晚期三阴性乳腺癌患者的Ⅱ期临床试验(KEYNOTE086)同样取得了令人满意的缓解率,其采取的方案为200 mg固定剂量,每三周给药一次(NCT02447003)[24-25]。
2.2 免疫治疗联合化疗
化疗是三阴性乳腺癌辅助治疗和晚期解救治疗阶段的主要治疗方式。目前主要的化疗方案为蒽环、环磷酰胺与紫杉的序贯或联合使用。然而,研究显示,蒽环和奥沙利铂为基础的化疗要求具备完全的免疫活性才能达到最佳的治疗效果[26]。对于那些免疫力受损的患者来说该条件将成为一道阻碍。另一方面,蒽环和奥沙利铂可以通过诱导宿主免疫原性细胞死亡(immunogenic cell death,ICD)和抗肿瘤免疫反应来导致肿瘤生长抑制[27]。有趣的是,在三阴性乳腺癌患者新辅助化疗免疫微环境中的研究显示,化疗可能作为一种关键的免疫调节效应器,将免疫环境从“冷环境”(低的TIL表达)转变为“热环境”(高的TIL表达)。
大多数初诊为早期三阴性乳腺癌的患者均接受了新辅助化疗[27]。研究表明,接受新辅助化疗仍有残留病灶患者的预后更差,可能与宿主免疫抑制细胞的继发性扩增、免疫效应器的减少、化疗耐药克隆形成等有关[26],因此进一步强化治疗成为合理选择,包括单药免疫调节药物或免疫调节药物与化疗的联用等。SWOG1418/BR006研究针对新辅助化疗后手术仍有残留的患者进行,术后继续给予PD-1抑制剂pembrolizumab每三周一次,连用52周。Keynote522(NCT03036488)Ⅲ期临床研究,针对Ⅱ~Ⅲ期早期三阴性乳腺癌,比较Pembrolizumab和新辅助化疗联用与单用新辅助化疗之间的疗效差异,其中Pembrolizumab需要序贯使用1年,结果显示,联用组与对照组pCR分别为64.8%和51.2%,差异有统计学意义(P<0.001)[7]。另外一项评估Pembrolizumab和新辅助化疗联用的安全性和有效性的ⅠB期临床研究Keynote173也表明,其毒性可控,Pembrolizumab使用剂量为200 mg,整体pCR达60%,进一步探索性分析提示,pCR与PD-L1阳性表达和间质肿瘤浸润淋巴细胞呈正相关[28]。
在晚期三阴性乳腺癌解救治疗阶段,也有一些针对化疗与免疫治疗联用的临床试验。最近发表的Impassion130研究,在转移性和局部晚期三阴性乳腺癌患者中PD-L1抑制剂Atezolizumab联合白蛋白紫杉醇相比单用化疗组,出现mPFS的显著获益,也直接导致FDA批准PD-L1抑制剂用于此类患者的治疗,且FDA将PD-L1阳性定义为采用VENTANA PD-L1(SP142)检测其表达≥1%者[29]。这些数据均提示,免疫治疗与化疗的联用将极大改善晚期三阴性乳腺癌患者的预后。同时这些研究也提示我们对于免疫治疗与化疗联用获益人群有效生物标志物的筛选显得尤其重要。
2.3 免疫治疗与靶向治疗
尽管三阴性乳腺癌缺乏明确的靶标,比如HER2、雌激素受体和孕激素受体,然而在新辅助化疗之后,90%的三阴性乳腺癌出现信号通路的突变,针对这些突变的信号通路的靶标目前正处于临床研究阶段。这些靶标包括:PARP抑制剂、PI3K抑制剂、组蛋白去乙酰化酶(histone deacetylase inhibitors,HDAC)抑制剂、TP53/MYC抑制剂和TGFβ抑制剂等[30]。针对这些新靶标的单独或与免疫治疗联用的临床试验也正在广泛开展。
2.4 免疫治疗与放疗
一项评估PD-1抑制剂Pembrolizumab与放疗联合用于晚期三阴性乳腺癌的Ⅱ期临床研究显示,主要终点指标总体缓解率为17.6%,无4级严重不良反应发生[31]。Aguilera等将放疗敏感三阴性乳腺癌细胞加入放疗不敏感小鼠肿瘤体内,一起接受放疗,发现抑制肿瘤进展的M1亚型巨噬细胞和DC细胞增多,促进肿瘤进展的M2型巨噬细胞减少,形成免疫促进型肿瘤微环境,从而提高免疫治疗的疗效[32]。体内和体外研究均提示放疗可以促进三阴性乳腺癌细胞释放损伤相关模型蛋白,促进中性粒细胞和单核细胞的募集、内皮细胞的激活和抗原呈递细胞的分化和成熟等利于免疫反应的环境,提高放疗和免疫治疗协同的疗效[33]。
2.5 继发性细胞免疫治疗
在一项研究了90例外科切除三阴性乳腺癌的临床研究中,45例接受了化疗或放疗,剩余的45例接受了细胞因子诱导的杀伤性细胞(cytokineinduced killer,CIK)注射治疗联合化疗或放疗。该研究显示,接受了CIK联合治疗亚组显示出更好的DFS和OS[34]。多因素分析显示,CIK辅助治疗是三阴性乳腺癌有效的独立预后指标。该研究提示,化疗辅助的CIK治疗在预防三阴性乳腺癌复发和延长总生存方面有显著优势。
3 总结
免疫检查点抑制剂和继发性细胞免疫治疗是目前癌症免疫治疗的两大主要成就,通过克服肿瘤诱导的免疫抑制使得免疫介导的肿瘤清除发挥主导作用。然而,部分患者依然会对既有免疫治疗产生耐药而导致免疫逃逸,使免疫治疗整体疗效欠佳。在三阴性乳腺癌中,化疗、放疗和新型靶向治疗与现有免疫治疗手段尤其是免疫检查点抑制剂的联合使用,使免疫治疗疗效大大提高。这提示我们针对尚无特殊有效内分泌治疗和靶向治疗手段的三阴性乳腺癌患者而言,寻求免疫检查点抑制剂与化疗或其他免疫靶向治疗手段的有效联合可能是改善其远期生存的有效手段。
