盐酸安罗替尼治疗晚期非小细胞肺癌的近期疗效及相关预测指标
2020-12-07王伟谢宵靓燕迪迪
王伟,谢宵靓,燕迪迪
0 引言
肺癌是全世界最常见的恶性肿瘤之一,居癌症相关死亡病因的首位,世界上确诊的肺癌例数超过160万/年,严重威胁着人们的生命安全[1]。由于发病初期无明显症状,超过50%的患者首次确诊即已进入晚期,丧失手术机会,5年生存率不足20%[2-3]。非小细胞肺癌在临床治疗方法主要有手术、放化疗、靶向和免疫治疗等[4]。对于表皮生长因子受体(epidermal growth factor receptor,EGFR)及ALK、ROS1基因突变阳性的患者,分子靶向药物治疗能显著改善患者预后[5-7]。对于基因突变阴性的患者无法从靶向药物中获益,只能采用含铂双药方案化疗,中位无进展生存期(median progressfree survival,mPFS)仅4~5月[8]。同时靶向药物在应用一段时间,都不可避免地出现耐药,这是目前肺癌治疗中亟待解决的问题,因此需要新的靶向药物支持肺癌的治疗[9]。肿瘤血管生成与肿瘤生长、增殖、进展和转移密切相关;肿瘤中的新生血管为肿瘤组织提供必要的氧气、各种因素和营养,促进肿瘤细胞不断扩增[10-11]。既往实验表明化疗药物联合抗血管生成药物(阿帕替尼)可显著延长非小细胞肺癌患者的mPFS,且不良反应可控[12-14]。安罗替尼是一种新型的、多靶点的抗血管生成药物,随着临床上的广泛应用,寻找合适的疗效预测标志物及筛选敏感人群成为亟待解决的问题。本研究旨在探讨安罗替尼三线治疗非小细胞肺癌的临床疗效以及寻找可能的疗效预测因素。
1 资料与方法
1.1 病例选择及一般资料
回顾性分析2018年6月—2019年8月在郑州大学第一附属医院接受安罗替尼治疗的83例晚期非小细胞肺癌患者的临床资料。纳入标准:(1)诊断年龄30~84岁;(2)经病理或细胞学确诊为非小细胞肺癌;(3)既往接受过二线化疗方案后进展;(4)至少有一个实体肿瘤反应评估标准定义的可测量的病灶;(5)东部合作肿瘤学组表现状况(ECOG)评分为0~2;(6)足够的主要器官功能储备。排除标准:有控制不良的高血压、有出血倾向或缺血性心血管疾病、严重的肝肾功能不全。所有患者至少接受一个周期的安罗替尼治疗,并随访至2019年8月10日,对其疗效进行评估,直至病情进展、死亡或出现不可耐受的不良反应。本研究经郑州大学第一附属医院伦理委员会批准。
1.2 研究方法
所有患者均口服安罗替尼(正大天晴药业集团股份有限公司,国药准字H20180004),起始剂量根据患者具体情况由医师指导12、10或8 mg,连续服用14 d,21 d为一个疗程。服用过程中患者如果出现不能耐受的不良反应,可以减少剂量,如果患者仍然不能耐受则停药。治疗一直持续到疾病进展、死亡或任何其他原因。
1.3 临床疗效评估和不良反应
依据影像学检查,应用实体瘤疗效评估标准(response evaluation in solid tumors,RECIST)1.1进行疗效评估,分为完全缓解(CR)、部分缓解(PR)、稳定疾病(SD)或进展(PD)。客观反应率(ORR)为CR和PR之和。疾病控制率(DCR)为CR、PR和SD之和。无进展生存期(PFS)为从安罗替尼初始治疗之日直至疾病进展或死亡的时间。不良反应参照美国国立癌症研究所常见毒性分级标准4.0版(Common Terminology Criteria for Adverse Events,CTCAE 4.0)进行统计分级(Ⅰ~Ⅳ级)。
1.4 统计学方法
采用SPSS22.0软件进行数据处理和统计学分析。Kaplan-Meier绘制生存曲线,Log rank法进行生存率曲线统计学检验,Cox回归模型分析多因素对无进展生存期的影响,ROC曲线分析多项指标对预后的预测价值。检验水准为α<0.05双尾。
2 结果
2.1 患者临床基本资料
研究共纳入晚期非小细胞癌患者83例,基本资料见表1。
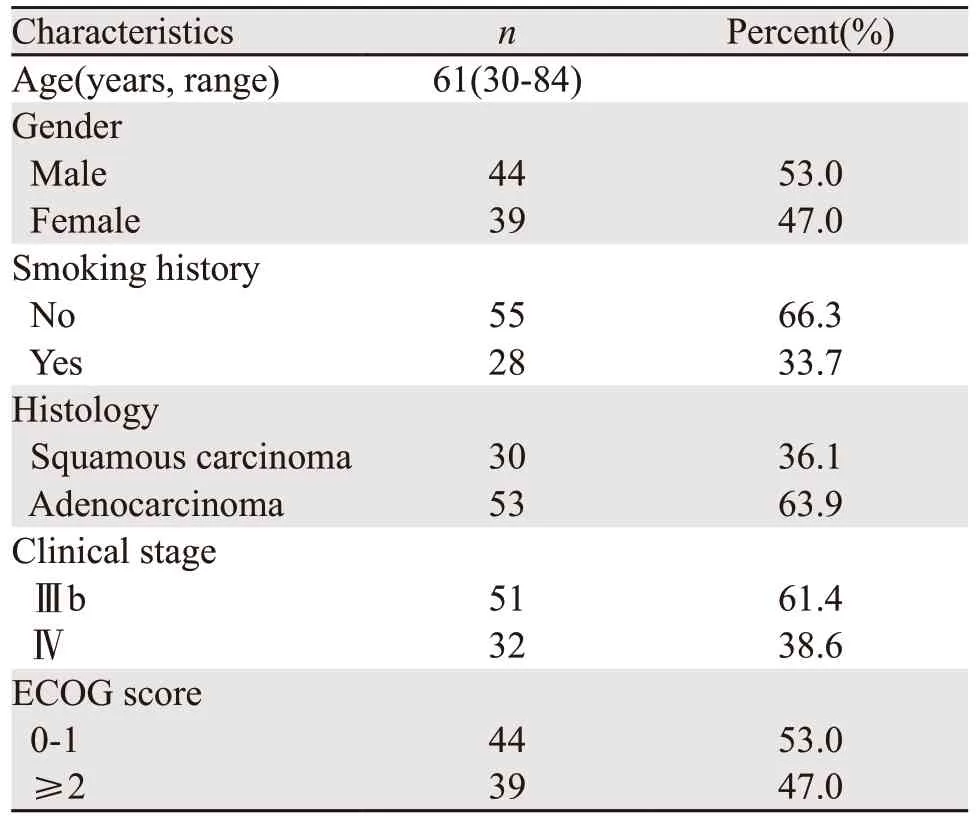
表1 83例晚期非小细胞癌患者的临床信息 (n=83)Table 1 Clinical information of 83 advanced non-small cell cancer patients (n=83)
2.2 近期和远期疗效
截至随访结束,共有54例发生病情进展,7例失访,3例因不良反应停药,19例继续接受治疗。mPFS为4.43月(95%CI:3.10~5.76 月),ORR为12.0%,DCR为79.5%,见图1。
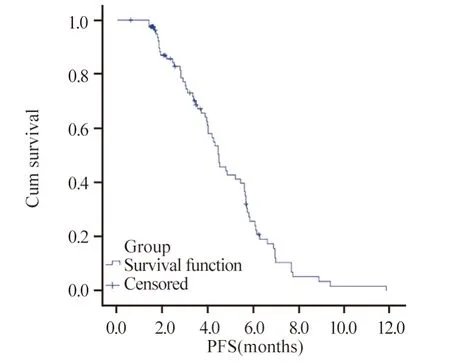
图1 83例晚期非小细胞癌患者无进展生存时间的Kaplan-Meier曲线Figure 1 Kaplan-Meier curves of PFS of 83 advanced nonsmall cell cancer patients
2.3 一般不良反应
83例患者均可评价不良反应,且研究中无治疗相关死亡。常见的不良反应(AEs)为高血压、蛋白尿、口腔黏膜炎、消化道出血、蛋白尿、手足综合征、乏力等。Ⅲ~Ⅳ级AEs的发生率为48.38%。3例因消化道出血、手足综合征、Ⅲ级蛋白尿停止用药,1例患者因高血压控制不佳将安罗替尼减量至8 mg/d。
2.4 无进展生存期相关的临床单因素分析
ECOG评分≥2分、合并胸腔积液、有低白蛋白血症、谷酰胺转肽酶GGT升高、CYFRA21-1升高、血小板压积Pct升高、合并肺脉管癌栓的晚期非小细胞癌患者PFS明显缩短,差异有统计学意义(均P<0.05),见表2。
2.5 无进展生存期相关的临床多因素分析
Cox多因素回归分析显示,胸腔积液、ECOG体力状况评分、低白蛋白血症、CYFRA21-1以及合并肺脉管癌栓是PFS的独立预后因素,见表3。ROC曲线分析CYFRA21-1对非小细胞肺癌具有较高的疗效预测价值,见图2。
3 讨论
盐酸安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制促进血管形成的相关激酶,如内皮细胞生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维生长因子受体、干细胞生长因子受体等,进而发挥抗肿瘤血管生成和抑制肿瘤生长的作用[15-16]。安罗替尼Ⅲ期临床试验显示,安罗替尼作为晚期NSCLC的三线治疗药物,能够明显提高DCR、ORR,延长患者的PFS、OS[17]。本研究观察安罗替尼三线以上治疗NSCLC的临床疗效,结果显示全组患者总体mPFS为133 d,本研究DCR、PFS略低于ALTER0303研究数据,可能与样本量小、部分患者治疗超过三线、部分老年患者大于70岁等因素有关。
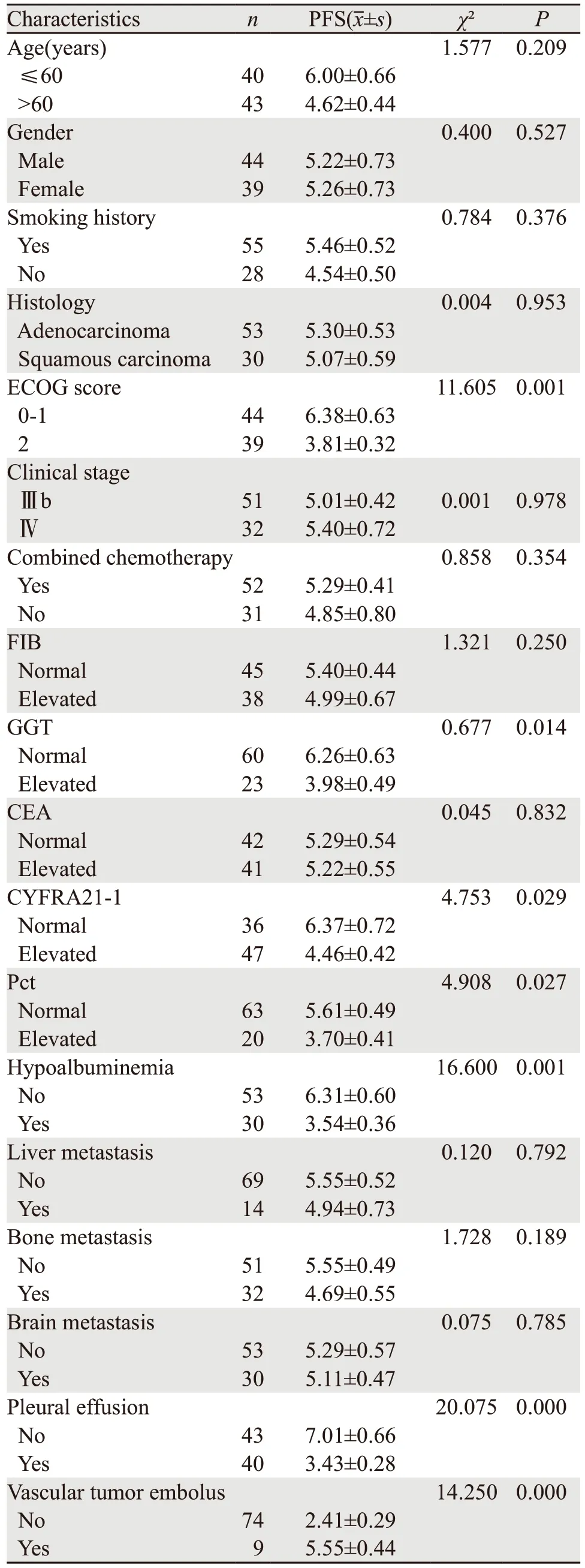
表2 83例晚期非小细胞癌患者临床特征与生存期的单因素分析Table 2 Univariate analysis of clinical features and survival time of 83 advanced NSCLC patients
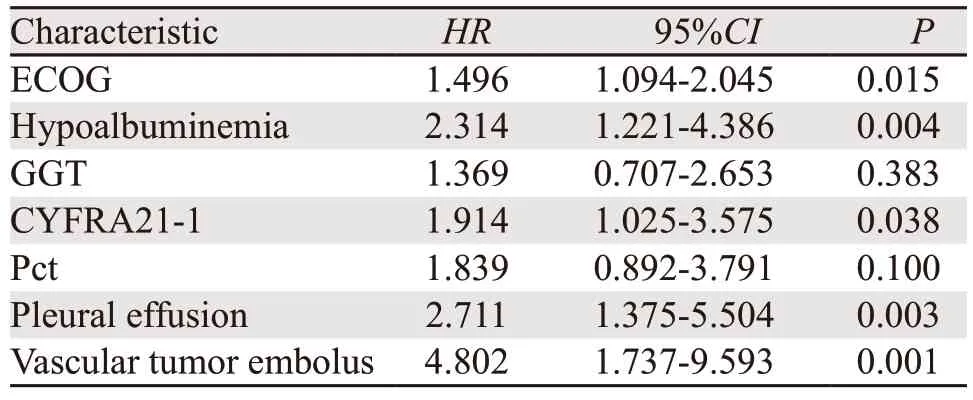
表3 83例晚期非小细胞癌患者无进展生存期的多因素Cox回归分析Table 3 Multivariate Cox regression analysis of PFS of 83 advanced NSCLC patients
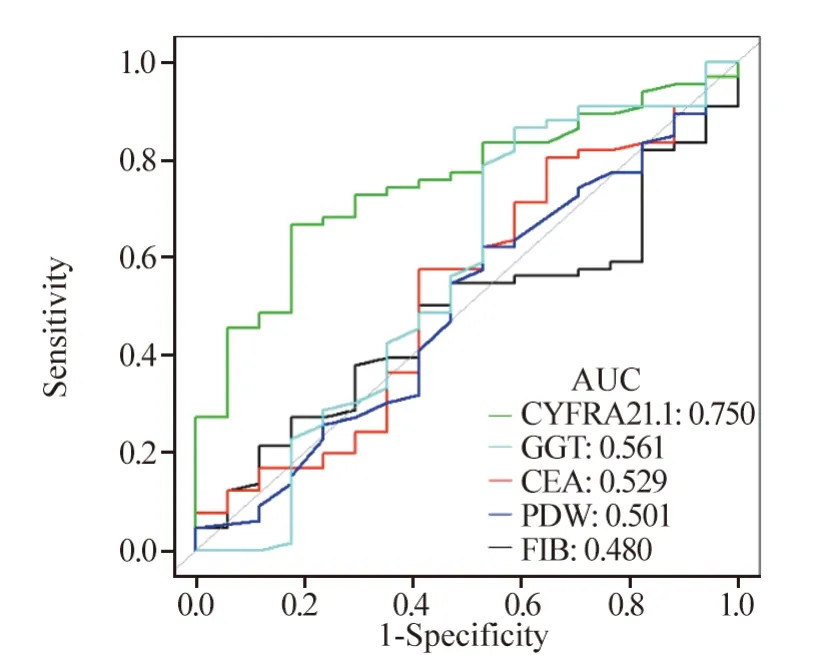
图2 ROC曲线分析各项指标对预后的预测价值Figure 2 ROC curve analysis of prognostic value of each indicator
在临床特征方面,一项关于阿帕替尼治疗晚期非小细胞肺癌的研究显示,ECOG评分0~1分的患者相比于2分的患者中位PFS明显延长(3.0月:1.1月,P=0.014)[18]。Girard等[19]研究也指出,ECOG评分可作为晚期非小细胞肺癌二线治疗后的疗效预测指标。本研究结果也显示,ECOG评分可作为PFS的独立预测因素,与之前研究结论相同。
恶性肿瘤直接侵犯、转移到胸膜或者原发性胸膜肿瘤所致的胸腔积液称为恶性胸腔积液,肺癌是最常见引起胸腔积液的原发肿瘤[20]。本研究结果显示合并胸腔积液患者的PFS较无胸腔积液患者明显缩短,且是一项独立预测因素,与Porcel等[21]研究结论相同。
CYFRA21-1是目前检测NSCLC的首选血清肿瘤标志物,它的水平与肿瘤生长趋势有关,多项研究指出其在鳞癌患者中阳性率较高,且在疗效评估、监测复发方面意义重大[22-23]。本研究也发现CYFRA21-1可以作为非小细胞肺癌独立预测疗效的生物标志物,具有较高的临床疗效预测价值,值得进一步探索研究。
肿瘤晚期患者大多合并低白蛋白血症,本研究结果显示合并低白蛋白血症患者疗效差,且是一项独立预测因素。其机制目前尚不清楚,推测可能与以下因素有关:恶性肿瘤对机体的代谢产生影响,促使机体产生负氮平衡,从而导致低白蛋白血症。既往研究表明临床分期和体内肿瘤负荷是白蛋白水平的决定因素[24]。合并低白蛋白血症患者,多数处于肿瘤晚期且合并恶病质,体力状态极差。同时白蛋白参与药物代谢的部分过程,低白蛋白血症可能间接影响着药物疗效[25]。
脉管癌栓是恶性肿瘤常见的一种现象,既往研究表明,脉管癌栓的形成是淋巴结转移和神经侵犯的必要条件。有研究发现,脉管癌栓是食管癌新辅助治疗后预后不良及食管癌淋巴结转移的独立危险因素[26-27]。本研究也发现合并肺部脉管癌栓的晚期非小细胞肺癌患者的PFS明显缩短,脉管癌栓为一项独立预测因素。
对于二线治疗后进展的晚期非小细胞肺癌,应用安罗替尼治疗效果可,ECOG评分、CYFRA21-1、低白蛋白血症、脉管癌栓、胸腔积液可作为PFS的独立预测因素。本研究的不足之处在于,对于临床应用中存在的不良因素的患者未进行详细的随访观察记录。多数患者尚存活故未能进行OS相关分析。同时由于样本量较小,对于安罗替尼联合化疗的疗效未能进一步明确及分析,结果有待于大规模前瞻性研究进一步证实。
