反相-亲水作用色谱-定制多反应监测法同步测定肉苁蓉多成分含量
2020-12-06宋青青张珂李婷管朋维龚兴成许霞李军屠鹏飞宋月林
宋青青 张珂 李婷 管朋维 龚兴成 许霞 李军 屠鹏飞 宋月林

摘 要 建立了反相色谱-亲水作用色谱-定制多反应监测(RPLC-HILIC-tailored MRM)方法,对肉苁蓉中极性跨度大、含量差异大的27个化学成分的含量进行同步测定。利用RPLC与HILIC的在线直接偶联实现大、中、小极性化学成分的同步色谱保留和分离。Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm)用于RPLC,Xbridge Amide色谱柱(150 mm×4.6 mm, 3.5 μm)用于HILIC,色谱柱间通过混合器引入稀释泵来解决色谱机制不一致的问题。泵A(0.1%甲酸-水)和泵B(乙腈)输送流动相至RPLC柱进行梯度洗脱,流速为0.15 mL/min; 泵C(0.1%甲酸-水)和泵D(乙腈)以1.0 mL/min的流速输送流动相至混合器,改变RPLC柱洗脱液的组成,促进极性大的化学成分在HILIC柱中的保留。通过灵活调节在线碰撞能,提高微量成分的质谱响应,抑制常量成分的质谱响应,形成定制多反应监测模式。最终同步测定36批肉苁蓉中27个化学成分,包括氨基酸类、有机酸类、糖类、苯乙醇苷类、环烯醚萜类、木质素类等类型。方法检出限为0.0032~160 μg/g,定量限为0.032~320 μg/g,线性相关系数大于0.9929,加标回收率为74.7%~125.1%,相对标准偏差(RSD)为1.6%~13.7%。本方法线性范围宽、准确度高、适用性广,为肉苁蓉及其它中药化学成分的深入定量分析提供了有效手段。
关键词 反相色谱-亲水作用色谱; 定制多反应监测模式; 极性跨度; 含量跨度; 肉苁蓉
1 引 言
肉苁蓉为列当科植物荒漠肉苁蓉Cistanche deserticola Y.C. Ma干燥带鳞叶的肉质茎,始载于《神农本草经》,具有补肾阳、益精血、润肠通便等功效[1],从1977年开始为历版《中国药典》收录。现代药理研究结果表明,肉苁蓉具有提高性功能、抗老年痴呆症、抗帕金森病、提高学习记忆能力、抗衰老、抗疲劳、保肝、通便等多种作用[2~5]。肉苁蓉也被我国卫健委列入“药食同源物质”名录。
迄今,已从肉苁蓉中分离得到120余种化合物,主要包括苯乙醇苷类、环烯醚萜及其苷类、木脂素及其苷类、寡糖酯类、多元醇及多糖类等[2,3]。苯乙醇苷类化合物为肉苁蓉主要活性化学成分群,以苯乙醇苷为主要成分的苁蓉总苷胶囊被用于血管性痴呆的临床治疗。松果菊苷于2017年获得新药临床批件,主要适应症为老年痴呆。除含量较高的松果菊苷和毛蕊花糖苷外,肉苁蓉中甘露糖醇、异毛蕊花糖苷、2′-乙酰毛蕊花糖苷、红景天苷等微量成分也具有广泛的生物活性[5~7]。
液相色谱-质谱联用技术(Liquid chromatography-tandem mass spectrometry,LC-MS)前处理过程简单、灵敏度高、选择性强,适用于复杂基质的化学成分分析[8,9],尤其是在中药多成分定量研究中得到了广泛应用[10,11]。然而,中药活性成分常表现出不同的极性,单一色谱体系难以同时实现强、中、弱极性化学成分的全面分析,无法满足中药全面质量评价的要求。全二维色谱[12]、中心切割色谱[13]等多维色谱体系以及多种新型色谱填料技术[14]虽然可以提高色谱的峰容量,增强对不同极性化合物的保留和分离能力,但仍难以同步定量分析具有大极性跨度的有效成分群。单一批次中药样品同时含有常量及微量成分,对于不同批次样品,各化合物的含量差异非常大。肉苁蓉中主要成分松果菊苷含量是其它微量苯乙醇苷类化合物的数十倍甚至数千倍[15,16]。由于生长环境、采收时间和后期饮片加工方式等因素,不同批次肉苁蓉中松果菊苷的含量差异也可达千倍以上[17]。Zou等[18]利用1H NMR技术比较了肉苁蓉的三种不同干燥方式,发现蒸汽杀酶结合冷冻干燥的肉苁蓉中苯乙醇苷含量比直接冷凍干燥、蒸汽杀酶结合烘干的肉苁蓉高2~3倍,且三者中糖类、有机酸等强极性的初生代谢产物的含量也存在显著差异。
为了全面提高中药肉苁蓉质量控制水平,本研究建立了适用于不同含量与极性的多指标成分同步定量分析方法。反相色谱(RPLC)适用于中小极性化合物的保留和高效分离,而对强极性或是亲水性化合物的保留和分离能力较弱。本研究利用RPLC及亲水作用色谱(HILIC)分离机制的互补性,将RPLC柱及HILIC柱直接相联,实现不同极性化合物的同时保留[19]; 充分利用三重四极杆-线性离子阱质谱(Qtrap-MS)灵敏度高的优势,采用在线能量分辨质谱技术筛选各目标分析物的最适宜碰撞能(CE)[20],形成定制多反应监测模式(Tailored MRM),同步定量分析常量及微量化学成分。基于所建立的RPLC-HILIC-定制多反应监测法(RPLC-HILIC-tailored MRM),对肉苁蓉中27种氨基酸类、有机酸类、糖类、苯乙醇苷类、环烯醚萜类、木质素类化学成分进行同步定量分析,为肉苁蓉及其它中药质量控制提供了有效的分析方法。
2 实验部分
2.1 仪器与试剂
岛津分析型高效液相色谱仪(日本Shimadzu公司),配四个LC-20AD泵、 DGU-20A真空脱气机、SIL-20A自动进样器、CTO-20AC柱温箱; SCIEX Qtrap5500质谱仪(美国SCIEX公司); 超声波清洗器(南京垒君达超声电子设备有限公司); XS105型电子分析天平(瑞士Mettler-Toledo公司); Milli-Q超纯水系统(美国Millipore公司); XW-80A漩涡混合器(海门其林贝尔仪器制造有限公司); PREMIXER ASSY混合器(日本Shimadzu公司)。
色谱纯甲醇、质谱纯甲酸和乙腈(美国Thermo Fisher公司); 对照品烟酸(Nicotinic acid)、琥珀酸(Succinic acid)、莽草酸(Shikimic acid)购于美国Sigma公司; 尿苷(Uridine)、腺苷(Adenosine)、肌苷(Inosine)、腺嘌呤(Adenine)、鸟苷(Guanosine)购于北京欣经科生物科技有限公司; 肉苁蓉苷F(Cistanoside F)购于四川成都曼斯特生物科技有限公司; 红景天苷(Salidroside)购于上海源叶生物科技有限公司; 肉苁蓉苷A(Cistanoside A)、2′-乙酰毛蕊花糖苷(2′-Acetylacteoside)、芹糖甘草苷(Liquiritin apioside)购于上海诗丹德生物科技有限公司; 管花苷A(Tubuloside A)购于四川维克奇生物科技有限公司; 6-去氧梓醇(6-Deoxycatalpol)、苯丙氨酸(Phenylalaine)、8-表马钱子酸(8-Epi-Loganic acid)、甘露糖醇(Mannitol)、蔗糖(Sucrose)、格鲁苷(Gluroside)、京尼平苷(Geniposide)、阿拉善苷A(Alaschanioside A)、松果菊苷(Echinacoside)、落叶松脂素葡萄糖苷(Lariciresinol 4′-O-glucoside)、阿魏酸(Ferulic acid)、毛蕊花糖苷(Acteoside)、异毛蕊花糖苷(Isoacteoside)、松脂素葡萄糖苷(Pinoresinol 4-O-glucoside)均由本实验室制备、鉴定所得。经HPLC-DAD检测,以上对照品纯度均大于98%。实验用水为Milli-Q纯水系统(美国Millipore公司)制备的超纯水。
36批肉苁蓉样品(CD1-CD36)均采集于中国新疆、内蒙古、甘肃等地区(见电子版文后支持信息表S1), 经鉴定为荒漠肉苁蓉[Cistanche deserticola Y.C. Ma]干燥带鳞叶的肉质茎。
2.2 实验方法
2.2.1 标准溶液的配制 精确称取各对照品适量,分别用二甲基亚砜(DMSO)、甲醇或水配成 4 mg/mL或10 mg/mL的标准品储备液。使用前, 精密吸取各标准品储备液适量,用50%(V/V)甲醇稀释成不同浓度的混合标准溶液。取混合标准溶液各50 μL,加入950 μL含内标物的25%(V/V)乙腈-水溶液稀释,配制成不同浓度标准曲线溶液。
2.2.2 样品制备 肉苁蓉药材采集后,将其切成片, 40℃干燥处理4 d后,粉碎并过筛。称取1.0 g干燥粉末,加入50%(V/V)甲醇定容至50 mL,称重,超声处理30 min,冷却后再次称重,用甲醇补足失重,摇匀,静置。 上清液过0.22 μm滤膜,取续滤液50 μL,加入950 μL含内标物的25%(V/V)乙腈-水(内标物终浓度为138 ng/mL),待测。
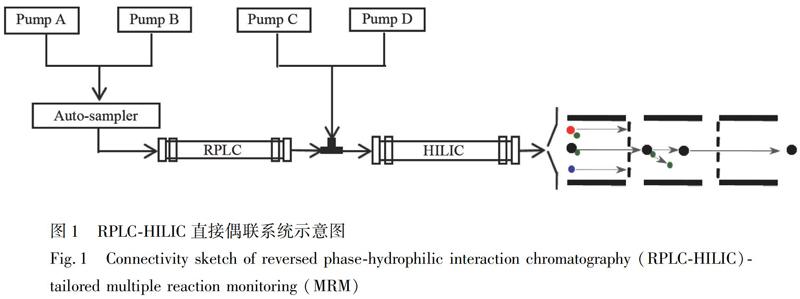
2.2.3 RPLC-HILIC直接偶联系统条件 RPLC-HILIC直接偶联系统示意图见图1。RPLC柱:Waters Acquity UPLC HSS T3(2.1×100 mm,1.8 μm),HILIC柱:Waters Xbridge Amide(150 mm×4.6 mm,3.5 μm)。泵A和泵C输送流动相: 0.1%甲酸-水; 泵B和泵D输送流动相:乙腈; 稀释泵由泵C和泵D组成。RPLC色谱柱和稀释泵分别连接于混合器入口,混合器出口连接HILIC色谱柱。泵A和泵B输送流动相流入T3色谱柱进行梯度洗脱: 0~4 min,10% B; 4~8 min,10%~20% B; 8~22 min,20%~55% B; 22.1~30 min,10% B; 流速为0.15 mL/min。同时,稀释泵以1.0 mL/min流入混合器,与RPLC柱流出的流动相混合后,一同流入HILIC柱,稀释泵梯度洗脱程序如下:0~4 min,100% D; 4~8 min, 100%~84% D; 8~22 min,84%~61% D; 22.1~30 min,100% D。两根色谱柱均置于40℃的柱温箱中,进样量2 μL。
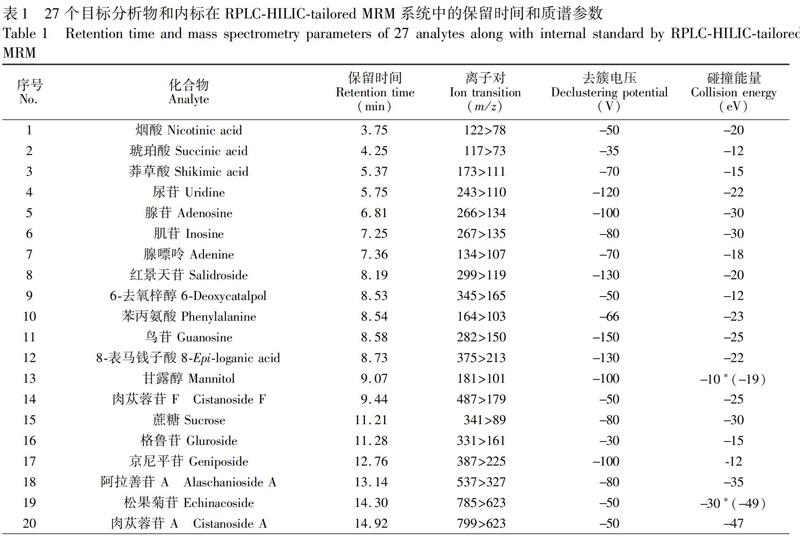
2.2.4 质谱条件 电喷雾离子源(ESI), 负离子模式, 多反应监测(MRM)-信息依赖性采集(IDA)-增强自离子扫描模式(EPI), 时间窗为90 s。气帘气: 35.0 psi(1 psi=6.89 kPa); 碰撞气等级: 高; 喷雾电压: 4500 V; 雾化气: 55 psi; 辅助气: 55 psi; 雾化温度: 550℃。 27个定量化合物及内标物的离子对、CE、去簇电压(DP)等质谱参数见表1。IDA设置强度阈值大于20000 cps的一个峰度最高的母离子,靶向获得二级质谱信息,EPI质量数采集范围m/z 100~1000,碰撞能(30±20)eV。
3 结果与讨论
3.1 RPLC-HILIC-tailored MRM分析方法的建立
3.1.1 色谱条件优化 通过实验考察,小内径RPLC柱适于作为前置色谱分离柱用来分离强、弱极性化合物,而在RPLC柱上无法保留的弱极性化合物能够通过后置大内径HILIC色谱柱保留和分离。比较了Phenomenex Kinetex-C18 shell(100 mm×2.1 mm,2.6 μm)、ACE UltraCore 2.5 Super C18(150 mm×3.0 mm, 2.5 μm)、Shiseido Capcell Core C18(150 mm×2.1 mm,2.7 μm)和Waters Acquity UPLC HSS T3(100 mm×2.1 mm, 1.8 μm)4种候选RPLC柱,相比于其它色谱柱,T3色谱柱对强、弱极性化合物的保留能力较强,分离度和峰形较好(图2B)。比较了Shiseido Capcell Core PC HILIC(150 mm×2.1 mm,2.7 μm)、Merck SeQuantZIC-cHILIC(150 mm×2.1 mm,3.0 μm)、Phenomenex Kinetex HILIC(50 mm×2.1 mm,2.6 μm)和Waters Xbridge Amide(150 mm×4.6 mm,3.5 μm)4種HILIC色谱柱,发现在乙腈和0.1%甲酸的流动相条件下,烟酸、琥珀酸、尿苷等亲水性化合物均能够在Amide色谱柱上良好的保留和分离,灵敏度高,峰形较好(图2C),优于其它三种色谱柱。因此,本研究选择T3色谱柱以及键合酰胺官能团的Amide色谱柱。
由于RPLC和HILIC流动相组成相似,但色谱原理相反。HILIC采用强极性固定相,需要高浓度的有机溶剂作为流动相实现强极性化合物的分离。因此,在RPLC和HILIC进行直接偶联时,引入了稀释泵(泵C和泵D)提供高浓度有机溶剂(乙腈)来解决RPLC和HILIC两个色谱体系流动相组成不一致的问题。根据各化合物的保留情况及色谱行为优化流速,T3色谱柱流速为0.15 mL/min,稀释泵流速为1.0 mL/min,进入质谱流速共计1.15 mL/min,位于Turbo VTM ESI离子源允许范围之内。稀释泵采用纯乙腈为起始比例,使Amide的起始流动相比例为88%,能够保证极性化合物在Amide上良好的保留。进一步优化梯度洗脱程序,结果如2.2.3项下所述。
基于已优化方法,分别将Amide色谱柱和T3色谱柱用等长的不锈钢管线(0.13 mm, i.d.)替代,建立RPLC单柱和HILIC单柱色谱系统。考察了混合标准品在RPLC-HILIC、RPLC、HILIC上的色谱行为,发现RPLC对氨基酸、有机酸等强极性成分(1,3~7,11,13,15)无法有效保留,均在死体积共流出(图2B),而HILIC的色谱分辨率较低,色谱峰宽,且对阿魏酸(23)等弱极性化合物无法有效保留(图2C)。同时,在RPLC以及HILIC单柱系统中,共流出的化合物在质谱检测时会发生离子竞争,从而造成不同程度的基质效应。然而,采用RPLC-HILIC偶连系统可以实现不同极性化合物的全面保留和良好分离(图2A)。图2D为肉苁蓉样品(CD23)的RPLC-HILIC-tailored MRM提取离子流图,表明构建的色谱方法同时实现了肉苁蓉中27个氨基酸类、有机酸类、糖类、苯乙醇苷类、环烯醚萜类、木质素类目标分析物的测定。
国家药典委员会. 中华人民共和国药典. 北京: 中国医药科技出版社, 2015: 135
2 Fu Z, Fan X, Wang X, Gao X. J. Ethnopharmacol., 2018, 219: 233-247
3 Jiang Y, Tu P F. J. Chromatogr. A, 2009, 1216(11): 1970-1979
4 Gu C, Yang X, Huang L. Front. Pharmacol., 2016, 7: 289
5 TU Peng-Fei, GUO Yu-Hai. Cultivation Techniques of Cistanche Deserticola and Its Host Haloxylonam Modendron. Beijing: Science Press, 2015: 31-38
屠鹏飞, 郭玉海. 荒漠肉苁蓉及其寄主梭梭栽培技术. 北京: 科学出版社, 2015: 31-38
6 Li M, Xu T, Zhou F, Wang M, Song H, Xiao X, Lu B. Int. J. Mol. Sci., 2018, 19(4): 1135
7 SHI Zi-Yi, WU Yun, ZHU Yue-Mei, CUI Hai-Ou, WANG Min, YIN Hong-Mei, JIANG Yong, TU Peng-Fei. Modern Chin. Med., 2019, 21(12): 1641-1646
石子仪, 吴 云, 朱月美, 崔海鸥, 王 敏, 殷洪梅, 姜 勇, 屠鹏飞. 中国现代中药, 2019, 21(12): 1641-1646
8 ZHOU Shao-Heng, LIANG Chuang, TANG Yang, LIAO Yan-Hua, LIN Wen-Si. Chinese Journal of Chromatography, 2018, 36(5): 425-430
周劭桓, 梁 川, 唐 陽, 廖艳华, 林文斯. 色谱, 2018, 36(5): 425-430
9 DU Ying-Ying, LIU Xiang-Zhen, YE Mei-Jun, XU Jian-Feng, GAO Hai-Yan, ZHENG Guo-Jian. Chinese Journal of Chromatography, 2019, 37(6): 597-604
杜颖颖, 刘相真, 叶美君, 徐建峰, 高海燕, 郑国建. 色谱, 2019, 37(6): 597-604
10 ZHANG Li-Yuan. World Chin. Med., 2018, 13(2): 513-516, 521
张黎媛. 世界中医药, 2018, 13(2): 513-516, 521
11 He X R, Li C G, Zhu X S, Li Y Q, Jarouche M, Bensoussan A, Li P P. J. Sep. Sci., 2017, 40(1): 81-92
12 Zhou W, Liu Y, Wang J, Guo Z, Shen A, Liu Y, Liang X. J. Sep. Sci., 2020, 43(1): 87-104
13 LIU Yong-Li, WANG Chang-Shun, WANG Xiao-Lei, YANG Shu-Nan, LIU Xing-Guo, FENG Li. Chinese J. Anal. Chem., 2016, 44(5): 828-832
刘永利, 王常顺, 王晓蕾, 杨抒楠, 刘兴国, 冯 丽. 分析化学, 2016, 44(5): 828-832
14 Abou El-Alamin M M, Sultan M A, Atia M A, Aboul-Enein H Y. Comb. Chem. High Throughput Screen, 2020, doi: 10.2174/1386207323666200220114818
15 Dong Y, Guo Q, Liu J, Ma X. J. Sep. Sci., 2018, 41(9): 1913-1922
16 QIN Wen-Ting, WANG Xiao-Ming, XU Rong, SU Mei-Feng, LUO Xiao-Mei, CHANG Xiao-Yan, CHEN Jun, SHI Yue. Modern Chin. Med., 2018, 20(4): 426-431
覃文婷, 王小明, 徐 荣, 宿美凤, 雒晓梅, 常晓燕, 陈 君, 石 钺. 中国现代中药, 2018, 20(4): 426-431
17 ZHAO Jing-Jing, LI Wei, ZHANG Li-Juan, AN Jun, SONG Xin-Bo. J. Liaoning Univ. Tradit. Chin. Med., 2012, 14(8): 89-91
赵晶晶, 李 薇, 张丽娟, 安 君, 宋新波. 辽宁中医药大学学报, 2012, 14(8): 89-91
18 Zou P, Song Y, Lei W, Li J, Tu P, Jiang Y. Acta Pharm. Sin. B, 2017, 7(6): 647-656
19 Yan Z, Yan R. Anal. Chim. Acta, 2015, 894: 65-75
20 Song Y L, Song Q Q, Liu Y, Li J, Wan J B, Wang Y T, Jiang Y, Tu P F. Anal. Chim. Acta, 2017, 953: 40-47
21 Vrhovsek U, Masuero D, Gasperotti M, Franceschi P, Caputi L, Viola R, Mattivi F. J. Agric. Food Chem., 2012, 60(36): 8831-8840
