老年急性心肌梗死患者血清微小核糖核酸-133a、微小核糖核酸-208a表达水平与冠状动脉病变程度相关性研究
2020-12-05张小坤王玉霞刘亚宁
张小坤,王玉霞,刘亚宁,谢 明
华北石油管理局总医院 心内一科,河北 任丘 062550
急性心肌梗死(acute myocardial infarction,AMI)在老年群体中患病率高,其病变机制较复杂,包括炎症因子聚集、内皮细胞功能损害、冠脉粥样硬化、血栓形成等,具有发病急、病情进展快等特点,若未及时治疗,可出现心力衰竭、心律失常、心脏破裂等并发症,预后欠佳[1]。有研究报道,微小核糖核酸(microRNA,miR)与AMI患者内皮细胞功能损害、炎症聚集、脂代谢紊乱、冠状动脉病变等过程密切相关[2]。miR-208a对心脏发育影响较大,参与心肌损伤病变过程,临床将其视为评估心肌损伤的重要标志物[3]。有研究报道,当心肌组织受损后,可导致miR-208a表达增高[4]。miR-133a则参与慢性心力衰竭等病变过程[5]。有研究报道,miR-133a表达水平与AMI主要不良心血管事件发生率有关[6]。血清miR-208a、miR-133a可能参与AMI病理过程,有望成为评估AMI病情的潜在指标。目前,关于miR-208a、miR-133a表达与AMI病变程度的相关研究较少。本研究旨在观察AMI患者血清miR-133a、miR-208a表达水平,分析其与冠脉病变程度的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取自2017年2月至2019年2月收治的120例AMI患者为AMI组,患者均存在不同程度的冠状动脉病变;选取同期收治的80例稳定型心绞痛(stable angina pcctoris,SAP)患者为SAP组;选取同期体检的72例健康者为健康组。纳入标准:(1)AMI、SAP符合《临床诊疗指南·心血管分册》中诊断标准[7]。(2)AMI患者为首次发病,冠脉造影提示至少存在1支血管狭窄超过50%。(3)AMI、SAP患者意识清醒,认知功能、沟通能力良好。(4)AMI、SAP患者病例资料齐全。(5)健康体检者身体健康状况良好,既往无严重病史。排除标准:(1)恶性肿瘤病史者。(2)伴有心肌炎、先天性心脏病者。(3)肝、肾等器官严重受损者。(4)既往有精神病史者。(5)既往存在心脏手术史者。(6)近3个月内有慢、急性感染病史者。3组患者性别、年龄、体质量指数等临床资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医院伦理委员会批准,研究对象均签署知情同意书。

表1 3组患者临床资料比较/例(百分率/%)
1.2 研究方法 分别于入院当日或体检当日空腹取3 ml肘静脉血,3 000 r/min离心5 min,离心半径10 cm,分离血清存放于低温冰箱待检测。采用实时荧光定量法检测3组血清miR-133a、miR-208a表达水平。主要仪器:冷冻高速离心机(湖南迈克尔,VL-200R)、荧光定量聚合酶链式反应仪(美国Bio-rad,CFX96)、电子天平(日本岛津,TW-O5B)、移液器(瑞士伊孚森,SOCOREX)、灭菌器(日本ALP,CL-32L)。主要试剂:无水乙醇(国药集团,规格:500 ml)、血清miRNA提取试剂盒(北京天根生物)、miR-133a引物(锐博科技)、miR-208a引物(锐博科技)。采用血清miRNA提取试剂盒对总RNA进行提取,并经反转录处理成互补DNA,具体操作参考说明书。miR-133a引物序列,上游5′-CGCCGGTTACTGAGACACATTC-3′,下游5′-TGCAGATCGAA TATTCCAGCATAC-3′;miR-208a引物序列,上游5′-GTCCTTCAAGCAGACCGATGT-3′,下游5′-CAGCACTCAGTCAACGTCTCA-3′。聚合酶链式反应条件:预变性95℃ 10 min 1个循环;95℃ 2 s,60℃ 20 s,70℃ 10 s,49个循环。miR-133a、miR-208a相对表达量以2-△△CT表示,二者均以U6视为内参基因,引物序列上游5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游5′-CGCTTCACGAATTTGCGTGTCAT-3′。
1.3 观察指标 记录并比较3组血清miR-133a、miR-208a表达水平。对AMI患者行冠状动脉造影,根据Gensini评分[8]明确AMI患者冠状动脉病变程度,总分<25分为轻度,总分25~50分为中度,总分>50分为重度,比较不同冠状动脉病变程度的AMI患者血清miR-133a、miR-208a表达水平。分析AMI患者血清miR-133a、miR-208a表达水平与冠状动脉病变程度的相关性,血清miR-133a、miR-208a对冠状动脉病变加重的评估价值及AMI患者冠脉病变加重的危险因素。

2 结果
2.1 3组血清miR-133a、miR-208a比较 AMI组、SAP组的血清miR-133a、miR-208a相对表达量高于健康组,且AMI组高于SAP组,差异均有统计学意义(P<0.05)。见表2。

表2 3组血清miR-133a、miR-208a相对表达量比较
2.2 不同冠状动脉病变程度患者血清miR-133a、miR-208a比较 重度、中度病变患者的血清miR-133a、miR-208a相对表达量均高于轻度病变患者,且重度病变患者高于中度病变患者,差异均有统计学意义(P<0.05)。见表3。

表3 不同冠状动脉病变程度患者血清miR-133a、miR-208a比较
2.3 血清miR-133a、miR-208a与AMI冠状动脉病变程度相关性 以Gensini评分反映冠状动脉病变程度,AMI组患者Gensini评分为(45.23±20.76)分。经Pearson线性相关分析显示,血清miR-133a、miR-208a与AMI冠状动脉病变程度呈正相关(r=0.729、r=0.680,P<0.05)。见图1。
2.4 血清miR-133a、miR-208a对AMI冠状动脉病变加重的评估价值 以中度、重度患者为冠状动脉病变加重,ROC曲线显示,血清miR-133a、miR-208a及二者联合评估冠脉病变加重的ROC曲线下面积分别为0.751、0.774、0.854。见表4、图2。
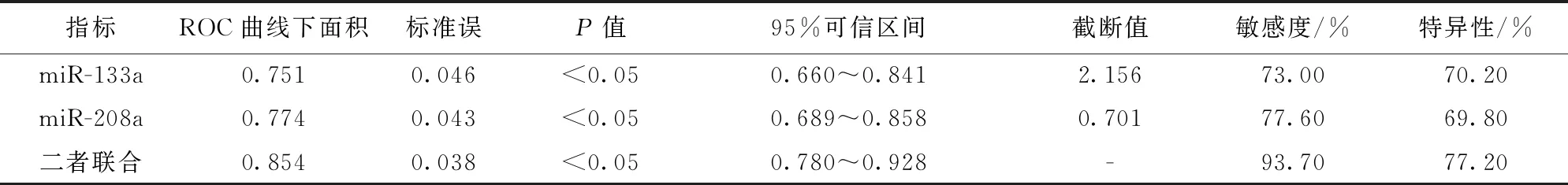
表4 血清miR-133a、miR-208a对AMI冠状动脉病变加重的评估价值
2.5 AMI冠脉病变加重的危险因素分析 采用Logistic回归模型对各变量进行量化赋值,血清miR-133a、miR-208a以ROC曲线得出的截断值为界进行赋值。以性别、年龄、体质量指数、吸烟史、饮酒史、糖尿病、高血压以及血清miR-133a、miR-208a相对表达量作为自变量,以AMI冠脉狭窄是否加重作为因变量。Logistic回归分析结果显示,糖尿病、高血压以及血清miR-133a、miR-208a表达水平增高是AMI冠脉病变加重的危险因素(P<0.05)。见表5。

表5 AMI冠脉病变加重的危险因素分析
3 讨论
冠状动脉粥样硬化进展是导致AMI发病的重要因素之一,粥样斑块形成需要一定时间,这期间一旦血管壁炎症受损程度加重,会促进脂质堆积,引起巨噬细胞聚集,纤维帽厚度下降,促使斑块破裂,导致局部血小板大量聚集,诱发血栓,增加AMI发生风险[9]。尽早评估、诊断冠状动脉病变程度是改善预后的关键。目前,关于评估冠状动脉病变严重度的可靠生物学标志物的研究较少。有研究报道,miRNA在心血管疾病进展过程中发挥重要作用,如冠心病、心力衰竭等疾病中均发现有miRNA参与,其涉及的机制较复杂,可影响免疫细胞的分化、发育过程,调节免疫、炎症系统[10]。miR-133a、miR-208a与心肌受损、心脏衰竭密切相关,二者影响心脏转录因子表达[11-12]。miR-133a、miR-208a表达异常可能与心肌损伤病变存在关联。miR-133a能调控内皮细胞功能,参与心血管疾病进展[13]。miR-208a表达异常能促进内皮细胞功能受损,导致大量炎症因子局部聚集,诱发不良事件,加重病情[14]。
本研究结果显示,AMI患者血清miR-133a、miR-208a的相对表达量明显增高,且血清miR-133a、miR-208a与AMI冠状动脉病变程度呈正相关。miR-133a在心肌细胞、平滑肌细胞内均有表达,可调控平滑肌细胞增殖,促进动脉粥样硬化[15]。有研究发现,心肌梗死患者损伤面积越大,受损程度越重,miR-133a表达越高,且表达增高会影响冠脉循环[16]。笔者推测,在心肌组织受损后,因局部受损细胞内环境改变,可导致miR-133a释放量增加,并进入冠脉循环。心肌受损、冠状动脉病变程度越重,miR-133a释放量可能越大,最终参与血液循环,导致血清miR-133a表达水平增高。miR-208a能促进心肌组织重构,在miR-208a表达异常的情况下,可诱发心律失常,这一过程可能与其促进β-主要组织相容性复合体增高有关[17]。笔者推测,AMI患者因心肌组织受损,导致miR-208a异常表达,上调β-主要组织相容性复合体水平,致β-主要组织相容性复合体与α主要组织相容性复合体处于失衡状态,进一步损害心功能与内皮细胞,加重冠状动脉病变程度。上述分析表明,血清miR-133a、miR-208a表达水平增高说明患者存在心肌组织损伤,可加重内皮细胞功能损害,促进动脉粥样硬化发生,这可能是二者加重AMI患者冠状动脉病变的机制。本研究绘制ROC曲线证实,血清miR-133a、miR-208a对AMI冠状动脉病变加重有一定评估价值,ROC曲线下面积均>0.700,总体评价效果较理想。
本研究中,采用Gensini评分反映AMI患者的冠状动脉病变程度。结果显示,血清miR-133a、miR-208a与AMI冠状动脉病变程度呈正相关,二者表达水平越高,冠状动脉病变程度越重。有研究报道,miR-133a、miR-208a在血清内表达上调,有利于炎症因子释放入血,引起机体炎症,可能诱发血栓性静脉炎,促进血栓形成[18-19]。笔者推测,miR-133a、miR-208a表达增高,可能通过加重机体炎症、促进血栓形成来导致冠状动脉病变加重。本研究发现,血清miR-133a、miR-208a异常增高是AMI冠状动脉病变加重的危险因素。在未来的AMI治疗探索中,miR-133a、miR-208a有望作为新的治疗靶点。此外,高血压、糖尿病也与AMI冠状动脉病变程度有关。高血压可导致患者冠状动脉内皮功能受损,还可增强血小板粘附作用,促进脂蛋白大量沉积,加重冠状动脉病变[20]。糖尿病患者若持续处于高血糖状态,可导致凝血机制异常,促进血小板聚集,上调纤维蛋白原水平,有利于冠状动脉血栓形成,加重冠状动脉病变[21]。本研究选取样本较少,且未分析血清miR-133a、miR-208a表达对预后的影响,仍需在后续研究中进一步探讨。
综上所述,血清miR-133a、miR-208a在AMI患者中表达明显增高,且与冠状动脉病变密切相关,二者联合检测对冠状动脉病变程度具有一定预测价值。
