大面积脑梗死患者外周血Th1、Th2、Th17、Treg细胞水平变化及意义
2020-12-05刘磊董海何仲春徐丽娟
刘磊 董海 何仲春 徐丽娟
脑梗死是一种由多种诱因引起的患者脑组织局部血液供应不足或血管受损出血,造成脑组织坏死或软化的疾病[1]。患者发病前往往无特殊表现,易被忽视。脑梗死病情发展迅速,大面积脑梗死致死致残率高,严重影响患者生存时间[2-3]。大面积脑梗死的发病是一个复杂的生理过程,涉及多种免疫机制,免疫调节T 细胞是脑梗死发病中的重要组成部分。孙德锦等人[4]研究发现脑梗死患者免疫调节的T 细胞亚群分布与病情的发展密切相关。但目前关于大面积脑梗死患者免疫调节T 细胞亚群分布特点的研究较少。本研究旨在探讨大面积脑梗死患者外周血辅助性T 细胞1(T-helpercell 1,Th1)、辅助性T 细胞2(T-helpercell 2,Th2)、辅助性T 细胞17(T-helpercell 17,Th17)、调节性T 细胞(regulatory T cells,Treg)水平变化及意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年2月至2019年2月本院收治的大面积脑梗死患者98 例作为观察组,选取临床同期行体检的正常人员53 例作为对照组。其中,观察组中男53 例,女45 例,年龄27~79 岁,平均年龄(48.89±7.14)岁;对照组中男32 例,女21 例,年龄35~80 岁,平均年龄(49.53±6.98)岁。两组患者的一般资料比较差异无统计学意义(P>0.05),具有可比性。
纳入标准:①首次发病,经磁敏感加权成像(susceptibility weighted imaging,SWI)检测诊断,梗死体积>10 cm3,符合大面积脑梗死的诊断标准[5];②患者及其家属签署知情同意书且同意进行研究;③发病至入院时间<48 h。排除标准:①合并患有其他功能性障碍疾病;②有其他恶性肿瘤或未控制的感染病灶;③孕期或哺乳期妇女;④合并严重的肝肾功能疾病、血液系统疾病及自身免疫性疾病。本研究经医院伦理会批准。
1.2 方法
1.2.1 采血检测方法
两组患者于采血前空腹8~12 h,采集外周血5 mL,以有荧光标记的Th1、Th2、Th17、Treg 单克隆抗体对外周血进行标记。以流式细胞仪(美国Beckman Coulter Gallios)检 测Th1、Th2、Th17、Treg 细胞水平。蛋白分析仪(西门子BioSystems A15)行散射免疫比浊法检测,测定患者免疫细胞因子白介素-17(interleukin17,IL-17)、肿瘤坏死因子a(tumor necrosis factor-α,TNF-α)、白介素-14(interleukin14,IL-4)与γ-干扰素(interferon-γ,IFN-γ)的含量。
1.2.2 SWI 检查方法及判断
采用SWI-MRI 扫描影像结果对两组研究对象进行诊断。选取美国GE 公司的1.5T MRI 仪进行检测,观察组研究对象采用仰卧体位,头前脚后进入。SWI-MRI 原始图像经EWS 2.7 工作站处理,以3D MIP 软件分析形成最小强度投影,得到SWI的最终图像[5],根据T1WI、T2WI、SWI 高低信号的变化,由1 名资深主任医师与2 名副主任医师,以双盲法评估梗死区域的病灶数量及程度,先经由2名副主任医师进行评判,意见不一致时交由主任医师进行评判。
1.3 统计学处理
采用SPSS 18.0 统计学软件进行数据分析,计数资料用n(%)率表示,采用χ2检验,计量资料采用(±s)表示,采用t检验,梗死面积、梗死灶数量、免疫细胞因子与Th1、Th2、Th17、Treg 的相关性采用Spearman秩相关分析,采用logistics 回归分析细胞水平与大面积梗死诊断的相关性,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较
观察组患者Th1、Th17、IL-17,TNF-α,IL-4与IFN-γ 显著高于对照组,差异具有统计学意义(P<0.05),观察组患者Th2、Treg 显著低于对照组,差异具有统计学意义(P<0.05)。见表1。
2.2 观察组患者治疗前后Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较
观察组患者治疗前Th2、Treg 显著低于治疗后,差异具有统计学意义(P<0.05);观察组患者治疗前Th1、Th17、IL-17,TNF-α,IL-4 与IFN-γ 显著高于治疗后,差异具有统计学意义(P<0.05)。见表2。
表1 两组患者Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较(±s)Table 1 Comparison of Th1,Th2,Th17,Treg cells,IL-17,TNF-α,IL-4 and IFN-γ between 2 groups(±s)
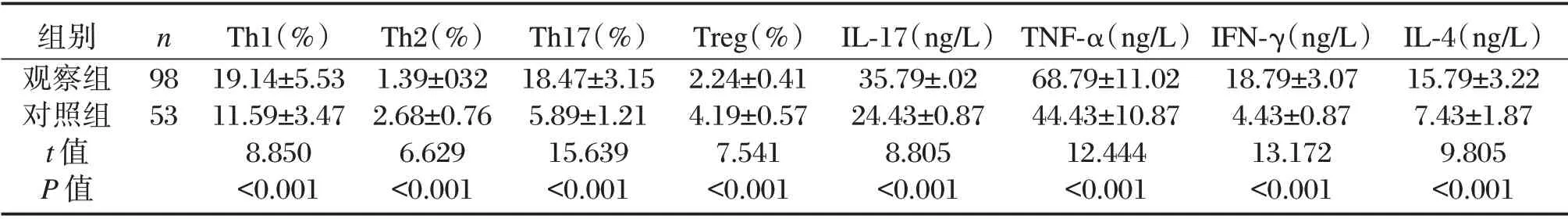
表1 两组患者Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较(±s)Table 1 Comparison of Th1,Th2,Th17,Treg cells,IL-17,TNF-α,IL-4 and IFN-γ between 2 groups(±s)
组别观察组对照组t 值P 值n 98 53 Th1(%)19.14±5.53 11.59±3.47 8.850<0.001 Th2(%)1.39±032 2.68±0.76 6.629<0.001 Th17(%)18.47±3.15 5.89±1.21 15.639<0.001 Treg(%)2.24±0.41 4.19±0.57 7.541<0.001 IL-17(ng/L)35.79±.02 24.43±0.87 8.805<0.001 TNF-α(ng/L)68.79±11.02 44.43±10.87 12.444<0.001 IFN-γ(ng/L)18.79±3.07 4.43±0.87 13.172<0.001 IL-4(ng/L)15.79±3.22 7.43±1.87 9.805<0.001
表2 观察组患者治疗前后Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较(±s)Table 2 Comparison of Th1,Th2,Th17,Treg cells,IL-17,TNF-α,IL-4 and IFN-γ in the observation group before and after treatment(±s)
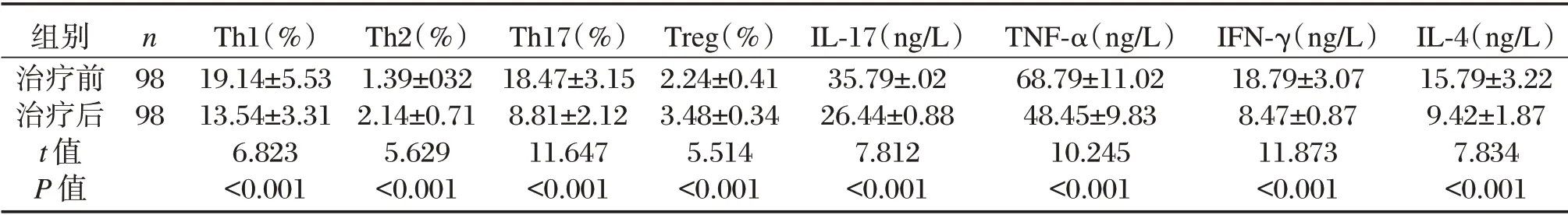
表2 观察组患者治疗前后Th1、Th2、Th17、Treg 细胞水平与IL-17,TNF-α,IL-4、IFN-γ 含量比较(±s)Table 2 Comparison of Th1,Th2,Th17,Treg cells,IL-17,TNF-α,IL-4 and IFN-γ in the observation group before and after treatment(±s)
组别治疗前治疗后t 值P 值n 98 98 Th1(%)19.14±5.53 13.54±3.31 6.823<0.001 Th2(%)1.39±032 2.14±0.71 5.629<0.001 Th17(%)18.47±3.15 8.81±2.12 11.647<0.001 Treg(%)2.24±0.41 3.48±0.34 5.514<0.001 IL-17(ng/L)35.79±.02 26.44±0.88 7.812<0.001 TNF-α(ng/L)68.79±11.02 48.45±9.83 10.245<0.001 IFN-γ(ng/L)18.79±3.07 8.47±0.87 11.873<0.001 IL-4(ng/L)15.79±3.22 9.42±1.87 7.834<0.001
2.3 观察组患者Th1、Th2、Th17、Treg 细胞水平与梗死体积、梗死灶数量、免疫细胞因子相关性分析
SWI 检查结果显示,98 例大面积脑梗死患者中大面积脑梗死病灶数量357 个,其中,脑皮质病灶数量208 个,深部白质病灶数量149 个;10 cm3<梗死灶体积<15 cm337 例,15 cm3<梗死灶体积<25 cm332 例,梗死灶体积>25 cm329 例。Spearman相关系数分析显示,观察组患者外周血Th2、Treg 细胞水平与脑梗死病灶数量、病灶体积、病灶深度呈负相关性(P<0.05),观察组患者外周血Th1、Th17 细胞水平与大面积脑梗死病灶数量、病灶体积、病灶深度呈正相关性(P<0.05)。见表3。
2.4 外周血Th1、Th2、Th17、Treg 细胞水平对大面积脑梗死的诊断与预后价值
以大面积脑梗死诊断结果为因变量(因变量赋值:未发生脑梗死为0,发生脑梗死为1),以外周血Th1、Th2、Th17、Treg 细胞水平为自变量进行logistics 回归分析,结果显示外周血Th1、Th2、Th17、Treg 细胞水平与大面积脑梗死诊断结果具有显著相关性(P<0.05)。见表4。
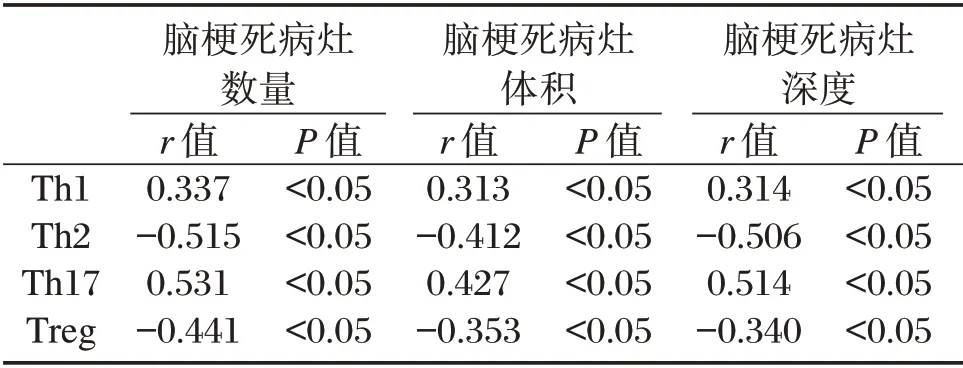
表3 观察组患者外周血Th1、Th2、Th17、Treg 的相关性分析Table 3 Correlation analysis of peripheral blood Th1,Th2,Th17 and Treg in observation group
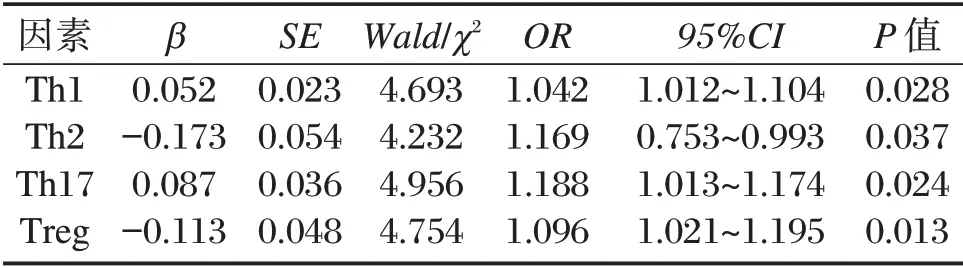
表4 外周血Th1、Th2、Th17、Treg 细胞水平与大面积脑梗死诊断结果的相关性分析Table 4 Correlation analysis between the levels of peripheral blood Th1,Th2,Th17 and Treg cells and the diagnosis results of massive cerebral infarction
3 讨论
大面积脑梗死的发病涉及多种免疫机制,是一个复杂的生理过程。脑梗死患者的病情发展迅速,增加了治疗难度,影响预后效果与生活质量[6]。杨晓军等人[7]的研究发现,大面积脑梗死容易影响患者的免疫细胞水平。脑梗死患者病情发展受到体内免疫调节T 细胞亚群分布与炎性因子等免疫学机制的影响[8-9]。机体免疫系统通过对免疫调节中的T 细胞调节,如Th 细胞、细胞毒性T 细胞(cytotoxic T cells,Tc)、Treg 细胞,在大面积脑梗死部位造成免疫抑制,避免因脑损伤的神经元暴露而导致自身免疫性疾病的发生[10]。本研究旨在探讨大面积脑梗死患者外周血Th1、Th2、Th17、Treg 细胞水平变化及意义。
本研究结果显示外周血中Th1、Th2、Th17、Treg 细胞水平与IL-17、TNF-α 含量的变化,与大面积脑梗死的发病进程密切相关,可作为大面积脑梗死中重要的生物学标志物,与刘红等人[11]的研究结果相一致。分析结果产生原因可能是脑梗死发生早期,患者体内免疫调节T 细胞的不同亚群主要聚集在损伤脑组织周围,包括CD8+T 细胞、CD4+T 细胞、NKT 细胞等,其中Th 细胞是CD4+T 细胞的重要亚群,主要分为Th1 与Th2 两种亚群。Th1 由CD4+T 细胞分化而成,可以诱导IL-2 与IFN-γ 等免疫细胞因子的分泌,Th2 能介导B 淋巴细胞的体液免疫过程,分泌IL-4 与IL-10 等细胞因子。Th17 和Treg 细胞是由初始T 细胞分化而成的不同亚型,两者在功能上存在拮抗效应,Th17 可诱导神经元释放IL-17 与TNF-α,梗死发生早期Th1、Th17 细胞水平增多,导致外周血IFN-γ、IL-17 含量上升。沙鹏等人[12]的研究发现,Th17/Treg 与脑梗死的严重程度密切相关,Th17、Treg 能参与调控梗死区域脑组织细胞的凋亡过程,与本研究中结果相一致。Treg 具有免疫抑制功能,在脑梗死发生的早期分布于脑组织神经元周围,外周血中含量较少,可诱导TNF-α 分泌,抑制CD8+T 细胞、CD4+T 细胞与初始T 细胞的增殖与分化,起到保护神经元暴露的作用。亓敏等人[13]的研究结果显示,采用脑心通胶囊治疗后,患者脑梗死程度得到一定控制,脑组织代偿性分泌Treg,导致外周血中Treg 含量逐渐上升,随着病情好转,外周血中的Th1、Th17 呈下降趋势,与本研究中观察组患者治疗前Th2、Treg 显著低于治疗后的结果相一致。Spearman相关系数分析结果显示治疗后随病情恢复,Th1/Th2 与Th17/Treg 呈下降趋势,调节体内IFN-γ、IL-4、IL-17 与TNF-α 等炎性因子下降[14-15]。
综上所述,面积脑梗死病情发展与患者外周血Th1、Th2、Th17、Treg 细胞水平密切相关,Th1、Th2、Th17、Treg 细胞水平可能可作为大面积脑梗死发病的独立危险因素。
