直肠癌患者BRMS1mRNA、PTNmRNA的表达及临床意义
2020-12-05马欢焦英华李曙光张贤雨魏玉磊田桂英卢秀荣原娜
马欢 焦英华 李曙光 张贤雨 魏玉磊 田桂英 卢秀荣 原娜
直肠癌是指发生在齿状线至直肠乙状结肠交界处的肿块,是消化道最常见的恶性肿瘤,直肠癌患者临床典型症状以排便习惯改变、里急后重、肛门坠涨等为主,当肿瘤侵犯膀胱、尿道、阴道等周围脏器时可引起尿路刺激症状、骶部及会阴部疼痛及下肢水肿等,此外,直肠癌还可累及多器官,引起重要器官功能不全,具有较高的死亡率[1]。消化道恶性肿瘤微转移是影响患者预后生存的关键,而浸润和转移作为一个复杂的过程,涉及肿瘤细胞和细胞外基质的某些重要物质的相互作用[2]。近年来,分子生物学的研究发现某些肿瘤转移抑制基因对抑制肿瘤细胞侵袭有重要作用,故相关分子指标成为研究的热点[3]。其中,乳腺癌转移抑制基因(breast cancer metastasis suppressorl,BRMS1)及多效生长因子(Pleiotrophin,PTN)分别作为重要的肿瘤转移抑制基因及生长因子,在细胞增殖与转移中均发挥关键作用[4-5]。本研究就直肠癌患者BRMS1mRNA、PTNmRNA 的表达及临床意义进行分析,旨在为临床治疗提供思路,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年5月本院收治的73例直肠癌患者临床资料,纳入标准:①所有患者有明确的病理学诊断依据,均确诊为直肠癌;②入组前未接受放疗及化疗;③肿瘤直径≤5 cm;④临床资料完整且真实;排除标准:①合并血液疾病者;②严重精神疾患或痴呆等无法配合本研究者;③存在除直肠癌以外其他原发性恶性肿瘤者;④合并风湿免疫及结缔组织病变者。其中男性41例,女性32 例;年龄35~72 岁,平均年龄(56.45±5.71)岁。收集肿瘤组织及肿瘤旁(距离直肠癌组织5 cm 以上)的正常直肠粘膜组织,分别作为直肠癌组(n=73)和癌旁组(n=73)。本研究经本院伦理委员会批准,受试者及家属均签署知情同意书。
1.2 研究方法
收集所有患者临床资料,比较BRMS1mRNA、PTNmRNA 在直肠癌及癌旁正常组织的表达情况;分析BRMS1mRNA、PTNmRNA 与直肠癌患者各病理参数的相关性,记录所有患者在随访时间内存活及死亡情况,采用多元Logistic 回归分析影响直肠癌患者预后生存的危险因素,绘制Kaplan-Meier生存曲线研究BRMS1mRNA、PTNmRNA 对患者预后生存的影响。
1.3 观察指标
1.3.1 主要仪器与试剂
ABI PRISM 7000 荧光定量PCR 分析仪购自美国应用生物系统公司,Biophotometer 核酸测定仪购自德国Eppendoff 公司。Trizol RNA 提取试剂盒、M-MLVcDNA 合成试剂盒、PCR 反应试剂、RNase-free 试剂购自试剂由上海生物工程有限公司提供,BRMSl 及3-磷酸甘油醛脱氢酶(GAPDH)RT 引物、荧光定量PCR 引物、荧光探针及用来制作标准曲线的人工合成BRMSl 及GAPDHcDNA均购自上海基康生物技术有限公司。即用型非生物素免疫组化Elivision TM plus 免疫组化检测试剂盒购自福州迈新生物技术开发公司,人重组PTN细胞因子、PTN单克隆抗体以及PTN多克隆抗体购自美国SantaCruz 公司,光学显微镜购自德国Leica 公司。
1.3.2BRMS1mRNA、PTNmRNA 的表达检测
BRMS1mRNA 的表达检测:BRMSl 上游引物5′-GACCGCCAGAGCCrllG-GA3′;下游引物:5′-CTGCCTCTGGCGTGCAG-3′;荧光探针:5-FAMCAGCTCTGAArrGGTGG-MGB-3′;GAPDH 上游引物:5′-CATCAATGACCCCTIlG-3′;下游引物:5′-CATGGGTGGAATCATATTFGGAAC-3′;荧光探针:5′-VIC-CCTCAACTACATGGTITAC-MGB-3′。取组织50~100 μg,Trizol 法提取组织总RNA,核酸蛋白紫外分析检测RNA 质量和浓度。以RT-PCR 试剂盒试剂进行RT 反应。首先反转录为c-DNA,反应条件:37℃1 h,95℃10 min 灭活MMLV,终止逆转录。PCR 反应条件:94℃1 min;58℃1 min,72℃1 min,循环35 次,最后72℃延长7 min。行1.5%琼脂糖电泳鉴定,用凝胶成像分析系统检测BRMS1和β-action mRNA 的表达强度。PTNmRNA 的表达检测采用原位杂交法,严格按照说明书进行操作,阴性对照则使用PBS 替代杂交液。
1.4 随访方法
随访从患者术后开始,直至患者死亡或本研究的随访结束,为期3年,截止于2020年5月31日。患者的随访时间分布在2 至36 个月,平均随访时间为(29.98±2.64)个月。对患者随访的方式主要采用电话随访及患者来院复查为主。在本研究中,总生存时间(overall Survival,OS)表示直肠癌患者从手术治死亡的时长[6]。
1.5 统计学方法
采用SPSS 18.0 软件进行统计分析,计数资料以n(%)表示,行χ2检验,计量资料以(±s)表示,行t检验;以Kaplan-Meier 生存曲线研究BRMS1mRNA、PTNmRNA 对患者预后生存的影响,采用多元Logistic 回归分析影响直肠癌患者预后生存的危险因素,P<0.05 为差异有统计学意义。
2 结果
2.1 两组BRMS1mRNA、PTNmRNA 的表达情况比较
直肠癌组BRMS1mRNA 表达水平较癌旁正常组织低,PTNmRNA 阳性率较癌旁正常组织高,差异均具有统计学意义(P<0.05)。见表1。
表1 两组BRMS1mRNA、PTNmRNA 的表达情况比较[n(%),(±s)]Table 1 Comparison of BRMS1mRNA and PTNmRNA expression in 2 groups[n(%),(±s)]

表1 两组BRMS1mRNA、PTNmRNA 的表达情况比较[n(%),(±s)]Table 1 Comparison of BRMS1mRNA and PTNmRNA expression in 2 groups[n(%),(±s)]
组别直肠癌组癌旁组χ2/t 值P 值n 73 73 BRMS1mRNA 0.59±0.06 0.87±0.07 25.948<0.001 PTNmRNA 阳性59(80.82)21(28.77)39.929<0.001
2.2 BRMS1mRNA、PTNmRNA 与直肠癌患者不同病理参数的关系
不同性别、年龄者BRMS1mRNA、PTNmRNA表达差异无统计学意义,组织高分化、淋巴结无转移、Ⅰ+Ⅱ期、无血性转移、浸润深度未及浆膜、肿瘤距肛缘距离≤7 cm 者BRMS1mRNA 表达水平较组织中低分化、淋巴结转移、Ⅲ+Ⅳ期、血性转移、浸润深度达浆膜、肿瘤距肛缘距离>7 cm 者高,PTNmRNA 阳性率较水平较组织中低分化、淋巴结转移、Ⅲ+Ⅳ期、血性转移、浸润深度达浆膜、肿瘤距肛缘距离>7 cm 者低,差异均具有统计学意义(P<0.05)。见表2。
2.3 患者预后情况及影响患者预后生存的单因素和多因素分析
截至随访结束,73 例直肠癌患者生存49 例,死亡24 例,死亡率为32.88%。
组织中低分化、浸及浆膜、TNM 分期:Ⅲ+Ⅳ期、淋巴结转移、BRMS1mRNA 低表达及PTNmRNA 阳性表达为影响直肠癌患者预后生存的独立危险因素(P<0.05)。见表3。
2.4 BRMS1mRNA、PTNmRNA 表达与直肠癌患者预后生存的关系
不同BRMS1mRNA、PTNmRNA 表达情况下Keplan-meier 生存曲线明显不同。见图1。
表2 BRMS1mRNA、PTNmRNA 与直肠癌患者不同病理参数的关系(±s)Table 2 Relationship between BRMS1mRNA,PTNmRNA and different pathological parameters in patients with rectal cancer(±s)
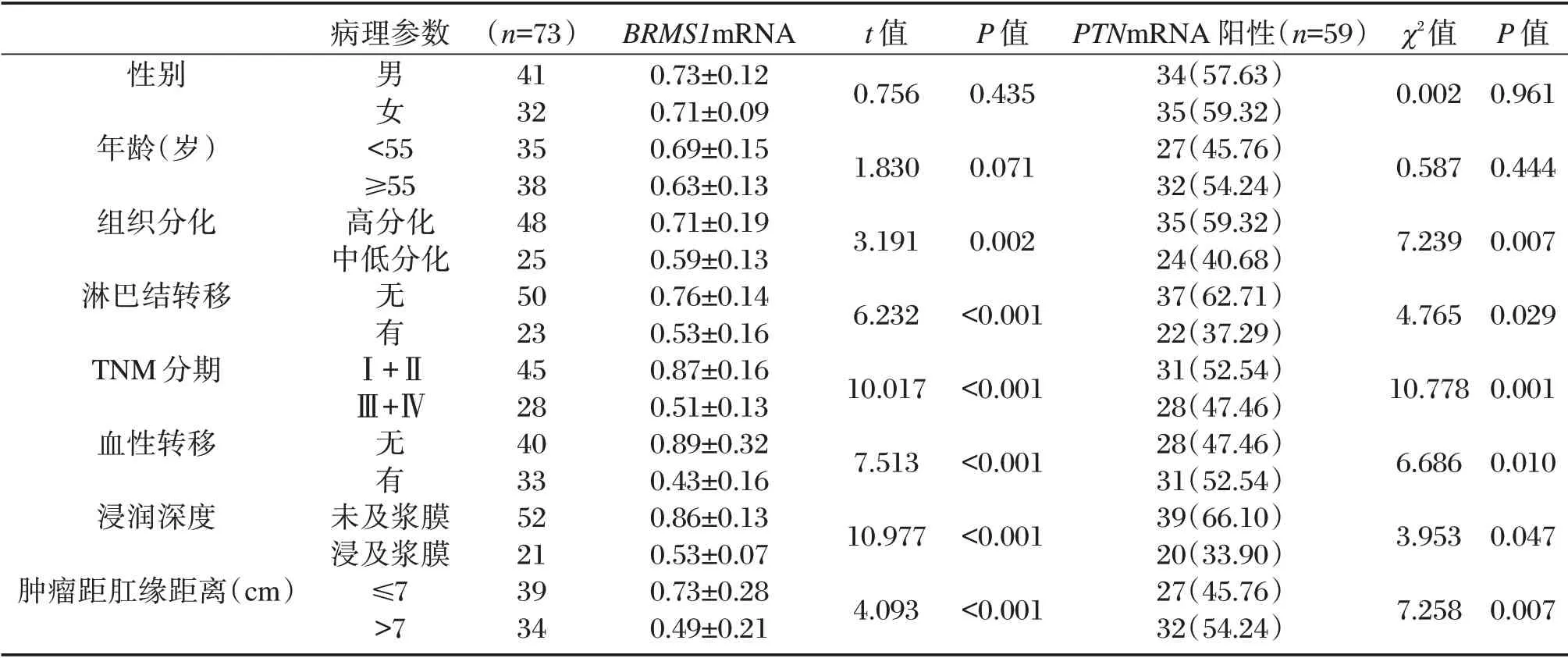
表2 BRMS1mRNA、PTNmRNA 与直肠癌患者不同病理参数的关系(±s)Table 2 Relationship between BRMS1mRNA,PTNmRNA and different pathological parameters in patients with rectal cancer(±s)
病理参数χ2值性别年龄(岁)组织分化淋巴结转移TNM 分期血性转移浸润深度肿瘤距肛缘距离(cm)男女<55≥55高分化中低分化无有Ⅰ+ⅡⅢ+Ⅳ无有未及浆膜浸及浆膜≤7>7(n=73)41 32 35 38 48 25 50 23 45 28 40 33 52 21 39 34 BRMS1mRNA 0.73±0.12 0.71±0.09 0.69±0.15 0.63±0.13 0.71±0.19 0.59±0.13 0.76±0.14 0.53±0.16 0.87±0.16 0.51±0.13 0.89±0.32 0.43±0.16 0.86±0.13 0.53±0.07 0.73±0.28 0.49±0.21 t 值0.756 1.830 3.191 6.232 10.017 7.513 10.977 4.093 P 值0.435 0.071 0.002<0.001<0.001<0.001<0.001<0.001 PTNmRNA 阳性(n=59)34(57.63)35(59.32)27(45.76)32(54.24)35(59.32)24(40.68)37(62.71)22(37.29)31(52.54)28(47.46)28(47.46)31(52.54)39(66.10)20(33.90)27(45.76)32(54.24)0.002 0.587 7.239 4.765 10.778 6.686 3.953 7.258 P 值0.961 0.444 0.007 0.029 0.001 0.010 0.047 0.007
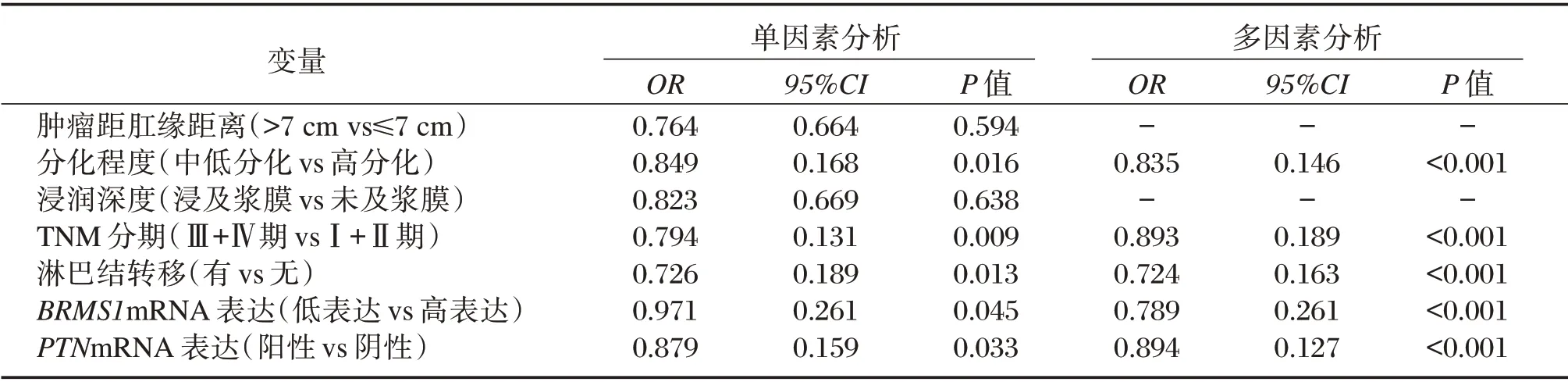
表3 影响直肠癌患者预后生存的单因素和多因素分析Table 3 Single factor and multiple factor analysis of prognostic survival in patients with rectal cancer
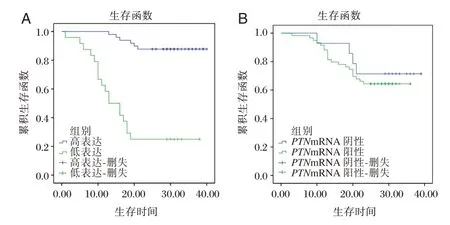
图1 BRMS1mRNA、PTNmRNA 表达与直肠癌患者预后生存的关系Figure 1 BRMS1mRNA and PTNmRNA expression and prognosis survival in patients with rectal cancer
3 讨论
直肠癌是临床多发的恶性肿瘤,近年来我国直肠癌发病率逐年上升,占肿瘤的死因亦顺位前移[7]。尽管目前直肠癌的外科手术已取得长足的进步,但术后复发转移及死亡的风险仍较高[8]。本组研究结果基本与既往研究相似,故寻求有效治疗靶点对降低直肠癌患者死亡率有重要意义。
肿瘤转移侵袭是导致患者死亡的重要原因,其过程包含肿瘤细胞的移行、扩散、浸润及在转移部位的繁殖等。在恶性肿瘤的转移过程中,转移抑制基因的作用十分关键[9]。BRMS1基因编码一种转移抑制因子,在多种类型的肿瘤转移中均有报道[10]。研究表明具有高度转移潜能的恶性肿瘤细胞,一般表现为BRMSI 表达降低成缺失,将BRMSl 转染到这些细胞中,可抑制其转移潜能。Sadat 等[11]发现BRMS1的表达与乳腺癌淋巴结转移呈负相关,表明BRMS1有抑制肿瘤转移的作用。Penglong 等[12]则发现BRMS1L 的过表达抑制了上皮性卵巢癌细胞的迁移和侵袭,认为其可作为BRMS1L 可作为上皮性卵巢癌患者预后的生物标志物和潜在的治疗靶点。虽然BMRS1基因的肿瘤转移抑制作用得到证实,但其作用机制仍不清楚。由于BMRS1 可使缝隙连接蛋白亚基Cx43 表达上调,恢复癌细胞与正常组织细胞间隙连接及信号传导,抑制癌细胞脱离原发灶而发生转移,故可推测BRMS1抑制直肠癌转移的机制可能与细胞间隙连接、信号传导有关[13]。本研究结果提示BRMS1L 参与直肠癌的转移与侵袭。结果证实BRMS1mRNA表达情况与直肠癌的恶化程度关系密切,可将其作为预测直肠癌癌患者预后的分子标志物之一。
PTN基因是已知的生长因子中最保守的基因之一,其与肿瘤发生和发展的关系得到多项研究的认证[14]。PTN基因作为一种原癌基因,属MDK 家族。体外培养发现,PTN可促进胚胎神经元的分化和神经突的生长,并可促进纤维细胞的肺裂增殖,故PTN也被称作轴突生长刺激因子[15]。本研究结果说明PTN与直肠癌的发生、转移和侵袭关系密切。与Wang 等[16]研究结果相似,进一步提示其可作为潜在的治疗靶点,进而提高患者生存时限。此外,本研究结果显示组织中低分化、浸及浆膜、TNM分期:Ⅲ+Ⅳ期、淋巴结转移为影响直肠癌患者预后生存的独立危险因素。因此,需加强对直肠癌的早期筛查、早期诊断、早期治疗,并重视对合并高危因素患者的预后评估,进一步提高治愈率。
综上所述,BRMS1mRNA、PTNmRNA 在直肠癌患者中呈异常状态,并与患者预后生存关系密切,可作为预测直肠癌患者预后生存的分子标志物和肿瘤治疗的潜在的靶点。本研究中存在一些不足之处在于纳入样本量较少,随访方式缺乏临床验证,未来可扩大样本量,加强随访真实性。
