小儿视网膜母细胞瘤VEGF、Cyclin D1及E-Cadherin表达及与组织病理特征的关系
2020-12-05汪岭马雪莲王启明
汪岭 马雪莲 王启明
视网膜母细胞瘤(retinoblastoma,RB)为儿童发病率较高的一类眼内恶性肿瘤,不仅对患儿视力造成严重影响,更危及患儿的生命安全[1]。肿瘤血管新生和细胞外基质降解为肿瘤浸润转移过程中的关键因素,血管内皮生长因子(vascular endothelial growth factor,VEGF)为已知的最强促血管形成因子之一,在恶性肿瘤发生发展中具有重要作用[2]。细胞周期调节蛋白D1(Cell cycle regulatory protein D1,Cyclin D1)参与了细胞周期G1/S 期转换,与多种肿瘤的发生发展密切相关[3]。上皮钙黏蛋白(Epithelial cadherin,E-Cadherin)阳性表达具有抑制肿瘤细胞侵袭转移的功能,并与多种肿瘤肿瘤浸润、临床分期及淋巴结转移密切相关[4]。目前,对于VEGF、Cyclin D1 及E-Cadherin 在RB 患儿中联合检测的研究尚不多见,RB 患儿肿瘤组织VEGF、Cyclin D1 及E-Cadherin 表达检测对于RB 患儿的诊断、评估和预后分析可能存在显著价值。故本研究对RB 患儿VEGF、Cyclin D1 及E-Cadherin 表达及与组织病理特征的关系进行了研究,具体如下。
1 资料与方法
1.1 一般资料
选取本院2017年1月至2019年1月收集的55例小儿RB 组织样本,纳入标准:①均为单眼发病;②均经病理学检查确诊;③均征得患儿家属同意并签署知情同意责任书。排除标准:①合并其他眼部疾病者;②临床资料缺失者;③依从性差及无法配合完成此研究者;④合并其他严重疾病者。患儿年龄为5 个月至8 岁,平均(2.8±0.6)岁,男30例,女25 例,左眼29 例,右眼25 例,分化35 例,未分化25 例;侵犯神经36 例,未侵犯神经24 例;临床分期眼内生长期7 例、眼内压增高期28 例、眼外转移期20 例;病理分期R0 期(肿瘤细胞不呈菊花团状排列)5 例、R1(仅少数肿瘤细胞呈菊花团状排列)期27 例、R2 期(多数肿瘤细胞呈菊花团状排列)23 例。并取55 例患儿瘤旁正常视网膜组织作为对照。本研究取得医学伦理委员会批准通过。
1.2 方法
1.2.1 临床病理特征统计
统计所有RB 组织对应患儿的性别、年龄、分化情况、临床分期、视神经侵犯程度、病理分期等资料。
1.2.2 免疫组织化学法染色
免疫组化染色法检测VEGF、Cyclin D1 及E-Cadherin 表达,取肿瘤组织及癌旁正常视网膜组织常规石蜡包埋,4 μm 连续切片,常规脱水,抗原修复。加入一抗和二抗,37℃孵育40 min。DAB 显色30 s,苏木精复染,封片显微镜下观察。VEGF、Cyclin D1 及E-Cadherin 染色结果表现为细胞质或细胞核中染色为棕黄色颗粒。结果判读[5]:阳性细胞数评分随机选取5 个高倍镜视野,视野内阳性细胞数百分比≤5%为阴性(-),6%~25%为弱阳性(+),26%~50%为阳性(++),>50%为强阳性(+++)。
1.3 统计学分析
采用SPSS 20.0 统计学软件进行数据分析,计数资料以n(%)表示,组间比较采用χ2检验;Spearman 检验分析各指标相关性,Cox 回归模型分析各指标与RB 患儿预后的关系。以P<0.05 为差异有统计学意义。
2 结果
2.1 正常视网膜组织与RB 组织VEGF、Cyclin D1及E-Cadherin 表达情况比较
免疫组化染色结果显示,RB组织中VEGF、Cyclin D1 表达阳性率均显著高于正常视网膜组织(高表达),E-Cadherin 表达显著低于正常视网膜组织(低表达),差异有统计学意义(P<0.05)。见图1和表1。

图1 RB 组织VEGF、Cyclin D1 及E-Cadherin 表达免疫组化染色(SP,×200)Figure 1 Immunohistochemical staining of VEGF,Cyclin D1 and E-Cadherin expression in RB tissue(SP,×200)
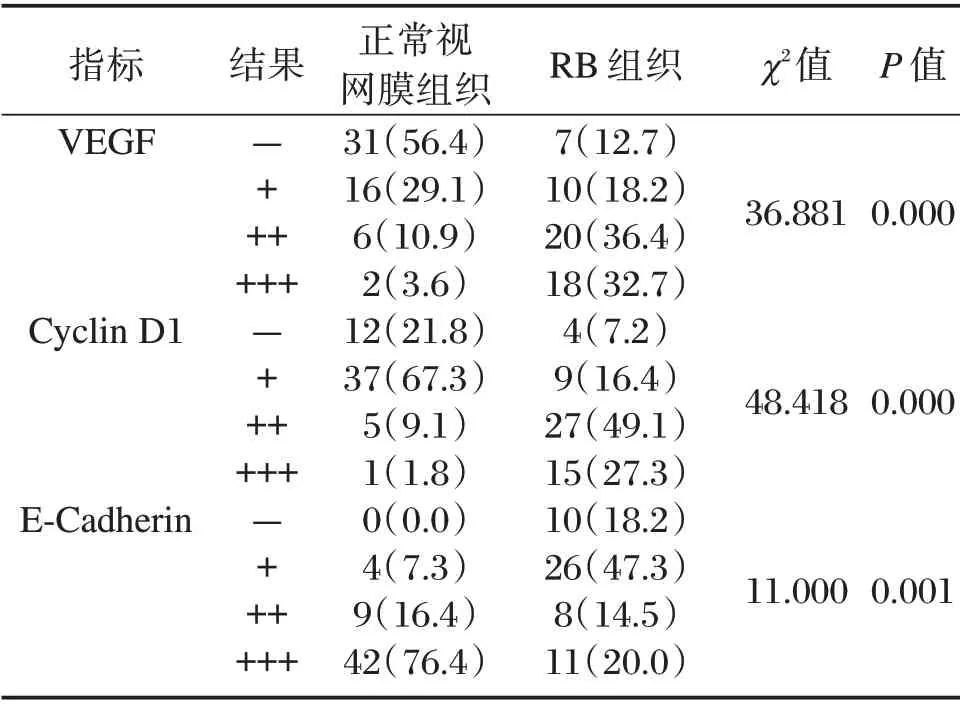
表1 正常视网膜组织与RB 组织VEGF、Cyclin D1 及E-Cadherin 表达情况比较[n(%)]Table 1 Comparison of VEGF,Cyclin D1 and E-Cadherin expression between normal retinal tissue and RB tissue[n(%)]
2.2 RB 组织VEGF、Cyclin D1 及E-Cadherin 表达相关性分析
VEGF、Cyclin D1 之间存在正相关性,差异有统计学意义(P<0.05),VEGF、Cyclin D1 均与E-Cadherin 之间存在负相关性,差异有统计学意义(P<0.05)。见表2。
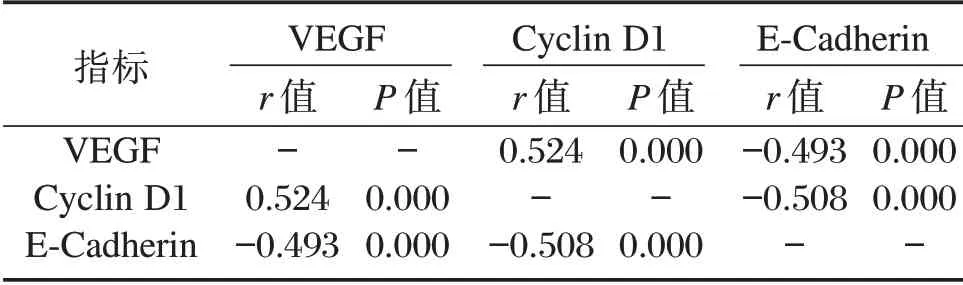
表2 RB 组织VEGF、Cyclin D1 及E-Cadherin 表达相关性分析Table 2 Correlation analysis of VEGF,Cyclin D1 and E-Cadherin expression in RB tissue
2.3 RB 患儿VEGF、Cyclin D1 及E-Cadherin 表达与组织病理特征的关系
RB 患儿不同性别、年龄、眼别VEGF、Cyclin D1 及E-Cadherin 表达阳性率比较,差异无统计学意义(P>0.05);不同分化情况、临床分期、病理分期、视神经侵犯程度RB 患儿VEGF、Cyclin D1 及E-Cadherin 表达阳性率比较,差异有统计学意义(P<0.05)。见表3。
2.4 Cox 回归多因素生存分析
临床分期越高、神经侵犯程度越高、VEGF、Cyclin D1 阳性高表达及E-Cadherin 低表达阳性为影响患者生存的不良因素(P<0.05)。见表4。
3 讨论
RB 具有生长速度快、恶性程度高的特点,主要来源于光感受器前体细胞,多具有一定的家族遗传倾向,容易发生颅内及远处转移,危及患儿生命[6]。视网膜母细胞瘤多表现为结膜内水肿、充血、角膜水肿、玻璃体混浊、虹膜新生血管、眼压升高及斜视等,但其具体的机制目前尚未完全明确[7]。研究认为[8],原癌基因和抑癌基因表达平衡失调及转录调控异常为肿瘤发生、发展的分子机制。
本研究结果提示VEGF、Cyclin D1 及E-Cadherin 在RB 病理进程中具有重要作用。视网膜母细胞瘤与多数实体瘤一样,肿瘤发生发展需要通过血管、淋巴管向远处转移,也需要新生血管形成二维肿瘤组织提供充足的营养物质。VEGF 为强促血管生成因子,也是肿瘤血管新生的主要促进因子,是多种实体瘤发生发展的关键因子[9]。Cyclin D1 为反映细胞周期变化的蛋白,为细胞周期的正向调控因子,Cyclin D1 表达异常上调可导致组织细胞无序性生长增加,从而导致肿瘤的发生。近年来,对于Cyclin D1 在肿瘤发生发展中的作用受到广泛重视,在多种恶性肿瘤组织中都检测到Cyclin D1 的过度表达[10]。本研究中,在RB 组织中Cyclin D1 表达相较于癌旁正常视网膜组织表达阳性率明显升高。研究表明,Cyclin D1 在食管癌、前列腺癌等疾病过程中发挥重要作用,并与分化程度、组织学类型等密切相关[11-12]。
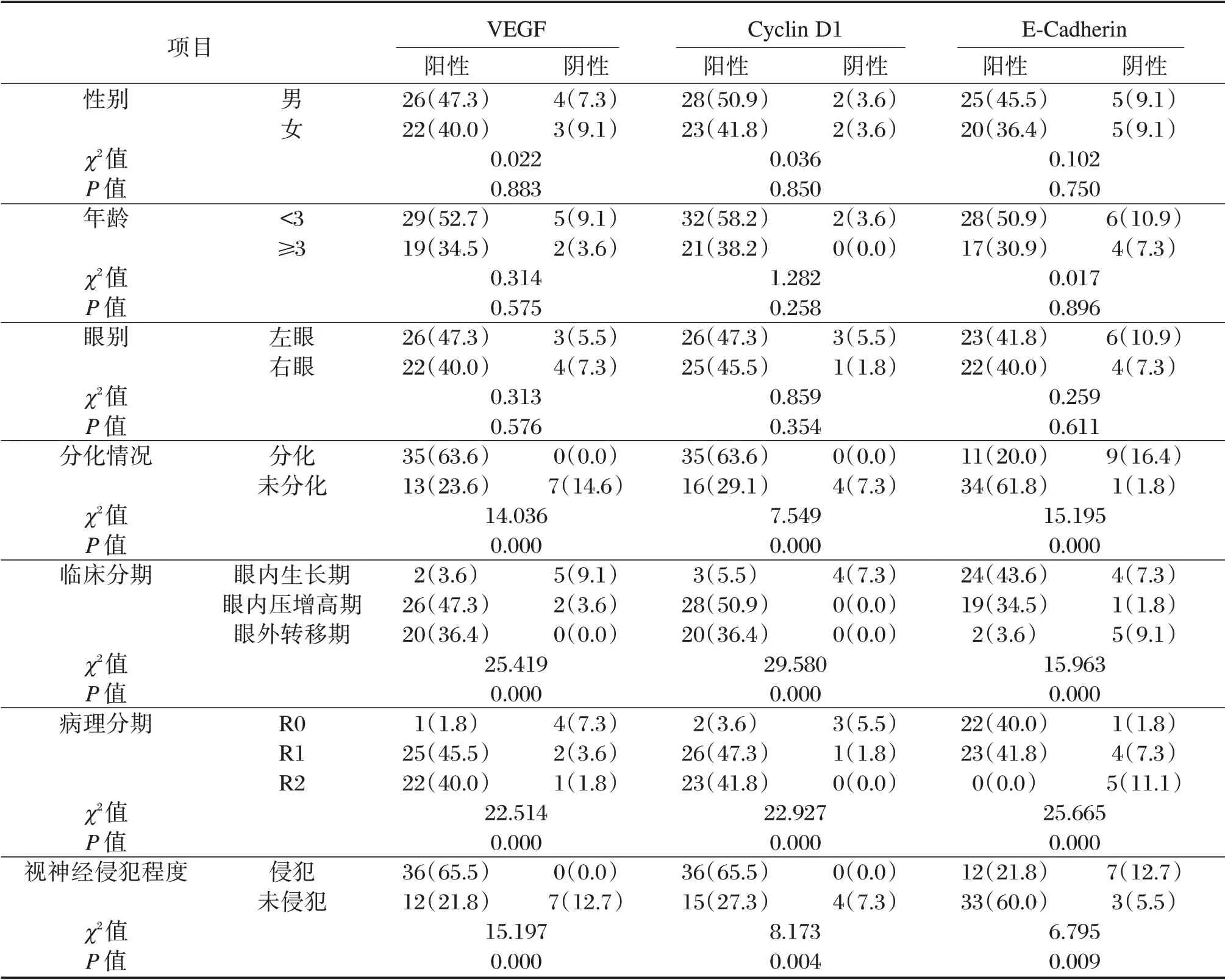
表3 RB 患儿VEGF、Cyclin D1 及E-Cadherin 表达与组织病理特征的关系[n(%)]Table 3 The relationship between the expression of VEGF,Cyclin D1 and E-Cadherin and histopathological characteristics in children with RB[n(%)]

表4 Cox 回归多因素生存分析Table 4 Cox regression multivariate survival analysis
E-Cadherin 为膜整合糖蛋白家族的一类,为钙离子依赖性正常细胞-细胞黏附的主要介质。研究证实[13-14],E-Cadherin 低表达可促进癌细胞侵袭、分化和转移,是机体重要的抗肿瘤侵袭分子之一。另有研究指出[15],E-Cadherin 表达水平与宫颈癌的侵犯血管、病理分期等密切相关,E-Cadherin表达越低,肿瘤侵袭更深,远处转移更广。本研究结果显示,VEGF、Cyclin D1 之间存在正相关性,VEGF、Cyclin D1 分别与E-Cadherin 存在负相关性,但其具体机制仍有待进一步研究。本研究推测:RB 恶性程度越高,肿瘤新生血管也更加丰富,其生长也更加迅速,诱导新生血管形成的能力提高,促使VEGF 和Cyclin D1 升高,随着肿瘤发展,机体抗肿瘤能力逐渐降低,E-Cadherin 表达也随之降低。这提示VEGF、Cyclin D1 表达越高及E-Cadherin 表达越低,RB 患儿预后越差;VEGF、Cyclin D1 及E-Cadherin 可作为RB 患儿预后评估的有效监测指标。在接下来的研究中,本研究将着重针对VEGF、Cyclin D1 及E-Cadherin 影响RB 发生发展及三指标之间存在的相互关系的分子生物学机制进行研究,以为RB患儿的临床诊疗和预后评估提供参考。
综上所述,VEGF、Cyclin D1 阳性表达越高、E-Cadherin 阳性表达越低,小儿RB 肿瘤恶性程度越高、预后越差,检测VEGF、Cyclin D1 及E-Cadherin 表达有助于RB 患儿病情评估。
