新型冠状病毒肺炎患者早期外周血实验室检查结果分析
2020-12-04华中科技大学同济医学院附属同济医院检验科武汉430030
白 欢,沈 玲,袁 旭,王 旭,唐 宁(华中科技大学同济医学院附属同济医院检验科,武汉 430030)
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)自2019年12月于湖北武汉暴发起,截至2020年6月13日24时,累计已造成中国83 132人确诊感染,4 634人死亡[1],当前国内疫情虽趋平稳,但国际形势愈发严峻,至今全球累计已有确诊感染报道病例超755万,死亡病例超42万[2],且感染及死亡数字仍在不断攀升,境外输入风险持续增加,加之国内无症状感染者的不断出现,亦成为潜在的传染源,具有一定的传播风险[3],“外防输入、内防反弹”责任重大,丝毫不可掉以轻心。
新型冠状病毒(SARS-CoV-2)核酸及血清学抗体检查,是确诊COVID-19的主要检查手段[4],然而受限于SARS-CoV-2核酸检测假阴性率较高及血清学抗体的产生存在固有时间窗口期[5-6],对于SARS-CoV-2感染早期疾病排查仍存在一定的局限性,加之部分医疗机构,尤其是基层医疗机构并不具备核酸及抗体检测能力,标本外送所带来的时间延误亦会造成疫情传播蔓延的潜在可能,寻找病程早期敏感的血液学指标仍具有十分重要的意义。基于此,我们的研究纳入最常规的31项外周血实验室检查指标,以期为COVID-19患者早期识别及临床诊疗提供参考,现将研究结果报道如下。
1 材料与方法
1.1 研究对象 选取2020年1月11日~2月18日所有在华中科技大学同济医学院附属同济医院发热门诊就诊且SARS-CoV-2核酸检测阳性的626例患者为研究组,其中男性315例,女性311例,年龄15~95岁,中位年龄54岁,所有入选病例参照《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》标准[4]最终明确诊断为新型冠状病毒肺炎;另选取同期就诊发热门诊且SARS-CoV-2核酸检测连续两次或两次以上阴性的254例疑似患者为对照组,其中男性123例,女性131例,年龄14~83岁,中位年龄49岁。所有纳入对照组的病例必须满足:①SARS-CoV-2核酸检测连续两次或两次以上为阴性(采样时间至少间隔1天);②整个就诊病程中无核酸阳性记录;③未入住我院发热病房。研究组与对照组病例排除标准包括血液系统疾病、严重肝肾功能不全、透析、恶性实体瘤化疗或术后、妊娠等。
1.2 仪器与试剂 白细胞(white blood cell,WBC)、中性粒细胞(neutrophil,NEUT)、淋巴细胞(lymphocyte,LYMPH)、单核细胞(monocyte,MON)、红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)采用Sysmex XN-9000血细胞分析仪及其配套检测试剂;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总蛋白(total protein,TP)、清蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(γ-glutamyltransferase,γ-GGT)、总胆固醇(total cholesterol,TCHOL)、乳酸脱氢酶(lactic dehydrogenase,LDH)、胆碱酯酶(cholinesterase,CHE)、总胆汁酸(total bile acid,TBA)、尿素(urea,Urea)、肌酐(creatinine,Cr)、尿酸(uric acid,UA)、碳酸氢根(bicarbonate radical,HCO3)、血清钾(serum potassium,K)、血清钠(serum sodium,-Na)、血清氯(serum chlorine,Cl)、血清钙(serum calcium,Ca)和超敏C反应蛋白(high-sensitivity C-reactive protein,hsCRP)采用Roche Cobas8000全自动生化分析仪,hsCRP检测试剂盒来自日本电化生研株式会社,TBA检测试剂盒来自北京豪迈生物工程有限公司,其余项目检测试剂盒为Roche配套检测试剂盒;降钙素原(procalcitonin,PCT)采用Roche Cobas602电化学发光免疫分析仪及其配套检测试剂盒。另球蛋白(globulin,GLB)、间接胆红素(indirect bilirubin,IBIL)非测量项目,为换算项目。
1.3 研究方法 采用回顾性分析方法,纳入血常规、生化常规、炎症标志物等31项血液学指标,选取研究组与对照组就诊发热门诊的首次检查结果纳入研究,分析比较两组病例以上31项血液学指标的差异。
1.4 统计学分析 采用SPSS 23.0统计软件进行数据处理。Kolmogorov-Smirnov法对数据进行正态性检验,正态分布的计量资料以均数±标准差(±s)表示;偏态分布的计量资料以 M(P25,P75)表示。正态分布且方差齐性的数据间比较用独立样本t检验,偏态分布数据间比较用Mann-WhitneyU-test检验,两组数据构成比的比较用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 研究组与对照组年龄、性别及血细胞检测结果比较 见表1。研究组与对照组比较,年龄和年龄段分布差异有统计学意义(P<0.001),性别间差异无统计学意义(P<0.05)。与对照组相比,研究组WBC,LYMPH,PLT均显著降低,差异有统计学意义(U=72 655,62 369.5,63 573,均P<0.05),且在结果分布上,研究组WBC多正常或降低,WBC正常者占比85.3%,降低者占比9.4%,另LYMPH降低者占比43.1%,PLT降低者占比12.8%,与对照组相比差异亦有统计学意义(χ2=12.792,9.523,11.222,均P<0.01)。而Hb,RBC,NEUT,MON两组比较差异均无统计学意义(U=77 298~79 226,均P>0.05)。
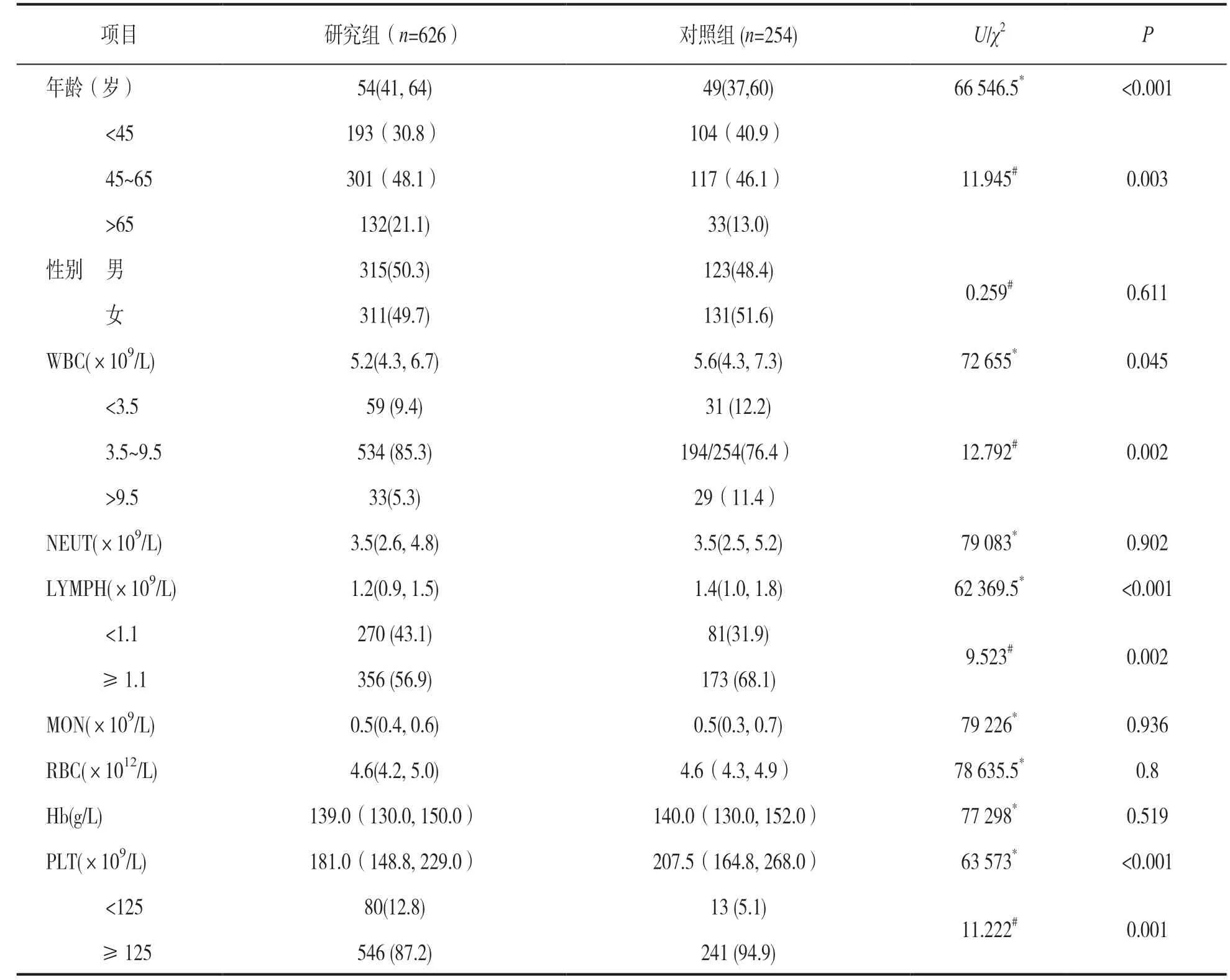
表1 研究组与对照组血细胞分析结果比较[M(P25,P75),n(%)]
2.2 研究组与对照组生化常规结果比较 见表2。研究组Ca显著低于对照组,差异有统计学意义(t=2.944,P=0.004),且在结果分布上,研究组Ca降低者占比达61.8%,而对照组Ca降低者占比仅为31.3%,两者相比差异有统计学意义(χ2=7.562,P=0.006);余21项生化常规指标(Cl,Na,K,HCO3,Urea,UA,Cr,TBA,CHE,ALB,ALT,ALP,LDH,TP,DBIL,GLB,IBIL,TBIL,γ-GGT,TCHOL,AST)两组比较差异均无统计学意义(均P>0.05)。
2.3 研究组与对照组炎症标志物结果比较 见表2。研究组hsCRP较对照组显著升高,差异有统计学意义(U=37 014.5,P<0.001),且在结果分布上,研究组hsCRP重度升高(>10mg/L)占比达66.2%,而对照组hsCRP重度升高占比为47.9%,两者相比差异亦有统计学意义(χ2=36.316,P<0.001);而PCT在两组病例间比较差异无统计学意义(U=4 438.5,χ2=5.380,均P>0.05)。
3 讨论
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由严重急性呼吸道综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的肺炎,部分患者肺部病变进展较快,可出现严重急性呼吸综合征(severe acute respiratory syndrome,SARS)表现。重症患者救治效果差,救治难度大[7]。当前国内疫情虽得到有效控制,然而国际形势不容乐观,境外输入风险持续增加,加之国内无症状感染者不断出现,亦成为潜在的传染源,具有一定的传播风险[3],“外防输入、内防反弹”任务艰巨,仍不可丝毫放松。考虑SARS-CoV-2核酸及抗体检测固有的局限[5-6],寻找疾病早期敏感的实验室指标仍具有重要意义,基于此,我们的研究从最常规的血液学指标入手,以期为COVID-19患者早期识别及临床诊疗提供参考。
COVID-19患者早期白细胞正常或降低,淋巴细胞降低,既往已有大量文献报道证实[8-10],并将此写入最新的《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[4],本研究中94.7%的COVID-19患者表现为白细胞正常或降低,另有43.1%的COVID-19患者淋巴细胞减少,与对照组相比存在显著性差异,提示临床诊疗中对疾病早期的识别需特别关注白细胞和淋巴细胞的水平。血小板是反映机体凝血状况的重要指标,在炎症过程中往往存在反应性升高,但在本研究中我们发现,COVID-19患者PLT计数显著低于对照组,且血小板减少病例数占比(12.8%)亦显著高于对照组(5.1%),提示COVID-19患者病程早期可能已存在凝血激活、血小板消耗,以及SARS-CoV-2在感染早期可能已侵袭骨髓,抑制了骨髓的正常生板,致使血小板减少。
表2 研究组与对照组生化常规结果比较[M(P25,P75),n(%),±s]
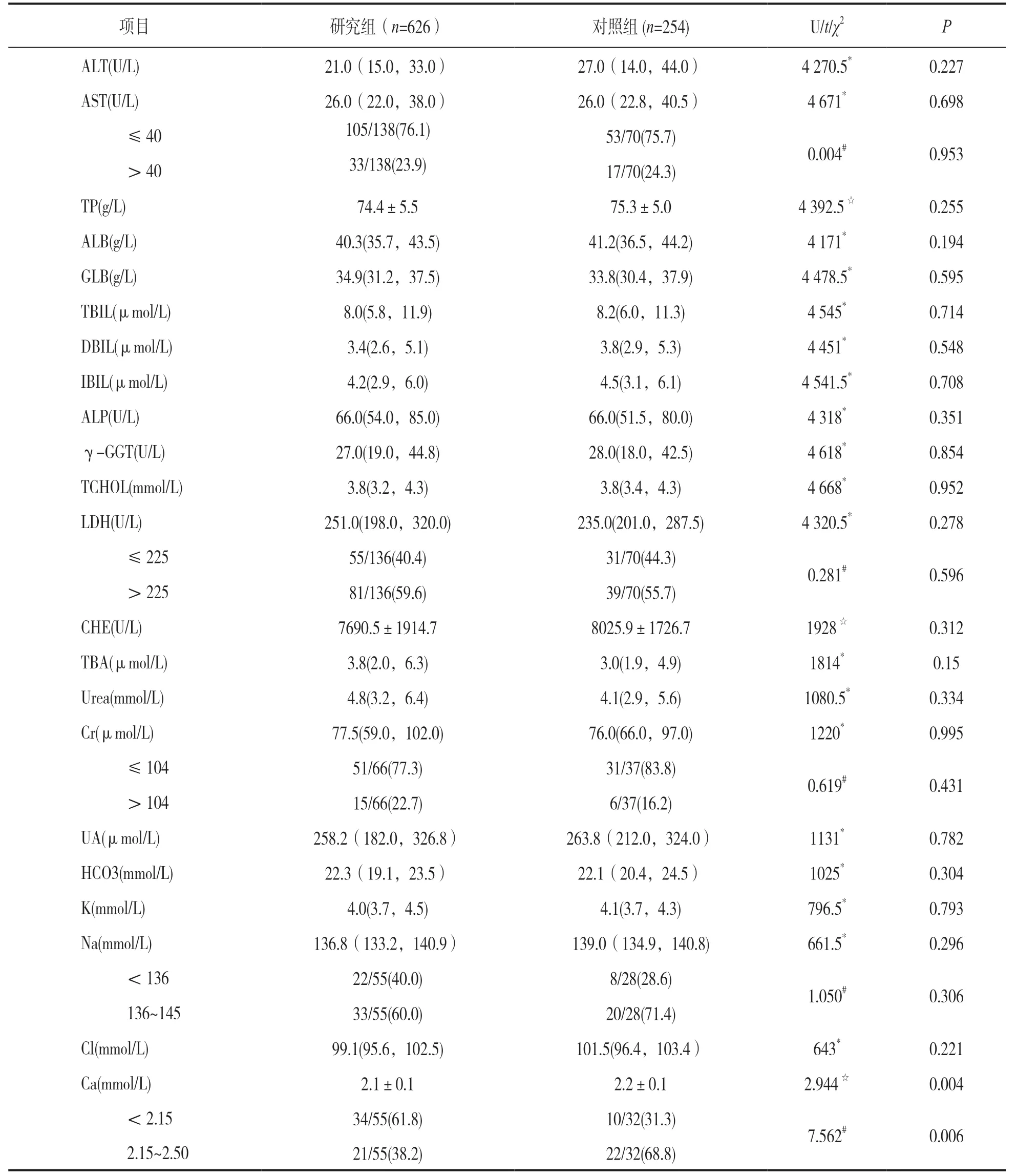
表2 研究组与对照组生化常规结果比较[M(P25,P75),n(%),±s]
注:*表示Mann-Whitney U-test检验的U值,☆表示独立样本t检验的t值,#表示卡方检验的χ2值。
项目 研究组(n=626) 对照组(n=254) U/t/χ2P ALT(U/L) 21.0(15.0,33.0) 27.0(14.0,44.0) 4 270.5*0.227 AST(U/L) 26.0(22.0,38.0) 26.0(22.8,40.5) 4 671*0.698 ≤40 105/138(76.1) 53/70(75.7)0.004#0.953 >40 33/138(23.9) 17/70(24.3)TP(g/L) 74.4±5.5 75.3±5.0 4 392.5☆0.255 ALB(g/L) 40.3(35.7,43.5) 41.2(36.5,44.2) 4 171*0.194 GLB(g/L) 34.9(31.2,37.5) 33.8(30.4,37.9) 4 478.5*0.595 TBIL(μmol/L) 8.0(5.8,11.9) 8.2(6.0,11.3) 4 545*0.714 DBIL(μmol/L) 3.4(2.6,5.1) 3.8(2.9,5.3) 4 451*0.548 IBIL(μmol/L) 4.2(2.9,6.0) 4.5(3.1,6.1) 4 541.5*0.708 ALP(U/L) 66.0(54.0,85.0) 66.0(51.5,80.0) 4 318*0.351 γ-GGT(U/L) 27.0(19.0,44.8) 28.0(18.0,42.5) 4 618*0.854 TCHOL(mmol/L) 3.8(3.2,4.3) 3.8(3.4,4.3) 4 668*0.952 LDH(U/L) 251.0(198.0,320.0) 235.0(201.0,287.5) 4 320.5*0.278 ≤225 55/136(40.4) 31/70(44.3)0.281#0.596 >225 81/136(59.6) 39/70(55.7)CHE(U/L) 7690.5±1914.7 8025.9±1726.7 1928☆0.312 TBA(μmol/L) 3.8(2.0,6.3) 3.0(1.9,4.9) 1814*0.15 Urea(mmol/L) 4.8(3.2,6.4) 4.1(2.9,5.6) 1080.5*0.334 Cr(μmol/L) 77.5(59.0,102.0) 76.0(66.0,97.0) 1220*0.995 ≤104 51/66(77.3) 31/37(83.8)0.619#0.431 >104 15/66(22.7) 6/37(16.2)UA(μmol/L) 258.2(182.0,326.8) 263.8(212.0,324.0) 1131*0.782 HCO3(mmol/L) 22.3(19.1,23.5) 22.1(20.4,24.5) 1025*0.304 K(mmol/L) 4.0(3.7,4.5) 4.1(3.7,4.3) 796.5*0.793 Na(mmol/L) 136.8(133.2,140.9) 139.0(134.9,140.8) 661.5*0.296 <136 22/55(40.0) 8/28(28.6)1.050#0.306 136~145 33/55(60.0) 20/28(71.4)Cl(mmol/L) 99.1(95.6,102.5) 101.5(96.4,103.4) 643*0.221 Ca(mmol/L) 2.1±0.1 2.2±0.1 2.944☆0.004 <2.15 34/55(61.8) 10/32(31.3)7.562#0.006 2.15~2.50 21/55(38.2) 22/32(68.8)
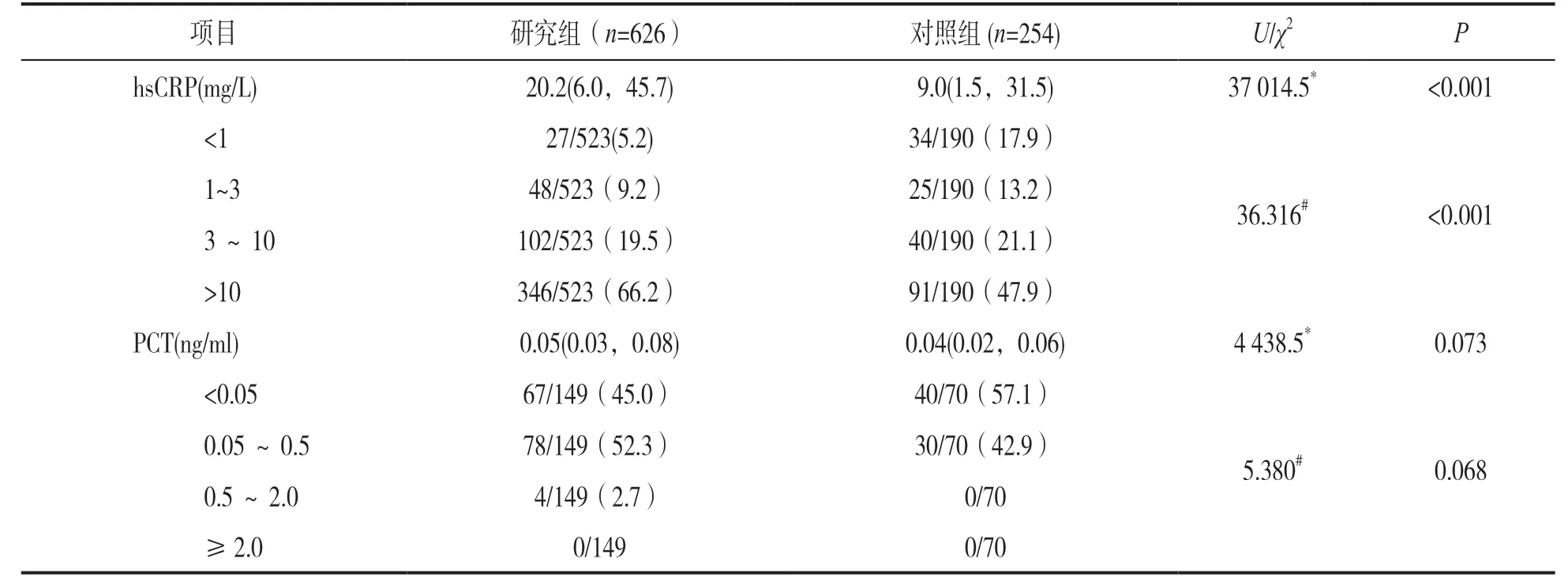
表3 研究组与对照组炎症标志物结果比较[M(P25,P75),n(%)]
血钙水平在COVID-19的既往研究中鲜有报道,我们研究发现COVID-19病程早期即普遍存在低钙血症,研究组中低钙血症的病例数占比高达61.8%,而对照组低钙血症病例数占比仅为31.3%,两组数据间比较差异有统计学意义(P<0.01),这在我们的认识里属于首次研究报道。值得关注的是,COVID-19病程进展至重症阶段时普遍存在呼吸系统功能障碍,若氧合指数≤300mmHg,即可在序贯器官衰竭(SOFA)评分中积2分以上,加上患者本身确定为SARS-CoV-2感染,这已满足脓毒症3.0的定义[11],因此大量的重症COVID-19患者符合脓毒症的诊断。既往已有大量关于脓毒症与低钙血症的研究报道[12-14],证实在脓毒症患者中普遍存在低钙血症,且低钙血症与脓毒症患者预后相关,脓毒症患者发生低钙血症时病死率更高。但脓毒症时血钙降低的具体机制尚未完全阐明,可能原因为病原菌感染时,侵袭损伤细胞膜,导致细胞膜对钙离子的通透性增加,胞外钙内流,并且三磷酸腺苷(ATP)合成降低,供能减少,钙泵活性减低,胞内钙蓄积,从而导致血钙降低。COVID-19患者在病程早期已表现出显著的低钙血症,与COVID-19患者预后是否相关尚需后续的研究证实,但在本研究中,关注COVID-19患者早期的低钙血症可能对SARS-CoV-2感染的早期识别有益。
hsCRP是机体受到微生物入侵或组织损伤等炎症性刺激时在白细胞介素-6(IL-6)诱导下由肝细胞合成的急性时相反应蛋白,是急性炎症的非特异性敏感标志物[15]。本研究中hsCRP在COVID-19研究组与对照组中有良好的区分作用,COVID-19研究组hsCRP显著升高,其中66.2%的病例hsCRP超过10mg/L,提示SARS-CoV-2感染早期,机体即存在显著的炎症反应,而病程进展至后期的“炎症因子风暴”可能是部分患者病情突然加重,并死于多器官功能衰竭的主要原因[16]。
值得强调的是,COVID-19是一种传染性极强的呼吸道疾病,主要攻击的靶器官为人体的肺部[7,17]。另在我们的研究中发现,COVID-19病程早期已有相当一部分病人出现肝肾功能不全,表现为ALT,AST,LDH和Cr等指标异常,提示SARSCoV-2在感染早期可能已侵袭人体肝、肾,造成肝肾脏器的损伤,现已有相关的研究报道[18-19]证实其可能性,另存在很大一部分COVID-19患者在感染早期已存在明显电解质紊乱,除上述讨论的61.8%的患者血钙降低外,另有40%的患者出现低钠血症。
本研究的局限之处在于,由于SARS-CoV-2核酸检测受检测试剂盒质量、取材、病毒感染部位等诸多因素影响,假阴性率较高[5,20],对照组尽管纳入的病例为核酸检测两次或两次以上阴性的病例,但仍不能完全排除SARS-CoV-2感染。另外本研究为单中心回顾性研究,纳入病例可能存在选择性偏倚,仍需后续设计更为严谨的前瞻性研究进一步验证。
综上所述,COVID-19传染性强,疾病进展快,病程早期绝大多数患者表现为白细胞计数正常或减低,血钙降低,hsCRP显著升高,部分患者淋巴细胞、血小板减少,并出现肝肾功能不全、电解质紊乱,病程早期密切关注以上血液学指标特征,有助于对疑似患者的早期识别,从而减少疫情的蔓延与扩散。
