HMMR-AS1在子宫内膜癌化疗耐药中的作用
2020-12-04席稳燕
王 娟,刘 鑫,席稳燕
(1.西安大兴医院妇产科,西安 710016;2西安交通大学第二附属医院妇科,西安710004)
子宫内膜癌(endometrial cancer,EC)是我国妇女常见的恶性肿瘤[1-3]。子宫内膜癌的发病率及其病死率均居高不下,且因为人口老龄化等因素,子宫内膜癌的发病率仍有进一步上升的危险[4]。子宫内膜癌目前的治疗手段主要为手术切除癌组织,辅以化疗和放疗[5]。手术切除术的缺点主要为复发率及远处转移率较高,辅助化疗和放疗虽能降低复发和远端转移的风险,但仍有相当部分患者因化疗耐药而出现复发和转移的情况[6-7],因此,对子宫内膜癌化疗耐药的机制进行研究对子宫内膜癌患者具有较大的现实意义。长链非编码RNA(long non coding RNAs,lncRNAs)作为新兴的研究热点,被发现在肿瘤耐药中发挥重要调节作用,如SHEN等[8]研究发现,浆细胞瘤多样异位基因1(plasmacytoma variant translocation gene 1,PVT1)在表观遗传学上沉默miR-195,并调节肿瘤细胞上皮细胞-间光质转化(EMT)导致宫颈癌细胞化疗耐药;王栋等[9]研究发现,肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)在结直肠癌中高表达,且其高表达能够介导结直肠癌患者化疗耐药。HMMR-AS1最早被发现在乳腺癌中高表达,且其高表达与HMMR呈正相关[10]。目前尚未发现其在子宫内膜癌中所起作用的报道。
1 材料与方法
1.1 研究对象 本研究收集了西安大兴医院2012年1月~2016年12月手术切除的80例子宫内膜癌肿瘤组织及其配对正常组织。本研究经西安大兴医院伦理委员会批准,以上所有子宫内膜癌患者手术前均未接受任何放疗和化疗治疗及激素治疗,且所有患者均无其他肿瘤,相互之间不存在亲缘关系。所有组织均为手术切除后30min内浸泡于RNAlater液中,24h后置于液氮中保存。
1.2 仪器与试剂 PCR仪器使用ABI公司7500型PCR仪(美国),PCR master Mix使用ABI公司配套试剂(美国),引物由上海生工合成(中国上海),Ishikawa细胞系购买于上海斯信生物公司(中国),慢病毒载体由Genecopoia公司合成(美国),CCK8试剂、5-FU,顺铂由肖鹏生物公司购买(中国)。
1.3 方法
1.3.1 RNA提取及实时荧光定量PCR:使用trizol法提取组织中的总RNA,使用TAKARA反转录试剂将提取的RNA反转录成cDNA模板备用。使用ABI公司7500型PCR仪进行实时荧光定量PCR实验。反应体系严格按照ABI公司提供的说明书配置。各基因PCR引物为:DNAJC3-AS1上游引物为:5’-AGCGATTGTGGAAGACCCTG-3’;下游引物为:5’-ATTTCCCCTGGTAAGCGCAA-3’;DNAJC3上 游引物为:5’-GCCACACACCTTTCCTCCTC-3’,下游引物为:5’-GCAGATCCACCAGGACTAGC-3’; 使用ACTB作为内参,上游引物为:5’-GGCGGC ACCACCATGTACCCT-3’,下游引物为:5’-AGGGGCCGGACTCGTCATACT-3’。反应程序为:94℃预变性10min;94℃10s,65℃1min;共计40个循环。实验结果采用2-ΔΔCt法进行分析,实验结果使用该基因在肿瘤组织中表达量的中位数作为临界值,大于等于中位数的为高表达,反之为低表达。
1.3.2 细胞培养:本实验所用人子宫内膜癌细胞系(Ishikawa)购于上海斯信生物公司,本实验细胞培养使用含10m1/dl胎牛血清的DMEM培养基,细胞培养条件为37℃,5ml/dl CO2,饱和湿度。待细胞汇合度达80%左右时使用胰蛋白酶消化传代细胞。
1.3.3 细胞转染:本研究采用慢病毒稳定转染包装系统进行过表达和干扰实验,所用载体分别为PEZ-LV201和psi-LVRH1GH。实验过程中,通过荧光检测及实时荧光定量PCR进行确认,两项均显示转染成功后使用该细胞进行后续实验。以上两种载体均为嘌呤霉素抗性载体。本研究拟通过过表达及干扰HMMR-AS1在子宫内膜癌细胞中表达后检测细胞耐药等能力的改变情况,检测其对常见化疗药物敏感性的变化趋势。转染所用试剂为Lipofectamine 2000(Invitrogen,美国),操作步骤严格按照Invitrogen公司说明书进行,转染后继续常规培养48h后,收集对数生长期细胞用于后续实验检测。
1.3.4 CCK-8实验:取转染后处于对数生长期子宫内膜癌细胞用于此实验。实验中,取胰蛋白酶消化重悬后的子宫内膜癌细胞计数,接种于96孔培养板中,每孔接种200个细胞,每组设置5个平行孔;接种5个96孔板用于不同时间点(0,24,48,72和96h)加入CCK-8试剂后在450nm波长下检测其吸光度值,吸光度值愈高则表示孔内细胞越多。
1.3.5 化疗敏感性实验:取转染后处于对数生长期的子宫内膜癌细胞用于此项实验。本实验采用加入化疗药物后检测各组子宫内膜癌细胞生长抑制情况差异来分析HMMR-AS1不同表达水平下对化疗药物敏感性的差异。实验中,取胰蛋白酶消化重悬后的子宫内膜癌细胞计数,接种于96孔培养板中,每孔接种2×104个细胞,每组设置5个平行孔;按对数浓度梯度设置化疗药物(5-FU,顺铂)的浓度地图加药,常规培养24h后PBS清洗96孔培养板,加入含20g/dl CCK-8试剂的培养基,2h后在450nm波长下检测其吸光度值,吸光度值愈高则表示孔内细胞越多。
1.3.6 Western blot实验:取转染后处于对数生长期细胞用于此实验。本实验所用一抗(ab124729)及二抗(ab205718)均购买自ABcam公司,实验过程中,一抗稀释倍数为2 000倍,二抗稀释倍数为1 000倍。实验过程为典型的Western blot实验过程,具体步骤参见文献[11]。
1.4 统计学分析 采用配对t检验分析癌组织和对应癌旁正常组织中lncRNA表达水平的差异,采用卡方检验和独立样本t检验分析不同宫颈癌患者临床特征及疾病进展中lncRNA表达水平的差异,采用K-M法绘制生存曲线,用log-rank检验不同组患者生存时间之间的差异。采用重复测量的方差分析方法分析细胞增殖能力的差异(CCK-8实验及化疗药物敏感性实验)。统计过程使用实验SPSS18.0软件运行,所有检验均为双侧检验,α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 HMMR-AS1在子宫内膜癌中高表达 见图1。经实时荧光定量PCR实验检测所有80对宫颈癌-癌旁正常组织,癌组织中的表达量显著高于对应癌旁正常组织,平均达7.24倍(P<0.01)。

图1 HMMR-AS1在子宫内膜癌中高表达
2.2 HMMR在子宫内膜癌中高表达 经实时荧光定量PCR实验检测80对宫颈癌-癌旁正常组织,癌组织中的表达量显著高于对应癌旁正常组织,平均达2.50倍,见图2A(P<0.01)。经分析发现HMMR-AS1表达量与HMMR表达呈正相关,见图2B(r2=0.763 5,P<0.01)。
2.3 转染实验 见图3。通过荧光显微镜初步确认转染成功后,收集转染细胞提取总RNA,反转录后使用实时荧光定量PCR实验确认转染是否成功。图A为荧光照片,B,C为qPCR实验结果,其中过表达平均为对照组的8.63倍,干扰后表达为对照组的0.07倍。
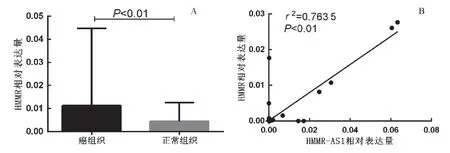
图2 HMMR在子宫内膜癌中高表达
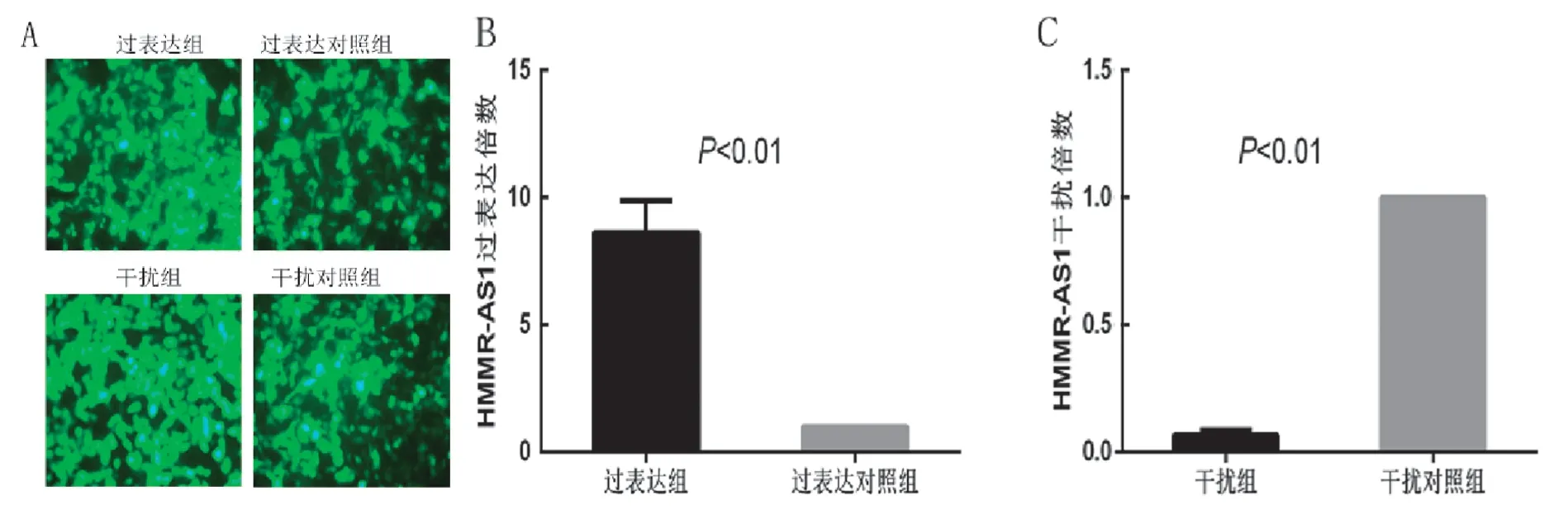
图3 转染实验的验证
2.4 过表达HMMR-AS1促进细胞增殖 通过CCK-8实验检测过表达组与对照组细胞、干扰组及对照组细胞增殖情况,结果显示,第2~4天,过表达组子宫内膜癌细胞在450nm下的吸光度值显著高于对照组,见图4A。经t检验,二者差异具有统计学意义(P<0.01)。通过干扰HMMR-AS1表达后检测其对子宫内膜癌细胞系增殖能力的影响,发现24h后即可观察到两组细胞增殖能力的差异,即24h后对照组细胞明显强于干扰组,见图4B(P<0.01)。表明过表达HMMR-AS1能够促进子宫内膜癌细胞增殖,干扰HMMR-AS1能够抑制子宫内膜癌细胞系增殖。
2.5 过表达HMMR-AS1降低化疗药物敏感性 通过检测子宫内膜癌细胞系对顺铂及5-FU两种药物的IC50,发现子宫内膜癌细胞系对顺铂的IC50为45.23ng/ml,对5-FU的IC50为15.94 ng/ml。通过改进CCK-8实验检测过表达组与对照组细胞在HMMR-AS1异常表达情况对化疗药物(顺铂、5-FU)敏感性的影响,结果显示,第2~4天,过表达组子宫内膜癌细胞在450nm波长下的吸光度值显著高于对照组(见图5A,5B),经t检验,二者差异具有统计学意义(均P<0.05)。干扰HMMR-AS1后则能观察到相反的效应:即HMMR-AS1干扰组对顺铂及5-FU的敏感性均增加,见图5C,5D(均P<0.05),表明过表达HMMR-AS1能降低子宫内膜 癌细胞对顺铂及5-FU的敏感性。
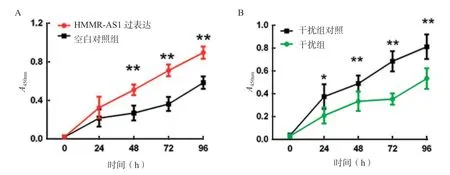
图4 过表达HMMR-AS1促进细胞增殖(*P<0.05,**P<0.01)
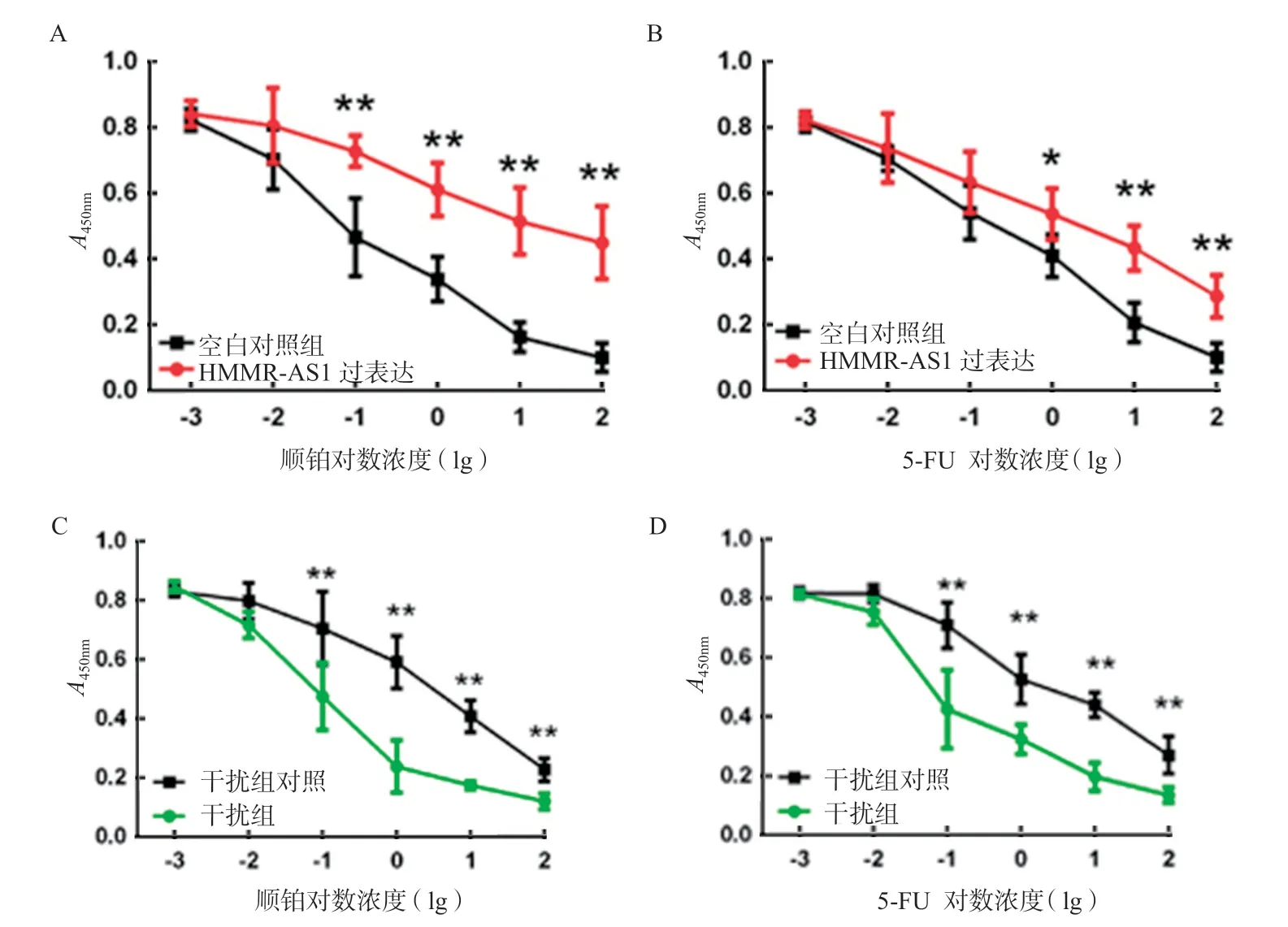
图5 过表达HMMR-AS1降低化疗药物敏感性(*P<0.05,**P<0.01)
2.6 过表达HMMR-AS1促进HMMR蛋白质表达增加 见图6。通过western blot实验检测过表达HMMR-AS1的子宫内膜癌细胞及对照组细胞的蛋白质,发现过表达组HMMR蛋白显著高于对照组。
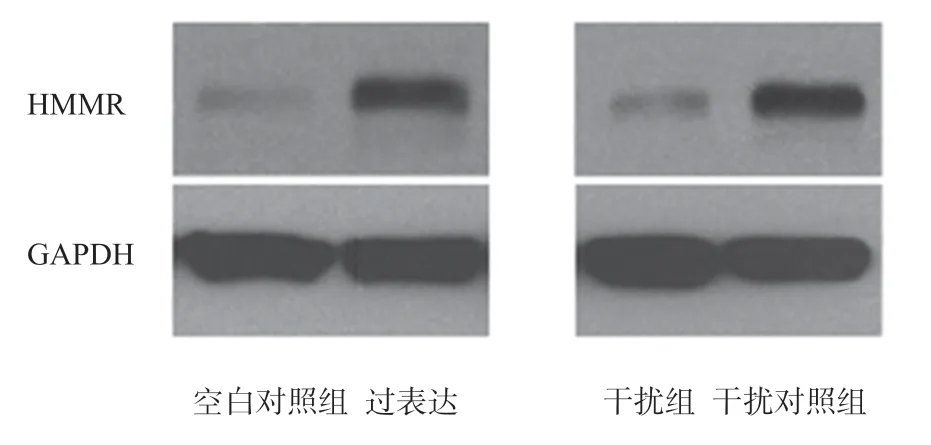
图6 过表达HMMR-AS1促进HMMR蛋白质表达增加
3 讨论
子宫内膜癌是发生在子宫内膜上的一种上皮恶性妇科肿瘤[12-14],主要发生于围绝经期和绝经后的女性,给全世界女性带来了严重的健康问题[15]。目前子宫内膜癌的主要治疗手段为手术切除,并使用放疗和化疗辅助治疗,但目前手术后患者仍有较高风险出现复发和转移,其中一个重要原因即为患者对化疗药物产生耐受,此外,放疗患者易出现部分肿瘤干细胞不能被射线杀灭的情况,进而导致子宫内膜癌出现较高复发率和转移率,导致子宫内膜癌预后不良。近年来研究显示,lncRNA在肿瘤化疗耐药中发挥重要调控作用[16-17]。
有研究报道,HMMR-AS1在乳腺癌中高表达;在上皮性卵巢癌中高表达,且可作为独立的预后因子[18];在恶性胶质瘤中高表达,且能够调节靶基因HMMR的表达[19];此外,王冉冉等[20]研究发现HMMR-AS1在上皮性卵巢癌中通过介导EMT的发生降低卵巢癌细胞对化疗药物敏感性,并促进卵巢癌细胞侵袭和转移。本研究发现,HMMRAS1在子宫内膜癌肿瘤组织中检测发现HMMRAS1在子宫内膜癌中高表达,且其高表达与其靶基因HMMR呈正相关。通过化疗敏感性实验发现过表达HMMR-AS1能够促进子宫内膜癌细胞系增殖,并降低其对化疗药物顺铂及氟尿嘧啶的敏感性,进而导致其对顺铂和氟尿嘧啶产生耐药。这与王冉冉等[20]在上皮性卵巢癌中的研究相符,均表现为促癌作用,并能够介导以上两种肿瘤细胞对化疗药物产生耐药性。通过检测过表达HMMR-AS1后细胞HMMR蛋白质水平的变化发现HMMR蛋白质水平升高,这与HMMR在恶性胶质瘤中能够促进化疗耐药的研究相符。
以上研究结果表明,HMMR-AS1在子宫内膜癌中通过促进HMMR的表达降低子宫内膜癌细胞对顺铂及氟尿嘧啶的敏感性,进而产生耐药。但HMMR-AS1与HMMR之间相互作用,并介导子宫内膜癌细胞耐药的分子机制尚未能明确,笔者所在课题组后期将进一步研究并揭示其分子机制,为子宫内膜癌化疗耐药提供新的科学依据。
