酿酒酵母关联多药耐受性转录因子Yrr1p的研究进展
2020-12-04曹文妍王心凝沈煜李在禄鲍晓明
曹文妍 王心凝 沈煜 李在禄 鲍晓明,
(1.齐鲁工业大学生物工程学院 生物基材料与绿色造纸国家重点实验室 山东省微生物工程重点实验室,济南 250353;2.山东大学微生物技术研究院 微生物技术国家重点实验室,青岛 266237)
环境胁迫是对生物生存与生长不利的各种环境因素的总称,是显著偏离生物适宜生长范围环境因素(如高温、高盐、营养饥饿、抑制物等)的水平。生物体对环境胁迫产生应答反应,并最终形成耐受性的过程,称为环境胁迫反应(Environmental stress response,ESR)[1]。一般地,细胞可利用胁迫响应转录因子来激活特定基因的表达,以应对各种环境胁迫[2-5]。在以木质纤维素为原料的二代燃料乙醇生产工艺中,秸秆类原料的预处理不可避免地产生多种对微生物生长不利的抑制物,其中香草醛是酚类抑制物的典型代表化合物,形成环境胁迫,明显干扰微生物生长及乙醇发酵过程[6]。本课题组前期工作中发现,缺失关联多药耐受性转录因子 Yrr1p(for yeast reveromycin aresistance)是酿酒酵母(Saccharomyces cerevisiae)提高香草醛耐受性的重要原因[7]。然而,这与Yrr1p对提高其他药物耐受性的表现不同,该转录因子的存在或获得性功能突变能够显著提高酿酒酵母对如细胞周期抑制剂Reveromycin A和寡霉素、4-硝基喹啉-N-氧化物、水杨酸、戴森锰锌等药物的耐受性[8-12]。这种截然相反的现象暗示Yrr1p在不同抑制物胁迫下存在不同的调控功能。本文将回顾Yrr1p的发现过程,并对这几年的相关研究进展,特别是Yrr1p结构及其介导酿酒酵母耐受性的调控机制做出综述,为生物体胁迫应答调控网络的研究提供模式依据。
1 转录因子Yrr1p的结构特征
酿酒酵母的YRR1基因(YOR162C)位于酿酒酵母第XV号染色体上,基因全长2 466 bp,编码的蛋白Yrr1p由810个氨基酸残基组成。Yrr1p氨基端的DNA结合结构域中存在一个Zn(II)2Cys6型的锌指结构基序CGFCRRRKLRCDQQKPMCSTCISRNLTTC,由半胱氨酸介导两个锌原子结合,属于锌指蛋白的锌簇蛋白亚家族,锌簇蛋白仅存在于真菌中。目前只有酿酒酵母有锌指转录因子Yrr1p的报道。与其他真菌锌簇蛋白结构类似,Yrr1p蛋白序列从氨基端到羧基端依次为DNA结合域(DNA binding domain,DBD)、中心同源区(Middle homologous region,MHR,也称为中心调控域,Central regulation domain)和激活结构域(Activating domain,AD)[13],各个结构域执行不同的功能。(1)DNA结合域:Yrr1p的DBD又包含锌指结构域(Znic finger domain)、连接区域(Linker region)和二聚化区域(Dimerization region)。Yrr1p通过二聚化区域形成同源二聚体后,再利用锌指结构域特异性识别并结合于靶基因的上游顺式调控元件YRRE(Yrr1p response element),其motif为T/ACCGC/TG/TG/TA/TA/T(图1)[9,14]。(2)中心调控域:Yrr1p的中心同源区(MHR),含有蛋白激酶C磷酸化位点,位于Yrr1p蛋白质序列的第175-190位,连接氨基端DBD和羧基端的激活结构域(AD)[9]。中心调控域参与靶基因的激活,与DBD的锌指相互作用,降低其对非结合位点的亲和力并增强其对结合位点识别的特异性,它对羧基端激活结构域的转录激活功能存在抑制作用,该区域缺失会导致Yrr1p产生组成型活性,持续激活靶基因的表达[15]。(3)激活结构域:Yrr1p的激活结构域位于氨基酸序列的羧基端。该结构域存在潜在的磷酸化位点(S184),与Yrr1p的激活调控能力密切相关。野生状态的Yrr1p在常态下低水平激活受控基因的表达,而当 Yrr1p激活结构域的氨基酸发生突变(如非极性氨基酸突变为极性氨基酸或者插入短肽),能够形成高活性Yrr1p突变体,以较高水平激活受控基因表达[8,10,16]。
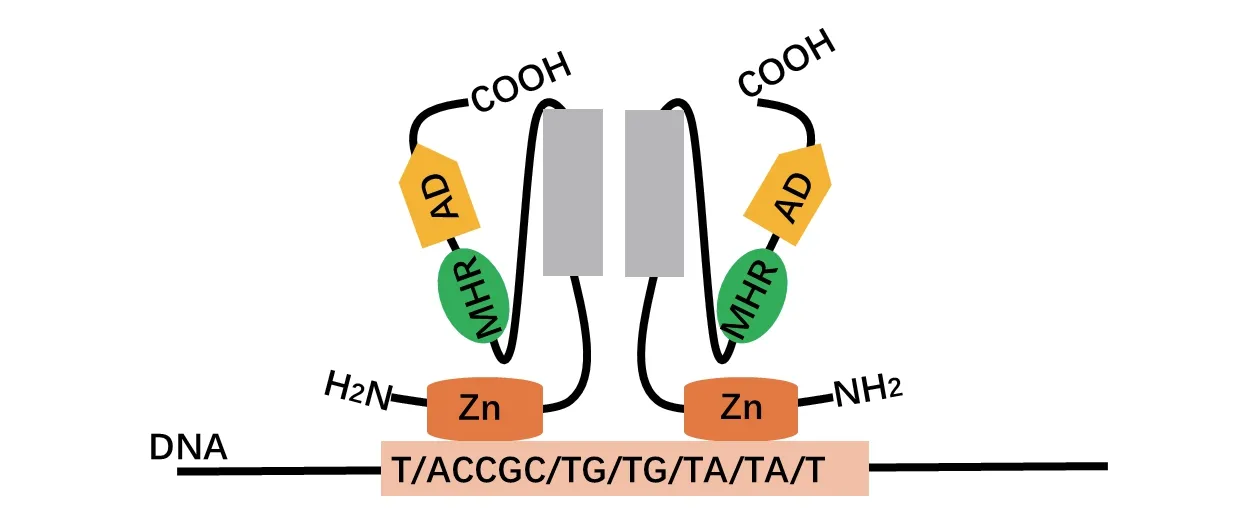
图1 转录因子Yrr1p锌指结构与DNA的结合方式[14-15]
2 转录因子Yrr1p的调控功能
Yrr1p与靶基因启动子区域的顺式调控元件YRRE(T/ACCGC/TG/TG/TA/TA/T)结合,激活或抑制靶基因的转录。由于转录因子结合结构域的特异性识别作用,一般认为启动子含有YRRE元件的基因均是Yrr1p潜在调控靶点[9]。但在不同环境胁迫条件下,Yrr1p的调控靶点也有所不同。
2.1 转录因子Yrr1p的调控靶点
由于Yrr1p的中心结构域会抑制自身活性,影响全基因组范围筛选靶基因的灵敏度,Le Crom等[9]将GAL4激活结构域与Yrr1p结合结构域融合成转录激活能力高于野生型Yrr1p的Yrr1*GAD。与野生型Yrr1p相比,Yrr1*GAD菌株中有15个基因的表达水平显著上调,其中13个基因的启动子区含有Yrr1p的识别序列YRRE。进一步通过凝胶迁移实验证实有9个基因(SNQ2、YOR1、FLR1、AZR1、SNG1、APD1、PLB1、YPL088W和YLL056C)能够与Yrr1p直接结合而被激活表达。推测其余6个基因(YLR179C、YLR346C、YMR102C、YLR046C、YRG035C和YKL051W)的表达是通过其他方式激活的。而这一推测也在随后Gallagher等[16]的研究中得到证实:在无胁迫条件下,利用ChIP-Seq技术在全基因组范围内鉴定Yrr1p调控靶点及识别元件,发现上述15个靶基因呈现不同的结合峰型,推测除YRRE外,Yrr1p可能还识别其它的顺式调控元件。
综上,Yrr1p激活的靶基主要分为以下4类:(1)ABC转运蛋白,例如SNQ2和YOR1;(2)易化载体蛋白超家族,例如FLR1、AZR1和SNG1;(3)与胞内脂质代谢,细胞膜组分代谢有关的PLB1,YPL088W、APD1、和YLL056C;(4)其他功能尚不清楚的YLR179C、YLR346C、YMR102C、YLR046C、YRG035C和YKL051W。
本课题组对YRR1敲除菌株及其野生菌株进行转录组学分析,结果显示,在无香草醛胁迫下,Yrr1p缺失只引起8个基因发生差异表达,其中6个表达上调(线粒体膜蛋白FMP45和UTH1、L-鸟氨酸转氨酶 CAR2、内质网膜合成相关SCS3以及功能未知的YCL048W-A 和YBR230W-A),2个表达下调(质膜蛋白YDR276C 和细胞溶质小蛋白CMI7)[17]。Le Crom等[9]已证实的受Yrr1p激活的靶基因都不在其列。Yrr1p的缺失和存在均能引起基因的差异表达,但所调控靶基因的不同暗示这两种状态参与不同的生物学过程。
2.2 转录因子Yrr1p提高酿酒酵母对多种含苯环药物耐受性的机制
转录因子Yrr1p提高酿酒酵母抑制物耐受性机制的研究工作主要涉及的抑制物,包括细胞周期抑制剂Reveromycin A和寡霉素、4-硝基喹啉-N-氧化物(4-nitroquinoline-oxide,4-NQO)、水杨酸、戴森锰锌等。Cui等[8]对细胞周期抑制剂Reveromycin A高耐受酿酒酵母菌株YRR1-1的基因组文库进行抗性元件的筛选发现,YOR162C的一个突变体能够显著提高酿酒酵母对Reveromycin A及4-NQO的耐受性。而敲除该基因则导致酿酒酵母对这两种药物的敏感表型。进而Zhang 等[10]证实了该突变基因在对线粒体抑制剂寡霉素的耐受性上也发生了相同的现象。为此将YOR162C命名为YRR1(for yeast reveromycin A resistance)。Kodo等[11]也进行了类似研究,他们将一株水杨酸高耐受性酵母菌株与野生型菌株进行杂交,分离其子代并进行遗传特性分析,确定水杨酸高耐受表型是由单基因控制。利用该高耐受菌株的基因组文库筛选这个单基因,确定是YRR1的获得性功能突变体YRR1-52提高了菌株对水杨酸的耐受性。同时发现YRR1-52也能提高酿酒酵母对4-NQO和寡霉素的耐受性。另外,有研究者从感染真菌性急性肺炎的艾滋病患者体内分离出致病性酿酒酵母YJM789,该菌株较经典S288C衍生菌株的衍生株S96具有更高的4-NQO耐受性。数量性状位点分析表明,不同耐受性表型与两者的YRR1序列差异有关[16]。
一般地,当酿酒酵母受到环境胁迫时,会激活转运蛋白表达来帮助毒性物质外排,以维护自身存活。例如,4-NQO、寡霉素和戴森锰锌分别依赖于ABC转运蛋白Snq2p、Yor1p以及易化载体超家族Flr1p[8,12,18-19]的表达,而Yrr1p调控的靶基因则正是一些与抑制物耐受性有关的膜转运蛋白。4-NQO高耐受性YRR1基因突变株YRR1-1和YRR1YJM789受4-NQO胁 迫 后,其ABC转 运 蛋 白Snq2p和Yor1p表达量较对照菌株均显著上调,而无胁迫条件下,SNQ2的转录水平不受YRR1突变体的影响[8,16]。在YRR1和SNQ2双缺失菌株中回补YRR1不能补救酿酒酵母对4-NQO的敏感性,证明Yrr1p主要通过激活SNQ2的表达从而提高菌株对4-NQO的耐受性。而后Zhang 等[10]在YRR1缺失菌株中将YOR1的启动子在不同位置进行突变,利用这些突变的启动子控制YOR1-lacZ的表达,并用低拷贝质粒分别回补野生型YRR1和突变体YRR1-1,经酶活测定,发现 Yrr1p 是通过结合在YOR1起始密码子上游-222到-190位置序列,激活YOR1表达,赋予酿酒酵母对寡霉素的耐受性。这两种转运蛋白表达量在Kodo等[11]发现的水杨酸高耐受性突变株YRR1-52中也有提高。荧光定量PCR结果表明YRR1-52是通过激活膜转运蛋白Snq2p、Yor1p、Flr1p和Azr1p的高表达综合提高菌株对水杨酸的耐受性,其中Flr1p也是酿酒酵母耐受杀菌剂戴森锰锌的关键蛋白[12]。荧光定量PCR结果显示在野生型酿酒酵母菌株中破坏YRR1,FLR1的转录水平会相应下降50%,从而引起菌株对戴森锰锌的超敏感性。上述突变形式的Yrr1p增强了自身激活调控能力,在多种结构的含苯环药物胁迫条件下,激活相关转运蛋白表达,赋予突变株较野生型状态较高的药物耐受性水平。这些突变体共同的特征是Yrr1p激活结构域的碱基序列发生置换或插入突变,这种获得性功能突变改变了Yrr1p蛋白结构。如YRR1-1突变体,在Yrr1p第695至706位插入12个氨基酸序列RTYRTILGNVIE[8]。YRR1-52突变体发现Yrr1p激活结构域的第626位丝氨酸突变为苯丙氨酸[11]。这两种突变如何影响Yrr1p活性还需进一步研究。另外,研究发现4-NQO高耐受性酵母菌株YJM789的YRR1基因YRR1YJM789编码的氨基酸序列第775位是苏氨酸,能够被磷酸化,而低耐受性菌株YRR1S96的第775位是异亮氨酸,不能发生磷酸化。研究人员将YRR1S96的异亮氨酸突变为带负电荷的谷氨酸,以模仿该位点被磷酸化后的强负电荷,结果显示突变后S96的4-NQO耐受性显著提高,且与YJM89的耐受性水平相当,从而证实激活结构域的磷酸化状态与Yrr1p介导酿酒酵母对4-NQO的耐受性密切相关[16]。
2.3 缺失转录因子Yrr1p提高酿酒酵母香草醛耐受性的机制
本课题组近几年的研究发现,Yrr1p与酿酒酵母对香草醛的耐受性有关。香草醛是酚类化合物,对微生物生长发酵有强烈的抑制[20-21]。而酚类化合物是二代燃料乙醇预处理过程中不可避免的抑制物[21]。利用基因组测序技术发现,YRR1发生缺失突变是酿酒酵母EMV-8菌株香草醛耐受性提高的主要原因[22]。对YRR1的同源基因YRM1,PDR8分别在野生型和YRR1缺失菌株中敲除,并没有引起香草醛耐受性的改变,推测同源基因之间的功能补偿或竞争结合作用不是YRR1缺失提高香草醛耐受性的原因。进一步转录组学数据显示,在无香草醛胁迫条件下,YRR1缺失只引起8个基因发生显著差异表达。而在香草醛胁迫条件下有多达218个基因发生显著差异表达。这一现象暗示香草醛在Yrr1p调控中发挥重要作用,即香草醛本身可能是Yrr1p调控的效应物。其中上文所涉及的其他药物耐受性相关的Yrr1p受控基因SNG1、SNQ2、YLL056C和APD1在YRR1缺失菌株中显著下调,其余受控基因表达量无明显变化。这也说明香草醛与其他药物的耐受性机制可能不同。另外,转录组结果还显示香草醛抑制了野生型菌株的核糖体合成、rRNA加工相关基因的表达。而敲除YRR1则可以解除该抑制作用,相关基因(如RNA解旋酶基因DBP2)表达提高[23]。超表达DBP2能够提高细胞对香草醛的耐受性,因此我们推测DBP2可能是潜在的Yrr1p负调控靶点。目前已报道的Yrr1p调控靶点均不涉及这类生物学过程,这可能是因为对Yrr1p靶基因的鉴定工作一般在常规培养条件下进行,忽略了抑制物本身的作用。因此,未来对于Yrr1p靶点的研究可以在不同环境如香草醛胁迫条件下进行,以发现新的调控靶点。该研究将揭示香草醛作为调控效应物影响 Yrr1p调控网络的机制以及相应的分子结构基础,为研究药物与转录因子之间的相互作用提供示例。
3 转录因子Yrr1p的上游调控
转录因子Yrr1p在调控下游靶基因的同时,也会受到上游更高级调节蛋白或信号途径的调控。Pdr1p和Pdr3p是酿酒酵母中调控多药耐受性(Pleiotropic drug resistance,PDR)的一对同源转录因子,其识别的上游顺式调控元件为PDRE(Pdr1/3p response element),其motif为C/TCCGC/TGGA/G[24-25]。YRRE和PDRE两者序列仅在CCG三联体周围碱基组成上略有差异,并且单独或交叠分布在共同调控靶基因的启动子区[26]。YRR1启动子存在Pdr1p结合位点PDRE以及Yrr1p自身结合位点YRRE,Zhang等[10]通过构建Yrr1p启动子连接β-半乳糖苷酶(Laz)报告基因载体与含有两种活跃程度的Pdr1p质粒共同转化至酿酒酵母,证实Pdr1p可以激活YRR1表达。另外用类似的方法证明Pdr3p可以激活YRR1表达和YRR1可以自我激活转录[10]。而调控Yrr1p的上游信号途径至今没有研究。此外,Pdr1p和Pdr3p所识别的PDRE元件,也分布在Yrr1p的一些靶基因启动子区域,如ABC转运蛋白基因(SNQ2和YOR1)与易化载体超家族基因(AZR1、SNG1和FLR1)等。因此,不仅YRR1受Pdr1p和Pdr3p激活表达,其靶基因也受到Pdr1p和Pdr3p的直接调控。
4 转录因子Yrr1p的同源转录因子
此外,在酿酒酵母的全基因组中,已经鉴定到的有54个Zn(Ⅱ)2Cys6锌簇蛋白,其中存在与Yrr1p的锌指结构基序高度同源的两个锌簇蛋白—Yrm1p(Yor172wp)和Pdr8p(Ylr266cp),三者调控靶基因的重叠度高达80%以上。虽然同源蛋白的全氨基酸序列与YRR1的相似度并不高,分别为25.7%和41.1%,但锌指结构域的高度相似(图2)是它们调控相似靶基因的主要原因[9,27-28]。

图2 Yrr1p与其同源基因锌指结构域氨基酸序列的比对[9]
Yrm1p与Yrr1p存在相互作用。Lucau-Danila等[28]在YRR1缺失和野生型酿酒酵母菌株中分别转入由半乳糖诱导启动子控制表达的YRM1,对它们分别进行基因差异表达分析并结合Northern blot验证,结果发现YRR1缺失菌株中,23个基因的表达水平显著上调,利用染色质免疫共沉淀技术证明这23个基因均是Yrm1p的调控靶点,其中包含了14个Yrr1p的靶基因。而在野生型菌株中,相比YRR1缺失菌株,这14个靶基因表达水平明显下调。换而言之,只有当YRR1缺失时,Yrm1p才发挥激活调控能力;Yrr1p存在,Yrm1p抑制Yrr1p转录调控活性,降低Yrr1p的靶基因转录水平。接着研究者构建了含有Yrm1p的结合结构域与Gal4p激活结构域的嵌合转录因子(该转录因子缺少了中心同源域),重复前面的实验,结果与前者相反,Yrr1p对Yrm1p的影响消失了。这些结果表明,Yrm1p和Yrr1p两者之间对靶基因启动子的竞争关系依赖于它们的中心结构域。
Hikke等[27]使用了与上述相似的办法,在野生型酿酒酵母中转入半乳糖诱导启动子控制表达的PDR8,对其进行基因转录水平的差异表达分析,结合染色质免疫共沉淀,证明了Pdr8p激活调控了8个靶基因,其中4个基因(AZR1、SNG1、YOR1和YLL056C)是Yrr1p的靶基因。
所有列出的基因受Yrr1p激活调控,主要分为4个功能类别:易化载体超家族、ABC转运蛋白、代谢和未知功能。Yrr1p大部分靶基因同时也受转录因子Pdr1p、Pdr3p、Pdr8p和Yrm1p调控。这些转录因子激活调控其它转录因子的表达(Pdr1p和Pdr3p激活调控YRR1)或激活自身表达(Yrr1p),转录因子之间还存在相互作用(Yrr1p和Yrm1p互相抑制激活调控能力,Yrr1p对Yrm1p的抑制程度更高)。
5 总结与展望
Yrr1p转录因子的作用广泛,参与酿酒酵母多药耐受性的调控及其他化学胁迫压力的响应。调控转运蛋白、透性酶和代谢相关等靶基因的表达。图3总结了以上综述的Yrr1p的药物耐受性调控网络。可以看到,耐药性调控网络不是简单的单向关系,在调控方式上,YRR1与功能高度相似的PDR1/PDR3/PDR8之间存在相互调控、协同互作的关系,同时YRR1和同源基因YRM1之间又存在相互作用关系。多药耐受性调控网络存在重要的重叠,一个转运蛋白同时受多个转录因子调控,目的就是为了避免因一个转录因子发生突变而导致致死反应。上述转录因子构成酿酒酵母应对各种环境胁迫条件的遗传缓冲调控的重要部分,同时也是酿酒酵母全局应激调控网络的重要组成部分。在研究Yrr1p转录因子调控机制的同时,还应从全局考虑,关注整个胁迫应答调控网络。

图3 Yrr1p与其同源转录因子的调控网络关联多药耐受性调控网络[9,28]
另外,本课题组发现Yrr1p对木质纤维素水解液中的香草醛耐受性有负调控作用,且Yrr1p对在香草醛胁迫下的调控网络不同于其他多药耐受性的调控网络,香草醛或许是Yrr1p调控网络中小分子效应物,与Yrr1p协同抑制翻译相关基因。未来可以利用ChIP-Seq在有和无香草醛条件,发掘Yrr1p潜在的调控靶点。
酿酒酵母耐受机理的研究,特别是解析抑制物对胁迫相关转录因子调控网络的影响,为缓解纤维素乙醇生产中毒性化合物抑制的瓶颈问题提供理论基础,同时对抗逆酿酒酵母细胞工厂的构建具有指导意义。
