脊髓PKCε和μ阿片受体参与瑞芬太尼诱导大鼠痛觉过敏
2020-12-04王晓娥
于 萍,王晓娥,崔 宇,陈 元
(中山大学1.中山医学院;2.附属第一医院麻醉科;3.医学院,广东广州 510080)
瑞芬太尼是一种超强效的μ阿片受体(μ opi⁃oid receptor,MOR)激动剂,具有作用时间短、起效快、消除作用迅速等优点,现已广泛应用于手术麻醉[1]。然而,大量研究发现,瑞芬太尼的长时间或大剂量输注可引起痛觉过敏(remifentanil-induced hyperalgesia,RIH),表现为痛阈降低、痛感增强或痛觉异常[2]。以往研究表明,RIH 涉及的分子机制可能有MOR 表达水平下调和功能改变、NMDA受体的激活、脊髓胶质细胞的活化等多方面[3],但RIH 的具体机制尚未明确。其中,MOR 水平下调和功能改变是RIH 形成的重要原因[4]。蛋白激酶C(PKC)属于多功能丝氨酸和苏氨酸酶,包含十余种亚型,尽管研究发现,阿片类药物诱导的MOR改变依赖于PKC,但具体亚型尚未明确[5]。PKCε在脊髓组织中表达丰富,参与多种疼痛调节[6-7]。研究发现,神经损伤后脊髓PKCε表达显著增加,抑制PKCε可以有效延缓痛觉过敏的发生,提示脊髓PKCε在慢性疼痛中具有重要作用[6-7]。然而,PKCε是否参与RIH 以及PKCε是否介导瑞芬太尼诱导的MOR 改变目前未见报道。本研究拟通过观察RIH 大鼠脊髓组织中PKCε和MOR 的表达水平,并通过预先鞘内注射不同的PKC 抑制剂观察大鼠行为学变化以及检测脊髓MOR 蛋白表达变化,初步探究RIH 大鼠模型中PKCε与MOR 之间的关系。
1 材料与方法
1.1 实验动物
本研究的实验动物均由中山大学实验动物中心提供提供,所有实验操作均符合中山大学动物实验中心伦理委员会要求并按照实验动物使用原则执行。18 只体质量为220~250 g 的SPF 级成年雄性SD 实验大鼠随机均分成3 组,即空白对照组(C 组)、生理盐水组(S 组)、瑞芬太尼组(R 组)。C 组:大鼠正常饲养;R 组:输注瑞芬太尼4 μg/(kg·min)给药2 h,丙泊酚12 mg/(kg·h)给药2 h;S 组:实验大鼠经尾静脉持续输注R 组同等剂量生理盐水和丙泊酚12 mg/(kg·h)给药2 h。第二批实验增加R+BIS 组和R+Gö6983组;R+BIS组:瑞芬太尼痛敏模型建立前30 min 鞘内注射BIS,之后经尾静脉持续输注瑞芬太尼4 μg/(kg·min)给药2 h、丙泊酚12 mg/(kg·h)给药2 h;R+Gö6983组:瑞芬太尼痛敏模型建立前30 min 鞘内注射Gö6983,之后经尾静脉持续输注瑞芬太尼4 μg/(kg·min)给药2 h、丙泊酚12 mg/(kg·h)给药2 h[8]。SD 实验大鼠置于安静环境下单笼饲养,饲养条件包括:房间采用12 h 明-暗交替且保持恒温(22±0.5)℃、恒湿(55±10)%、保证SD 实验大鼠自由饮食。
1.2 实验方法
1.2.1 瑞芬太尼痛敏模型建立 生理盐水稀释瑞芬太尼(宜昌人福药业有限责任公司,中国)至终浓度40 μg/mL 备用,生理盐水稀释丙泊酚(广东嘉博制药有限公司,中国)至终浓度250 μg/mL 备用。SD 实验大鼠吸入七氟烷(上海恒瑞医药有限公司,中国)麻醉侧卧后,尾静脉置入静脉留置针,连接恒速电子注射泵,S 组输注生理盐水和丙泊酚2 h。R 组持续输注瑞芬太尼和丙泊酚2 h。大鼠术中保持自主呼吸。
1.2.2 鞘内注射生理盐水稀释 BIS(Sigma,美国)和Gö6983(Sigma,美国)至终浓度分别为10 μmol/L和1 μmol/L 备用。采用Mestre 法[9]进行大鼠鞘内注射。RIH大鼠模型建立前30 min,SD实验大鼠吸入七氟烷麻醉俯卧后,备皮消毒SD 大鼠脊柱,以50 μL 微量注射器于SD 实验大鼠脊柱L4-15 椎间隙垂直进针,以大鼠尾巴出现抖动为成功进入髓鞘内信号,此时缓慢注入抑制剂BIS或Gö6983 10 μL。
1.2.3 行为学测试 测试前3 d,将SD 实验大鼠放于行为学测试室每天分笼适应2 h,适应行为学测试环境。尾静脉输注药物前24 h 测试SD 实验大鼠基础痛阈值,将输注结束后第6 h、24 h 设为行为学测试时间点。SD 实验大鼠在测试前1 h 于行为学测试室适应环境,采用Hargreaves[10]热痛测试法(thermal paw withdrawal latency,PWTL,以s 为单位)进行行为学测试。设置热辐射刺激仪(SERIES 8 Model 390G IITC,Life Science,美国)参数包括:基础光强:5 V;光强:30 V;自动断电时间:20 s。SD 实验大鼠处于安静状态时用热辐射源照射SD 实验大鼠右后足底正中处,记录从开始给予热刺激到大鼠出现反射性撤足的时间,每只大鼠重复测量3 次,每次间隔5 min,取3 次平均值为该SD 实验大鼠的热痛阈值。
1.2.4 免疫荧光染色 SD实验大鼠腹腔注射10%水合氯醛(上海生工,中国)进行深度麻醉。麻醉后暴露大鼠胸腔,剪开心尖后,针头经左心室至升主动脉并固定,剪右心耳,快速灌注预冷的生理盐水500 mL 后改灌注500 mL 预冷的40 g/L 多聚甲醛40 min 进行固定。灌注结束后,解剖取出SD 实验大鼠脊髓腰椎膨大处,置于预冷的40 g/L 多聚甲醛中后固定4 h,随后转入30% 蔗糖溶液中4℃过夜。待脊髓组织沉底后用OCT 包埋进行冰冻切片,片厚20 μm,直接贴片于载玻片上。
组织冰冻切片用1×PBS清洗3次,每次10 min。室温下封闭液封闭1 h。弃去封闭液后分别加入一抗(PKCε,1∶100,BD 美国;MOR,1∶200,abcam英国;OX-42,1∶200,Cell Signaling TECHNOLOGY美国;millipore 美国;GFAP,1∶200,NeuN,1∶200,abcam 英国),4 ℃湿盒孵育过夜。之后,1×PBS 洗3 次,10 min/次,洗去一抗后,置于相应的二抗(1∶1 000)中,室温避光孵育1 h,1×PBS 清洗3 次,10 min/次。洗去二抗。晾干后于正置荧光显微镜(Olympus BX63,日本)下观察并拍照。
1.2.5 实时荧光定量PCR 应用TIANGEN 试剂盒(TIANGEN,中国)提取SD 实验大鼠脊髓组织总RNA,采用两步法将RNA 逆转录为cDNA,应用SYBR Green 法(TAKARA,日本)进行实时荧光定量PCR 反应。设定GAPDH 为内参:上游引物:TGCCACTCAGAAGACTGTGG;下游引物:TTCAG⁃CTCTGGGATGACCTT。PKCε上游引物:AACGAG⁃TGTTTAGGGAGCGG;下游引物:GTTTCTTTAGC⁃CCAGCGCAC。MOR 上游引物:CAACTTGTCCCA⁃CGTTGATG;下游引物:TCCAAAGAGGCCCACTA⁃CAC。扩增条件:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环。实验重复3 次。反应结束后根据Ct值,计算并统计分析结果。
1.2.6 蛋白免疫印迹 取SD实验大鼠脊髓组织称重后加入蛋白裂解液,采用KZ-11高速组织研磨仪(Servicebio,中国)研磨,60 Hz,60 s。4 ℃14 000 r/min离心25 min(离心机半径r=5 cm),取上清液。采用BCA 法测定蛋白样品浓度,剩余蛋白加入上样缓冲液于95℃煮样10 min。采用10%聚丙烯酰胺凝胶电泳分离靶蛋白并以恒流250 mA电转90 min至PVDF 膜上。电转后,体积分数5%脱脂奶粉溶液室温下封闭PVDF膜1 h。之后,4 ℃下水平摇床孵育一抗(PKCε,1∶1 000,BD 美国;MOR,1∶2 000,abcam 英国)过夜。次日,1×TBST 缓冲液清洗PVDF膜3次,10 min/次。室温下孵育二抗(1∶10 000)1 h,之后1×TBST 缓冲液洗PVDF 膜3 次,10 min/次,曝光。结果使用Image J 软件进行灰度分析,以Relative Density(以下简称RD)表示各组测定灰度值与C 组比值,进行统计分析。
1.3 统计学分析
使用SPSS 26.0 统计分析软件进行统计分析,实验结果以均数±标准差()表示。行为学结果采用重复测量方差分析,蛋白免疫印迹和实时荧光定量PCR 结果采用单因素方差分析比较。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 尾静脉输注瑞芬太尼诱导大鼠热痛阈值降低
本实验通过构建RIH 大鼠模型检测瑞芬太尼输注后大鼠热痛行为学变化,采用重复测量方差分析结果显示:各组大鼠热痛阈值满足球形分布(χ2=4.12,P=0.86;χ2=11.32,P=0.26),各组间差异有统计学意义(F=32.60,P< 0.001;F=54.07,P< 0.001),各组时间点差异有统计学意义(F=17.84,P<0.001;F=15.34,P<0.001),且组间和时间点有交互效应(F=13.53,P< 0.001;F=12.47,P<0.001)。大鼠尾静脉注射生理盐水后与C组相比各时间点PWTL差异均无统计学意义(F=0.78,P> 0.05),而静脉注射瑞芬太尼6 h后,PWTL与C组比较明显降低[PWTL=(8.95±1.16)s,F=27.43,P<0.001]。在给药后24 h大鼠的热痛觉阈值显著下降[PWTL=(5.31±0.87)s,F=69.81,P<0.001],见图1。
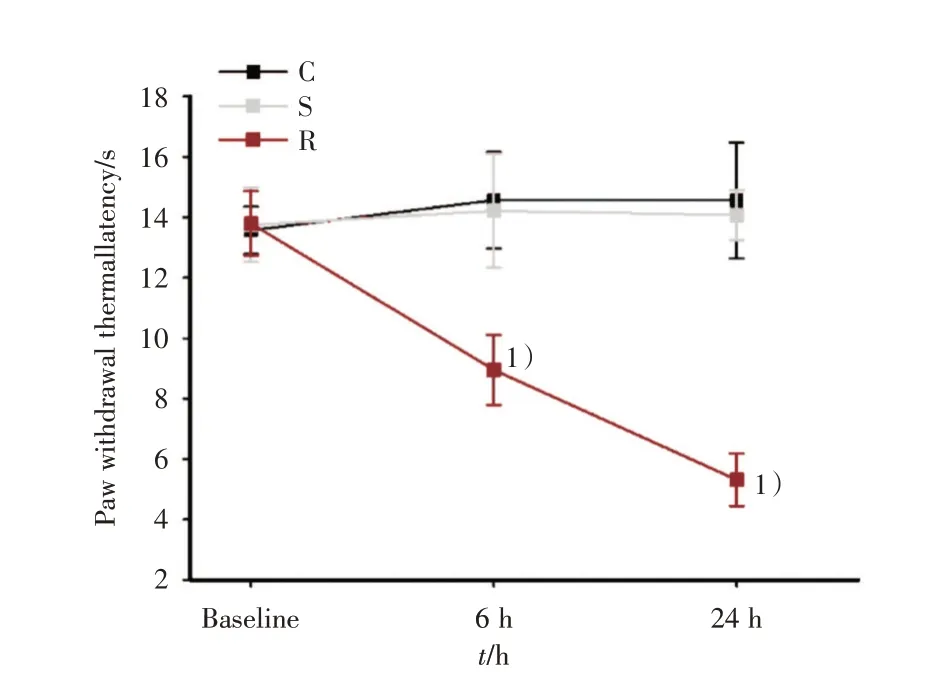
图1 静脉输注瑞芬太尼降低大鼠热痛阈值Fig.1 Intravenous infusion of remifentanil reduces PWTL in rats
2.2 瑞芬太尼诱导大鼠脊髓背角神经元中的PKCε表达增加、MOR 表达减少
对PKCε蛋白印迹相对灰度值进行单因素方差分析结果显示差异具有统计学意义(F=118.736,P< 0.001):与C 组进行比较,PKCε在瑞芬太尼输注后的6 h 蛋白表达水平增加(RD=1.79±0.08,P<0.001),且在瑞芬太尼输注后的24 h 蛋白表达水平显著增加(RD=3.01±0.24,P<0.001);我们对MOR蛋白印迹相对灰度值进行单因素方差分析结果显示具有统计学意义(F=144.303,P<0.001):与C 组进行比较,MOR 在输注后的6 h 蛋白表达水平减少(RD=0.68±0.04,P<0.001),在输注后的24 h 蛋白表达水平显著减少(RD=0.43±0.02,P<0.001),见图2。
采用荧光定量PCR 方法检测瑞芬太尼输注后大鼠脊髓组织中PKCε、MOR 的mRNA 的表达变化情况。与蛋白印迹结果一致的是PKCε的mRNA 表达水平的单因素方差分析结果显示差异具有统计学意义(F=18.873,P< 0.001);与C 组相比较,PKCε的mRNA 在尾静脉输注瑞芬太尼后24 h 表达显著增加(P< 0.001);我们对MOR 蛋白印迹相对灰度值进行单因素方差分析结果显示具有统计学意义(F=39.883,P<0.001);与C组相比较,MOR 的mRNA 在输注后24 h 表达显著降低(P<0.001),见图3。

图2 输注瑞芬太尼影响大鼠脊髓组织中PKCε、MOR 的蛋白水平表达变化Fig.2 Remifentanil infusion affects the expression of PKCε and MOR protein levels in the spinal cord
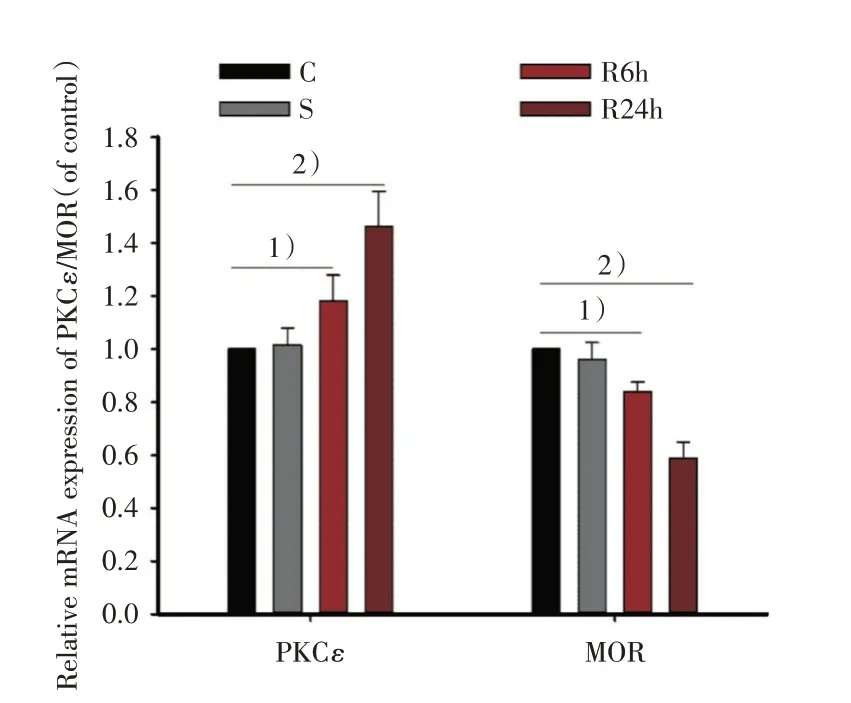
图3 输注瑞芬太尼影响大鼠脊髓组织中PKCε、MOR 的mRNA 水平表达变化Fig.3 Remifentanil infusion affects the expression of PKCε and MOR mRNA levels in the spinal cord
为了观察和PKCε和MOR 分布情况,我们利用免疫荧光化学染色方法将R24h 组的PKCε、MOR 分别与星形胶质细胞标记蛋白GFAP、小胶质细胞标志蛋白OX-42 和神经元标志蛋白NeuN共染。免疫荧光双染结果显示,PKCε和MOR 分别主要在脊髓背角神经元分布(图4、5)。以上结果表明,瑞芬太尼诱导大鼠脊髓背角神经元中的PKCε蛋白表达增加、MOR 蛋白表达减少,提示PKCε和MOR 参与RIH。

图4 PKCε与星形胶质细胞、小胶质细胞和神经元双染结果Fig.4 Co-localization of PKCε and astrocyte,microglia or neuron in the spinal dorsal cord
2.3 预先鞘内注射不同的PKC 抑制剂对瑞芬太尼诱导的大鼠痛觉过敏的影响
为进一步探究PKCε在瑞芬太尼引起的大鼠痛觉过敏中的作用,我们选用了两种不同的PKC相对抑制剂BIS 和Gö6983。与R 组[PWTL=(11.93 ±0.07)s]相比较,建立瑞芬太尼诱导的痛敏模型前30 min 鞘内注射BIS 后大鼠热痛过敏显著缓解,分别在输注瑞芬太尼后6 h[PWTL=(12.52 ±0.07)s,P< 0.001]、24 h[PWTL=(11.93 ± 0.90)s,P< 0.001]的差异具有统计学意义。而预先鞘内注射Gö6983 与C 组相比较不能缓解大鼠热痛过敏(P>0.05),见图6。
2.4 预先鞘内注射不同的PKC 抑制剂对MOR 蛋白表达影响
输注瑞芬太尼后24 h,分别对C 组、R 组、R+BIS 组和R+Gö6983 组大鼠脊髓MOR 蛋白进行单因素方差分析结果显示差异具有统计学意义(F=517.816,P<0.001)。相较于C 组,R+Gö6983组MOR 蛋白表达水平降低(RD=0.52 ± 0.01,P<0.001),与R 组(RD=0.49 ± 0.01,P< 0.001)趋势一致。而相较于R 组,由瑞芬太尼引起的MOR蛋白降低现象可以被BIS(RD=1.09 ± 0.04,P<0.001)所改变(图7)。以上实验结果提示PKCε可能介导瑞芬太尼诱导痛敏模型中MOR 下调。
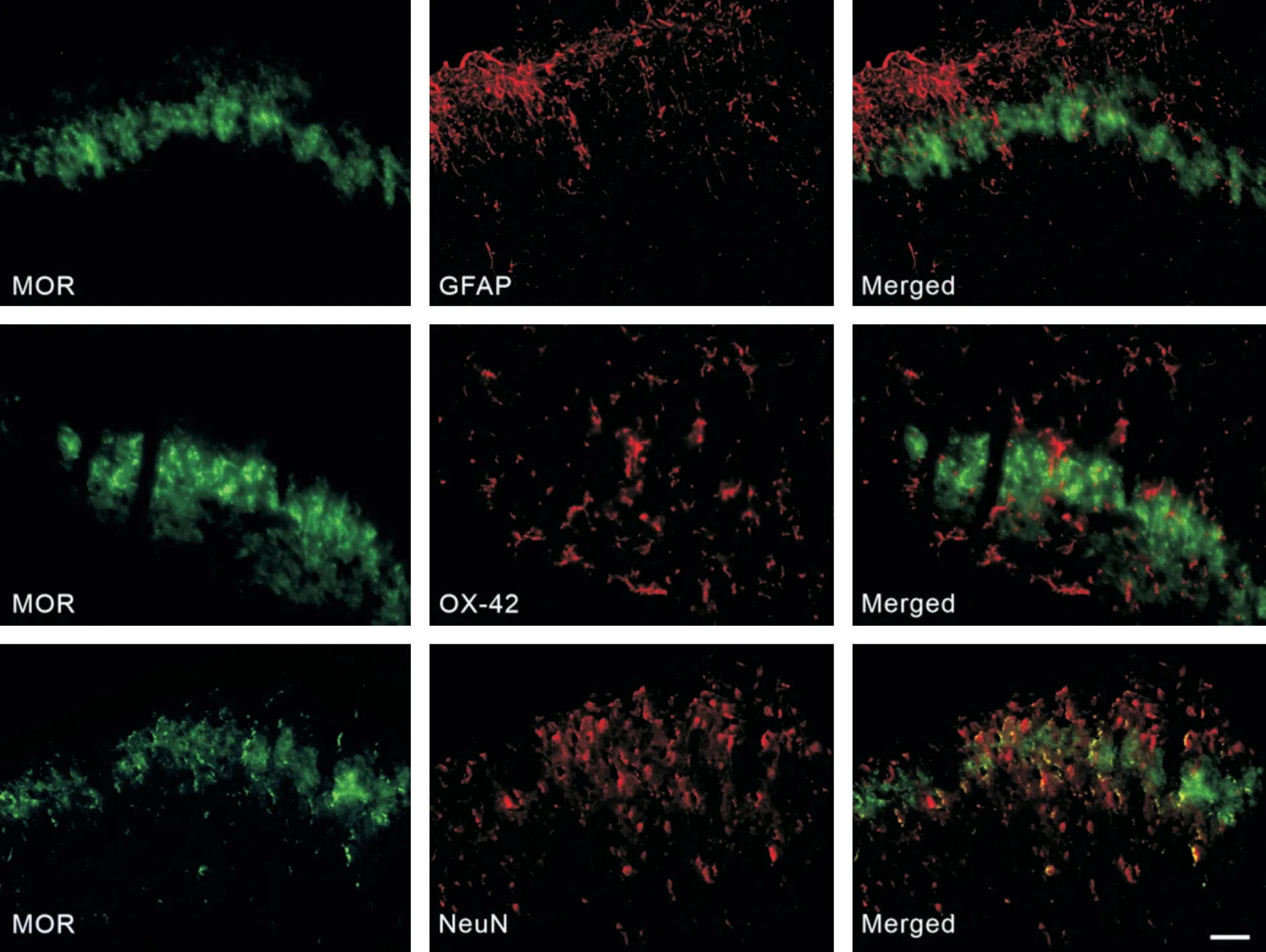
图5 MOR 与星形胶质细胞、小胶质细胞和神经元双染结果Fig.5 Co-localization of MOR and astrocyte,microglia or neuron in the spinal cord
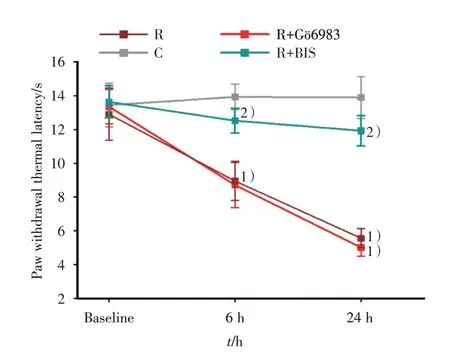
图6 不同的PKC 抑制剂预处理影响瑞芬太尼诱导的大鼠热痛阈值Fig.6 Effects of pretreatment with different PKC inhibitors on PWTL induced by remifentanil in rats
3 讨论
本研究中我们首次发现了脊髓PKCε在RIH大鼠中的蛋白、mRNA表达增加,并且预先鞘内注射BIS 可以有效缓解大鼠痛觉过敏,而使用Gö6983则无明显变化,BIS 是PKC 的广谱抑制剂,抑制包括PKCε在内的多种PKC 亚型,而Gö6983 仅抑制PKCα、PKCδ等亚型,不抑制PKCε[11]。提示PKCε参与了RIH。同时,我们发现RIH 大鼠脊髓MOR蛋白、核酸表达水平降低,且PKCε和MOR 均与脊髓背角神经元共定位,我们进一步研究发现鞘内注射BIS 可抑制瑞芬太尼引起的脊髓MOR 蛋白表达水平降低,提示PKCε可能通过下调MOR 介导RIH 的病理生理过程。
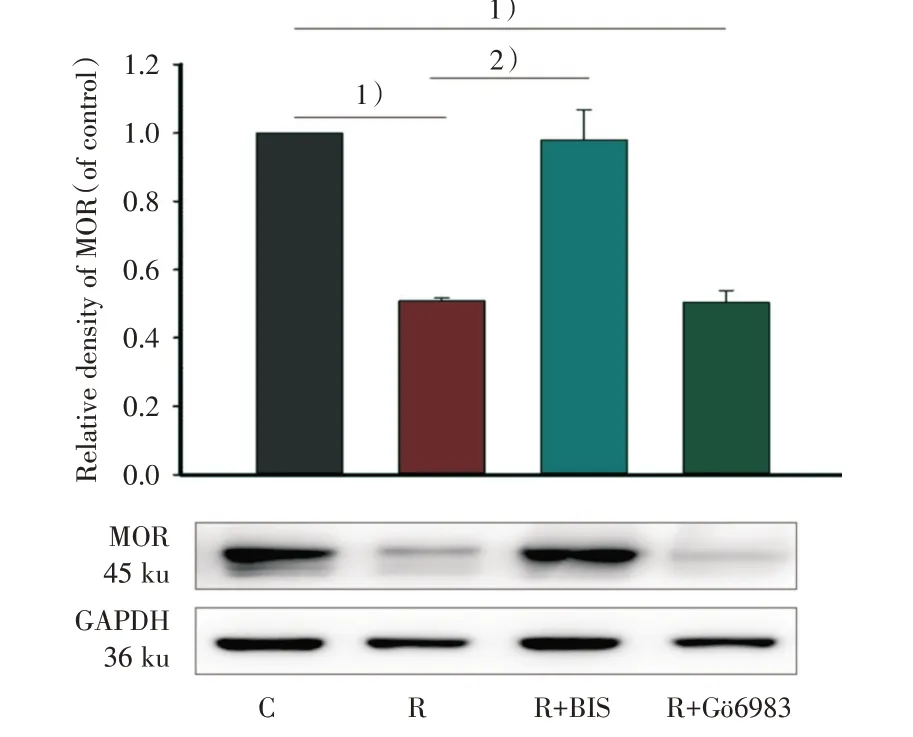
图7 不同的PKC 抑制剂预处理抑制瑞芬太尼诱导的大鼠脊髓中MOR 的蛋白表达降低Fig.7 Pretreatment of different PKC inhibitors block the decreased expression of MOR protein levels induced by remifentanil in rats
瑞芬太尼作为一种人工合成的超强效的μ阿片受体激动剂比其他阿片类药物更容易诱导痛觉过敏,且RIH大鼠模型现被广泛应用于研究阿片类药物诱导痛觉过敏(opioid-induced hyperalgesia,OIH)的作用机制。本实验采用的4 μg/(kg·min)输注剂量已被证实可用于成功构建瑞芬太尼诱导大鼠痛觉过敏模型[12],与Zhao 等[13]研究一致。MOR 被认为是临床上阿片类镇痛药物的主要作用靶点[14]。研究表明长时间输注MOR 激动剂可以促进急性疼痛向慢性疼痛的转化[15]。研究发现输注瑞芬太尼可诱导大鼠脊髓背根神经节MOR表达下调,与我们发现RIH 大鼠脊髓MOR 蛋白、核酸表达水平下调结果相似[16]。
据报道[5-6],激活的PKCε从细胞质中移位到细胞膜上磷酸化相应的下游底物,增强外周神经细胞的兴奋性,参与突触信息传递,在伤害感受器致敏和机械痛觉过敏中发挥重要作用。Chu 等[7]通过使用si RNA 干扰明确了PKCε介导吗啡诱导的MOR表达下调改变且该实验通过诱导基因突变证实了在MOR 信号转导复合物中,Gαi2 的Ser44、Ser144 和Ser302 被吗啡激活的PKCε磷酸化从而引起MOR 表达下调,进而导致吗啡耐受。然而瑞芬太尼引起的痛觉过敏中MOR 表达水平改变的具体机制并不明确,我们的研究发现,脊髓MOR在预先鞘内注射BIS 的RIH 大鼠中的蛋白表达水平降低现象被抑制,说明PKCε可能参与调控RIH中MOR 的表达。
PKCε转位对于其发挥磷酸化具有重要意义,然而,瑞芬太尼诱导痛觉过敏模型中PKCε转位与MOR 的改变的关系尚不清楚。我们推测:瑞芬太尼输注后激活PKCε发生转位,活化的PKCε可能通过直接磷酸化MOR 或其他受体导致MOR 内化,MOR 内化后其中部分受体有可能在细胞质内被酶水解而使回到细胞膜上的MOR 减少导致MOR 脱敏,进而产生痛觉过敏。因此,PKCε在瑞芬太尼引起的痛敏模型中的磷酸化作用以及作用靶点有待相关研究中进一步探究。
综上所述,本研究结果表明脊髓背角神经元PKCε和MOR 参与瑞芬太尼诱导大鼠痛觉过敏,同时PKCε可能调控MOR 表达水平变化。该结果为研究瑞芬太尼诱导痛觉过敏的发生机制提供了新的理论依据,也为进一步研究瑞芬太尼痛觉过敏的防治提供了理论基础。
