川东獐牙菜体外高效再生体系的建立
2020-12-04于叶霞林虎绒王元忠黄衡宇
于叶霞 林虎绒 王元忠 黄衡宇,* 李 鹂
(1 吉首大学植物资源保护与利用湖南省高校重点实验室,湖南 吉首 416000; 2 云南中医药大学中药材优良种苗繁育工程研究中心,云南 昆明 650500; 3云南省农业科学院药用植物研究所,云南 昆明 650200)
川东獐牙菜(SwertiadavidiiFranch.)又名水灵芝、鱼胆草、青鱼胆草等,为龙胆科(Gentianaceae)獐牙菜属(Swertia)多年生草本[1],主要分布在湖南、湖北、四川及贵州等中西部省份,为我国特有物种。川东獐牙菜多生长在河边草丛、石缝及灌木丛中[2],其性寒、味极苦,具有清热解毒、利胆健胃等功效。川东獐牙菜主要含有口山酮类、环烯醚萜类、三萜类和黄酮类等化学成分,用于治疗黄疸型肝炎、痢疾、肺炎、扁桃体炎及妇科炎症等疾病[3]。
随着对民间草药川东獐牙菜化学成分和药理活性的深入研究,其已成为重要中药资源,并作为一种珍稀药材被《中药志》收录[4]。在原生地,川东獐牙菜由于植株矮小、伴生杂草极多,仅在花期易被识别。药农及草医对花期植株的大量采摘导致川东獐牙菜无法完成生活史,有性生殖效率极低,野生种群及个体数量急剧锐减。此外,水坝、电站等人类活动使原生地水位上升,造成川东獐牙菜主要生境被淹没,野生资源逐渐枯竭,部分道地产区现已难觅其踪迹。我国一些地区曾尝试对川东獐牙菜进行人工引种栽培,但由于缺少对其生活史、有性生殖、无性繁殖及传粉生物学等方面的了解,成效甚微[5]。前期,课题组成员分别于2014年7月和2017年8月前往湘、黔、川等地进行川东獐牙菜资源考察研究,发现仅湖南省张家界市茅岩河南岸有较大种群存在,其他传统产地仅当地居民作为药地小面积种植,每年采收种子进行繁殖,野生资源基本丧失。据了解,此繁殖方式已持续15年之久,长期近交导致川东獐牙菜种质退化。因此,利用组织培养技术培育出大量基因型一致的优质川东獐牙菜种苗具有重要的现实意义。
目前已有川东獐牙菜组织培养的研究[6],但存在繁殖周期长、增殖系数低、生根苗纤弱等问题。在此基础上,本研究通过单因素-完全组合-正交试验,进一步优化培养条件,建立川东獐牙菜适宜和高效的繁殖技术体系,以期为其野生资源保护及规模化种植提供有效途径,也为其遗传转化研究奠定试验基础。
1 材料与方法
1.1 试验材料
营养生长期川东獐牙菜植株于2016年10—12月采自湖南省张家界市茅岩河火烧溶居群(110°16′E,29°06′N及附近,海拔150 m),带土移栽于湖南吉首大学生态研究所试验地。经吉首大学生物资源与环境科学学院标本馆张代贵高级实验师鉴定为SwertiadavidiiFranch.(凭证标本:黄衡宇159,存于吉首大学资源与环境科学学院标本馆)。选取生长健壮、无病虫害植株,取其带叶茎尖、带芽茎段和叶片作为外植体。
MS为基本培养基,琼脂4.7 g·L-1,pH值5.4~5.8。试验所用激素母液质量浓度均为0.1 mg·mL-1。
1.2 外植体的处理
外植体用自来水冲洗12 h,5%洗衣粉溶液(质量比)浸泡5 min,自来水冲洗30 min,置于超净工作台内,用75%乙醇(体积比)处理10~15 s,0.1%升汞(质量比)消毒2 min,无菌水冲洗6次,每次不少于3 min,接种于相应诱导培养基中。
1.3 优化试验设计
所有优化试验中,培养室温度控制在22±1℃,光照强度1 500~2 000 lx,光照时间10 h·d-1,每隔7 d记录不同处理组的川东獐牙菜生长情况。
1.3.1 单因素试验 MS基本培养基中添加不同激素进行单因素试验,其中6-苄基腺嘌呤(6-benzylamino purine,6-BA)、6-糠氨基嘌呤(Kinetin,KT)和吲哚乙酸(β-indoleacetic acid,IAA)质量浓度分别为0.05、0.10、0.50、1.00、1.50、2.00 mg·L-1;萘乙酸(1-naphthylacetic acid,NAA)质量浓度为0.01、0.05、0.50、1.00、1.50 mg·L-1;2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)质量浓度为0.01、0.03、0.05、0.50 mg·L-1。分别将3种外植体接种于上述培养基,培养30 d后观察各试验组川东獐牙菜的生长情况。
1.3.2 腋芽诱导 基于单因素试验及早期研究结果[8],用不同浓度的6-BA(1.0、1.5、2.0 mg·L-1)和NAA(0.5、1.0、1.5 mg·L-1)进行完全组合试验,以带芽茎段为外植体考察不同激素组合对川东獐牙菜腋芽诱导的影响。培养30 d后统计川东獐牙菜腋芽发生率及腋芽发生系数。每个培养瓶接种5个带芽茎段,每组接种22瓶。污染瓶不予统计。
1.3.3 愈伤组织诱导、不定丛芽发生及增殖 以叶片为外植体,进行L9(34)正交试验,正交因素为6-BA(A)、NAA(B)、KT(C),其组合见表1,筛选川东獐牙菜叶片愈伤组织诱导和不定丛芽发生的最佳激素组合。培养30 d后统计出愈率、丛芽发生率和增殖系数。每个培养瓶接种5个叶片,每组接种22瓶。

表1 川东獐牙菜愈伤组织诱导与丛芽发生的L9(34)正交试验设计Table 1 Orthogonal design L9 (34) of callus induction and shoots germination in S. davidii
1.3.4 生根培养试验 依据单因素试验结果,切取生长健壮的单苗接入含不同浓度(0、0.01、0.05、0.10、0.50 mg·L-1)NAA的基本培养基,培养30 d后统计川东獐牙菜生根率。每个培养瓶接种5个幼苗,每组接种22瓶。污染瓶不予统计。
1.4 炼苗移栽
川东獐牙菜生根培养30 d后,在自然光下闭口炼苗7 d,再打开瓶盖炼苗3 d,取出生根苗小心洗尽残余培养基,用0.1%多菌灵溶液(质量比)浸泡根部5 min,移栽到沙质土中,30 d后统计川东獐牙菜幼苗的成活率。
1.5 指标测定及分析
采用Microsoft Office Excel 2016和SPSS 12.0软件对试验数据进行整理与分析。
腋芽发生系数=出芽总数/起始接种总数
(1)
出愈率=产生愈伤组织的外植体数/起始接种总数×100%
(2)
丛芽发生率=产生丛芽的愈伤组织数/已产生愈伤的外植体总数×100%
(3)
增殖系数=有效转接数/起始接种总数
(4)
生根率=产生不定根的单苗数/起始接种总数×100%
(5)
成活率=成活植株数/移栽植株总数×100%
(6)。
2 结果与分析
2.1 单因素试验结果及激素种类的选择
结果表明,在所有激素处理下川东獐牙菜的带叶茎尖生长均不好,基本无愈伤组织产生,仅有少量不定根出现,不宜作为川东獐牙菜离体培养材料。而各试验组中川东獐牙菜叶片和带芽茎段均能生长。其中,在试验组各水平中,叶片都能诱导出一定比例愈伤组织,且KT组诱导出的愈伤组织中有少量不定芽分化,而2,4-D组虽然能诱导愈伤组织发生,但质量较差、易老化;带芽茎段则适合在6-BA、NAA和IAA组中生长,在节上腋芽萌发后可见少量愈伤组织出现,但无不定芽分化。此外,IAA和NAA均有利于川东獐牙菜带芽茎段节上腋芽及不定根的生长,且NAA诱导效果尤佳。综合分析,选择6-BA、NAA和KT用于川东獐牙菜的离体培养。
2.2 直接器官发生途径
不同激素配比对川东獐牙菜腋芽诱导有显著影响(表2)。其中,第9组培养基中腋芽发生系数最高,与其他试验组相比差异显著,且腋芽发育正常。将川东獐牙菜带芽茎段接入该培养基(图1-A),培养14 d后腋芽迅速增长,次级腋芽大量增殖(图1-B),培养21 d后各级腋芽进一步生长(图1-C),培养30 d后腋芽生长旺盛,形成多枝多芽系统(图1-D),其腋芽发生系数可达4.06,增殖系数达3.67。上述结果表明,带芽茎段是川东獐牙菜离体培养较合适的外植体材料。
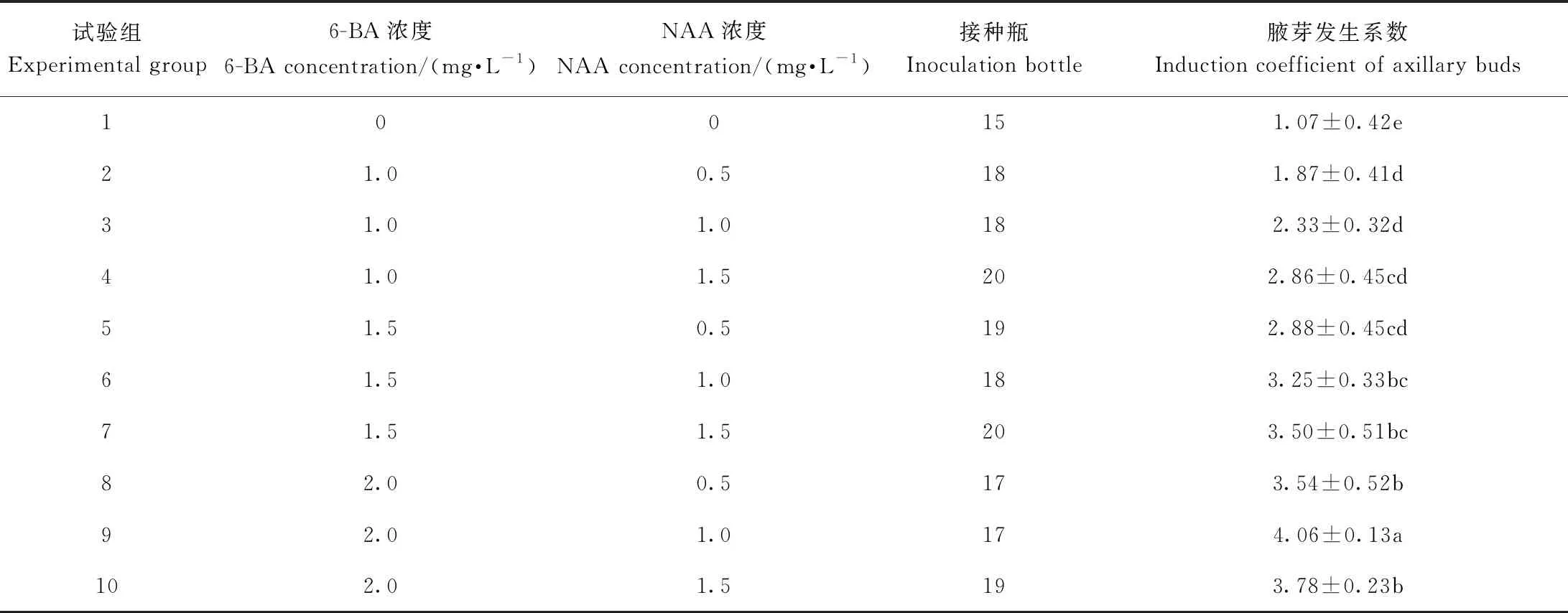
表2 不同激素组合对川东獐牙菜腋芽诱导的影响Table 2 Effect of different hormone combinations on the axillary buds induction in S. davidii

注:A:带芽茎段;B:培养14 d后腋芽;C:培养21 d后腋芽;D:培养30 d后形成多枝多芽系统。Note: A: Stem with buds. B: Axillary buds deriving from stem with buds in culture for 14 days. C: The growth of axillary buds in culture for 21 days. D: System of multi-branches in culture for 30 days.图1 川东獐牙菜带芽茎段诱导过程中的表型特征Fig.1 Phenotypic characteristics during the induction process of stem with buds in S. davidii
2.3 间接器官发生途径
愈伤组织诱导极差分析与方差分析结果显示(表3),RA>RC>RD>RB,表明6-BA是川东獐牙菜愈伤组织诱导最主要的影响因子,其次为KT;2个因素极差值均大于空白列,表明它们在愈伤组织诱导上效应可靠;而NAA极差值小于空白列,表明它对愈伤组织诱导的效应不可靠。方差分析(表4)表明,6-BA对诱导愈伤组织有显著性影响(P<0.05),KT和NAA则对对诱导愈伤组织无显著性影响(P>0.05)。结合极差和方差结果,可以不考虑NAA对川东獐牙菜叶片诱导愈伤组织的影响。Duncan检验(表5)表明,6-BA在3水平上较其他2个水平好,且有显著性差异(P<0.05)。根据平均值分析,川东獐牙菜叶片诱导愈伤组织的最佳激素组合为A3C3,即2.0 mg·L-16-BA+1.5 mg·L-1KT。
丛芽发生极差分析(表3)结果为RC>RA>RD>RB,表明KT是诱导丛芽发生最主要的影响因子,其次是6-BA和NAA;KT和6-BA的极差值均大于空白列,表明它们在丛芽发生上的效应可靠,NAA则不可靠。进一步方差分析(表4)可知,KT对丛芽诱导具有显著性影响(P<0.05),6-BA和NAA均对诱导丛芽无显著性影响(P>0.05)。Duncan检验(表5)表明,随着KT浓度升高,丛芽发生率增加,在水平3上影响显著高于水平1、2。由平均值分析可知,川东獐牙菜愈伤组织诱导丛芽发生的最佳激素组合为A2C3,即1.0 mg·L-16-BA+1.5 mg·L-1KT。
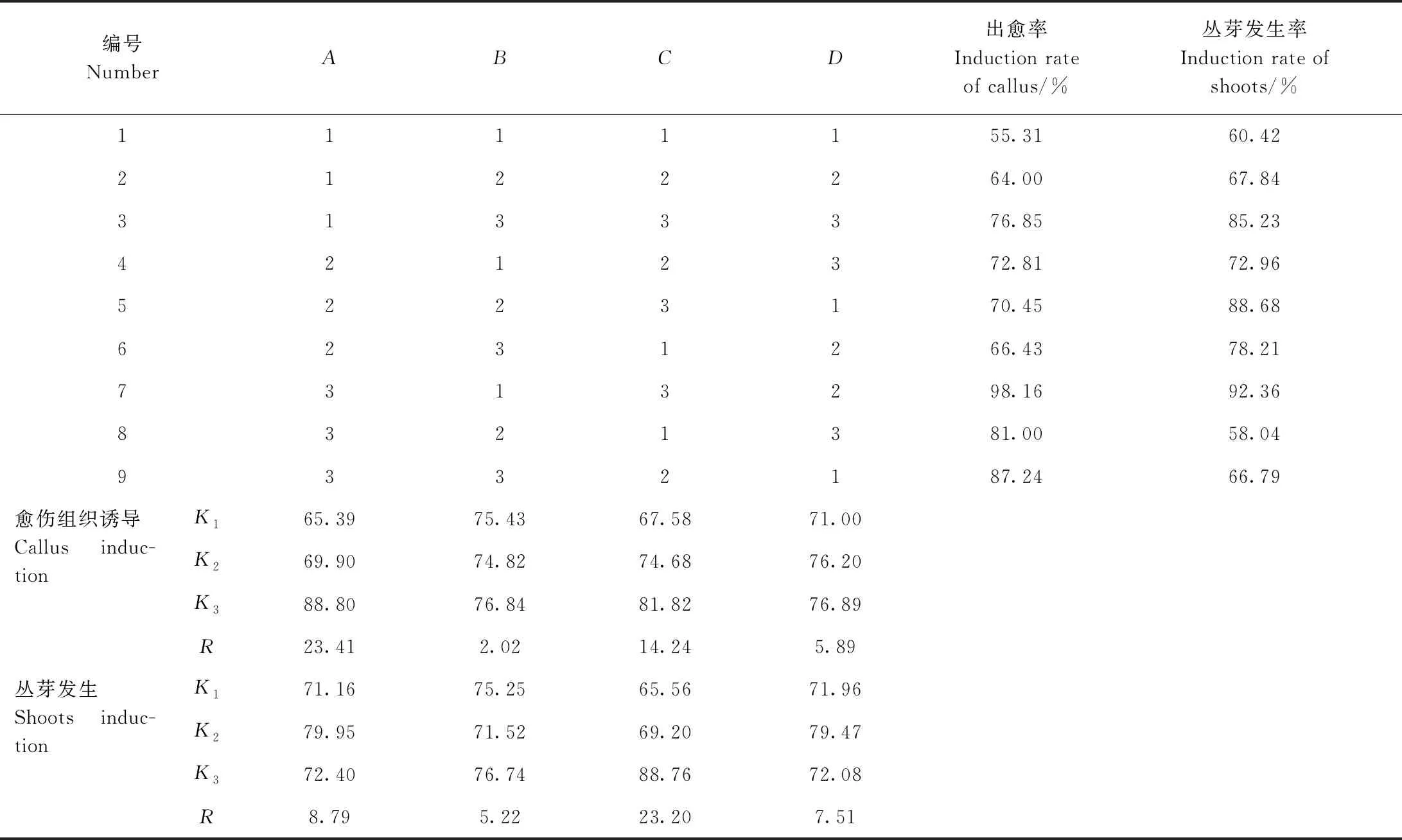
表3 川东獐牙菜愈伤组织诱导与丛芽发生L9(34)正交试验结果Table 3 Results of callus and shoots germination by L9 (34) orthogonal test in S. davidii
综合愈伤诱导率和丛芽发生率,考虑到愈伤组织为间接器官发生的关键阶段,故采用A3C3作为叶片愈伤组织诱导、不定丛芽分化和增殖同步进行的激素组合。在此培养基中,叶片培养7 d后切口处脱分化产生淡黄色愈伤组织,表面出现绿色芽点(图2-A);培养14 d后开始分化出不定芽(图2-B);培养21 d后不定芽迅速生长(图2-C);培养30 d后愈伤组织分化出大量丛芽,丛芽发生率达96.50%(图2-D)。将材料以5~6芽为单位切开并接入新鲜培养基中(图2-E),随着培养时间延长,丛芽不断增殖与生长(图2-F、G),培养30 d后获得大量丛芽,其增殖系数达到8.75(图2-H)。

表4 川东獐牙菜愈伤组织诱导和丛芽发生方差分析Table 4 Variance analysis of callus induction and shoots induction in S. davidii

注:A:愈伤组织;B:培养14 d后不定芽分化;C:培养21 d后不定芽生长与增殖;D:培养30 d后不定芽大量分化;E:培养转接丛芽; F:培养14 d后丛芽分化;G:培养21 d后丛芽分化与增殖;H:培养30 d后的丛生芽。Note: A: Callus. B: Adventitious shoots generated in culture for 14 days. C: Growth and proliferation of adventitious shoots in culture for 21 days. D: Abundant adventitious shoots were differentiated in culture for 30 days. E: Cluster shoots. F: Cluster shoots were differentiated in culture for 14 days. G: Growth and proliferation of adventitious shoots in culture for 21 days. H: Robust clustered-shoots in culture for 30 days.图2 川东獐牙菜愈伤组织诱导和丛芽增殖过程中的表型Fig.2 Phenotypic characteristics during callus induction and multiple-shoots proliferation in S. davidii
2.4 生根培养与炼苗移栽
在诱导不定根试验中(表6),对照组(0 mg·L-1NAA)生根率仅为23.40%,显著低于其他试验组,且分化出来的根短较细。在附加低浓度NAA的培养基上,川东獐牙菜生根率显著提高,其生长状况良好;当NAA浓度高于0.05 mg·L-1后,生根率随着NAA浓度的升高而逐渐下降。川东獐牙菜诱导生根的最佳配方为MS + 0.05 mg·L-1NAA,生根率达到100%,且显著高于其他处理。将生长健壮的单苗接入此培养基中,培养30 d后生根苗的根系粗壮且长(图3-A、B);炼苗后移栽成活率达90%以上(图3-C)。
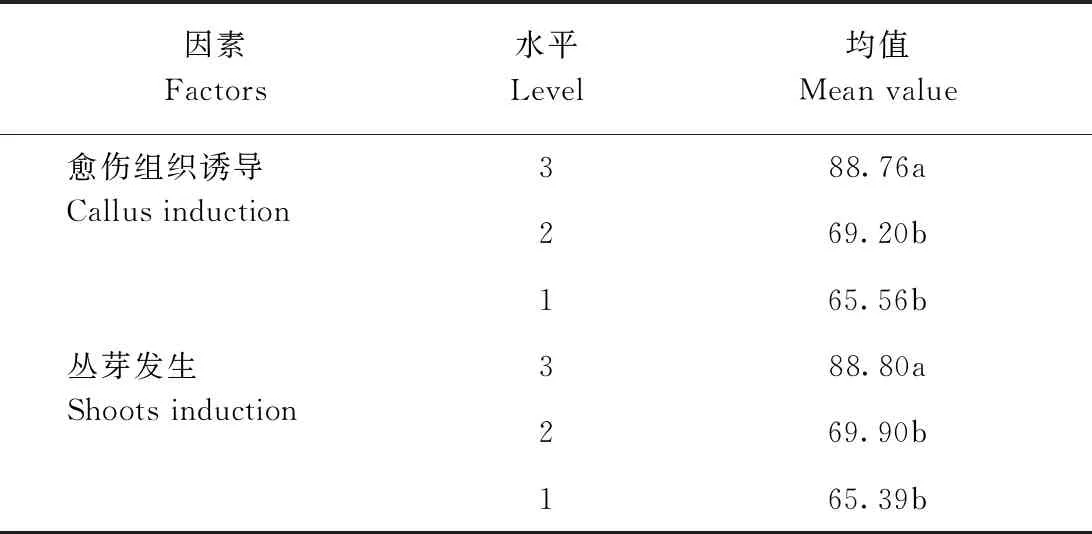
表5 不同浓度6-BA和KT的Duncan检验Table 5 Duncan’ test in different concentration of 6-BA and KT
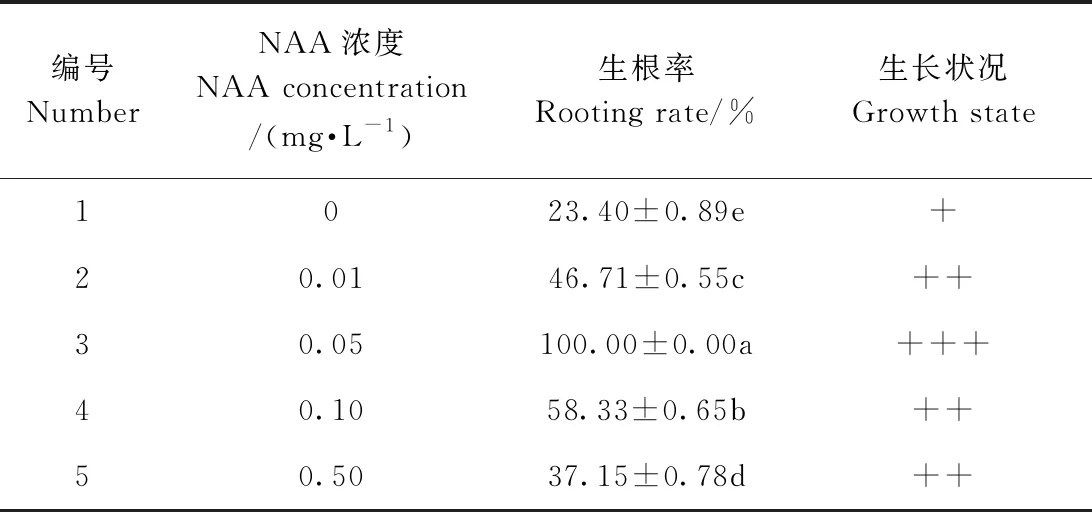
表6 不同NAA浓度对川东獐牙菜生根的影响Table 6 Effect of different NAA concentration on rooting of plantlets in S. davidii

注:A:培养30 d后生根苗;B:培养瓶底根系;C:培养30 d后移栽苗。Note: A: Rooting plantlets in medium after 14 days. B: Root system in bottom. C: Transplanting plantlets after 30 days.图3 川东獐牙菜生根培养及移栽Fig.3 Rooting culture and transplanting in S. davidii
3 讨论
3.1 川东獐牙菜不同外植体类型及其增殖途径
植物组织培养中,外植体类型是影响离体培养效果的主要因素之一。不同植物种类,甚至同一植物不同器官对外界诱导的反应及本身再分化能力均不同,因此不同外植体增殖方式与效果具有明显差异[7-9]。在龙胆科植物中有报道采用胚轴、叶片、茎段、茎尖和根等作为外植体,胚轴[10]、叶片[11-12]、根[13]主要通过间接器官发生途径再生;茎尖[14-15]则多以直接器官发生途径再生;带芽茎段[16-17]采用上述2种再生方式均有报道。本研究选取了3种外植体,其中带叶茎尖不宜作为川东獐牙菜外植体材料,估计其茎尖顶端优势较强,抑制腋芽发生,在培养过程仅生长点伸长最终形成不分支单株,达不到快繁的基数要求。
本研究发现带芽茎段适宜于直接器官发生途径,通过腋芽萌发和生长以“微扦插”方式进行繁殖,同时茎段基部切口处亦可产生少量质地疏松的愈伤组织。与青叶胆(S.mileensis)[17]不同,川东獐牙菜带芽茎段产生的愈伤组织无再分化能力,可能仅能增大外植体与培养基接触面积,从而有利于培养外植体更有效地获取营养。
叶片是川东獐牙菜间接器官发生途径的最佳材料。以叶片为外植体进行体外快繁的报道很多,大多为唇形科[18-19]、茄科[20-21]及蔷薇科[22-23]等草本或灌木植物,而通过叶片建立再生体系的獐牙菜属及整个龙胆科物种并不多见,推测与物种所处生境有关。川东獐牙菜主要分布在河谷两岸,气候湿润、多雨、多雾。这样的生境条件一方面导致叶片变厚,栅栏组织和海绵组织细胞排列疏松,组织间隙大;另一方面致使叶脉发达,其疏导水分的能力增加。因此,在外源激素刺激下,切口处叶脉周围薄壁组织极易转入脱分化状态并迅速增殖,产生的愈伤组织质地紧密、具很强再分化能力,一旦发生便很快分化出不定丛芽。本研究中,川东獐牙菜在此培养途径中,除了愈伤组织—不定丛芽增殖方式外,随着不定丛芽中3~5个主芽生长,各级腋芽也不断出现和生长,最后整个培养物形成一个既有基部不定丛芽又有多枝多芽的簇状丛生系统,其增殖系数远超过已报道的本属其他植物[17]。
3.2 川东獐牙菜不同外植体对外源激素的响应
外源激素对植物离体再生具有重要的调控作用,不同激素种类及其浓度水平在调控细胞脱分化、增殖和生长及形态建设等方面具有极其重要的影响[24-26]。本研究结果表明,在川东獐牙菜体外快速繁殖中,单因素、完全组合和正交试验结果都显示激素间配合使用所产生的培养效果明显高于单独使用,表明多种激素之间的协同作用远大于单独作用的效果。以带芽茎段为材料的培养中,附加较高浓度的6-BA有利于腋芽增殖,但对愈伤组织诱导和再分化基本无效果,似乎仅起到促进腋芽萌发和生长的作用;而在青叶胆[11]中,6-BA对其愈伤组织诱导和再分化具有显著效应。初步推断可能与川东獐牙菜生长地水源充足、气候潮湿有关,其植株茎段木质化程度较低、输导组织不发达,故对6-BA 不敏感,即使诱导出愈伤组织也无再分化能力。一般来说,以叶片为材料的培养中,细胞分裂素与生长素配合使用可以促进愈伤组织诱导、不定丛芽发生[27-28]。而本研究结果显示,6-BA和KT对川东獐牙菜愈伤组织诱导、不定丛芽发生和增殖均有显著效应,NAA的诱导效应并不明显;而在印度獐牙菜(S.chirayita)[29]、青叶胆[11]等同属植物的体外快速繁殖中,外源生长素却是诱导愈伤组织的重要因素。有研究指出,干旱胁迫是导致植物内源生长素含量低下的重要原因之一[30-32],本研究结果也验证了这一观点。川东獐牙菜的特殊生境使其植株,特别是叶片中内源生长素积累较多,造成外源生长素在其叶片离体繁殖中作用不显著;而其他已有报道的獐牙菜属植物生境均为少雨干旱,只能通过降低内源生长素水平,使生长速率减慢,从而保证植株完成正常生理活动,因而对外源生长素产生较强烈的响应。
4 结论
本研究优化了川东獐牙菜体外快速繁殖培养条件,成功建立了高效稳定的再生体系。其中,对于带芽茎段为材料的直接器官发生途径,尽管其培养周期长、繁殖系数较低,但能最大程度维持母本基因型,可用于种质资源保存、遗传转化等基础研究。以叶片为材料的间接器官发生途径,接种培养7 d后即可产生再分化能力极强的愈伤组织,培养14 d后便可产生不定丛芽,若及时将材料按5~6芽为单位切割,转接至新鲜培养基中,可无限繁殖,每代增殖系数均达8.75,且在以后的培养中,无需再从愈伤组织诱导开始,极大缩短了培养周期,实现了愈伤组织诱导、丛芽发生和增殖的同步进行,培养效率得到显著提高,可应用于工厂化大规模生产。
