儿童新发扩张型心肌病药物治疗后左心室逆重构发生率及预测因素
2020-12-03刘晓燕
潘 宇 刘晓燕
重庆医科大学附属儿童医院心血管内科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地 儿科学重庆市重点实验室(重庆 400014)
儿童扩张型心肌病(dilated cardiomyopathy,DCM)是一种以左心室或双心室扩大伴心脏收缩功能降低为典型特征的心肌病,临床主要表现为心力衰竭(简称心衰),可伴有心律失常,以及附壁血栓形成、脱落导致血栓栓塞及猝死[1]。儿童心内膜弹力纤维增生症(endocardial fibroelastosis,EFE)主要病理特点为心内膜弹力纤维增生及心内膜弥漫增厚,病变主要累及左心室、左心房,主要临床表现为心脏扩大及心衰。EFE 多发生于1 岁内婴儿,有学者认为EFE为DCM 的早期阶段[2-3]。新发扩张型心肌病(recent onset dilated cardiomyopathy,RODCM)是指心衰病史≤6个月的DCM[4]。目前DCM治疗仍以药物为主。近年对成人DCM 的研究发现,部分DCM 患者,尤其是RODCM 患者,经药物治疗后可以发生左心室逆重构(left ventricular reverse remodeling,LVRR),表现为左心室收缩功能伴左心室结构显著改善[4-5]。但目前对儿童DCM 发生LVRR 的研究较少。本研究分析儿童RODCM 药物治疗后LVRR 的发生率及预测因 素。
1 对象与方法
1.1 研究对象
以2012年2月至2018年11月在重庆医科大学附属儿童医院住院治疗及规律随访的55 例DCM、EFE患儿为研究对象。入选标准:①DCM 诊断符合2019年美国心脏协会(AHA)“儿童心肌病的分类和诊断科学声明”[1],左心室舒张末期内径Z值(left ventricular end-diastolic dimension z score,LVEDD-Z)>2,左心室射血分数(left ventricular ejection fraction,LVEF)<55%,左室短轴缩短分数(left ventricular fractional shortening,LVFS)<28%;②EFE 诊断符合《小儿心脏病学(第4 版)》中EFE 诊断标准[6]。排除标准:①先天性心脏病、肥厚型心肌病、限制型心肌病、心动过速性心肌病、左室心肌致密化不全、冠状动脉起源异常、心脏瓣膜疾病、心肌炎、川崎病、高血压、缺血性心脏病、酒精性心肌病、心包疾病、肺心病、神经肌肉性疾病和系统性疾病等可导致左心室扩大和收缩功能不全的疾病;②已知心衰病史或心脏扩大病史>6个月;③接受器械治疗的患儿,如心脏起搏器、植入型心脏复律除颤器或再同步化治疗者;④非心脏原因死亡病 例。根据LVRR 达标情况,将研究对象分为达到LVRR组与未达LVRR组。
1.2 方法
1.2.1 临床资料收集 患儿住院期间及出院后予药物治疗,并由门诊或电话随访至2020 年1月或死亡。收集患儿首次入院时(基线)的人口学资料、临床症状体征、DCM/EFE和猝死家族史、血液生化指标、胸片、心电图和超声心动图指标,随访患儿超声心动图。
1.2.2 心功能评估 采用改良ROSS评分标准。0~2分为心功能I级,3~6分为心功能Ⅱ级,7~9分为心功能Ⅲ级,10~12分为心功能Ⅳ级。
1.2.3 药物治疗 患儿确诊后即用标准药物治疗。急性心功能不全期选用静脉正性肌力药物(去乙酰毛花苷、磷酸二酯酶抑制剂、多巴胺、多巴酚丁胺)及利尿剂等治疗。临床症状缓解后改为口服药物长期维持,包括口服血管紧张素转换酶抑制剂(angiotensinconverting enzyme inhibitor,ACEI)、β受体阻滞剂、地高辛、醛固酮受体拮抗剂、利尿剂。EFE加用口服泼尼松片和/或静脉滴注人免疫球蛋白(IVIG)治疗。
1.2.4 超声心动图测量及Z 值计算 超声心动图估测肺动脉收缩压,根据右心房压力+4 V2计算(V 为三尖瓣反流最大速度)[7],肺动脉收缩压≥30 mmHg判断为肺动脉高压(pulmonary arterial hypertension,PAH)[6]。以超声心动图正常参考值为标准,用体表面积(body surface area,BSA)标准化后的Z 值判断心脏结构大小。计算方法为 Zscore=(M-x)/s,M为个体实测值,x为正常参考值中的样本均数,s为正常参考值中的样本标准差。BSA(m2)=0.0061×H(cm)+0.0128×Wt(kg)-0.152[7]。
1.2.5 LVRR 评价 随访时LVEF 较入院时提高≥10%且LVEF ≥55%,同时经BSA 标准化后的LVEDD-Z较基线降低≥10%且LVEDD-Z≤2。
1.3 统计学分析
采用SPSS 23.0进行统计分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验或配对t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2或校正χ2检验或Fisher精确概率法检验。影响LVRR的基线预测因素判定采用多元logistic回归分析法。生存分析采用Kaplan-Meier 法,以死亡为终点状态,两组间比较采用Log-rank 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
55 例患儿中DCM 13 例(23.6%)、EFE 42 例(76.4%);男16 例(29.1%)、女39 例(70.9%);中位发病年龄7 个月(范围23天~13岁2 个月)。EFE患儿发病年龄5 个月(范围23 天~3 岁),DCM 患儿发病年龄6 岁9 个月(范围2 个月~11 岁7 个月),两组差异有统计学意义(Z=4.45,P<0.001)。入院时心衰症状时间中位数15 天(范围1 天~6 个月),心功能Ⅱ、Ⅲ、Ⅳ级分别为20 例(36.4%)、29 例(52.7%)、6 例(10.9%)。入院时LVEF 为(35.6±7.7)%(范围20.0%~53.0%),LVEDD-Z 值9.4±2.8(范围2.86~18.29)。
2.2 药物治疗情况
55例患儿均使用ACEI、地高辛及螺内酯,使用β受体阻滞剂46例、利尿剂50例。42例EFE患儿均使用醋酸泼尼松口服,使用IVIG 21例。达到LVRR组与未达LVRR组相比,ACEI(100.0% 对 100.0%)、地高辛(100.0% 对100.0%)、螺内酯(100.0%对100.0%)、β 受体阻滞剂(88% 对 80%)、利尿剂(84.0%对96.7%)、醋酸泼尼松(100.0%对100.0%)以及IVIG(47.6%对52.4%)使用率的差异均无统计学意义(Fisher精确概率法,P=0.165~1.000)。
2.3 超声心动图随访结果
全体患儿超声心动图中位随访33 个月(范围1~85 个月)后(随访1 个月病例为死亡病例,非死亡病例均随访6个月以上),左室收缩功能指标LVEF较基线平均提高(22.8±12.0)%。87.3%(48/55)患儿LVEF 提高≥10%,60.0%(33/55)患儿LVEF 提高≥20%,30.9%(17/55)患儿LVEF 提高≥30%,70.9%(39/55)患儿随访LVEF ≥55%;左室结构指标LVEDD-Z较基线平均降低5.5±4.4,83.6%(46/55)患儿LVEDD-Z较基线降低≥10%,45.5%(25/55)患儿随访LVEDD-Z≤2。
随访结束时25 例(45.5%)患儿达到LVRR 标准,其中30.8%(4/13)DCM 患儿达到LVRR 标准,50.0%(21/42)EFE患儿达到LVRR标准。9.1%(5/55)患儿在1年内达到LVRR标准,23.6%(13/55)患儿在2年内达到LVRR标准,平均达标时间为(23.0±10.0)月(范围4~41个月)。达到LVRR的患儿LVEF由基线时的(37.1±7.4)%提高至随访时的(65.7±5.4)%(t=15.74,P<0.001),平均提高(28.6±9.1)%;LVEDD-Z 由基线时的9.5±3.0 降低至随访时的1.3±0.6(t=13.82,P<0.001),平均降低8.1±2.9。而30 例未达LVRR 患儿LVEF 较基线平均提高(17.9±12.1)%,LVEDD-Z较基线平均降低3.2±4.2。达到和未达到LVRR标准患儿的超声心动图随访时间分别为35个月(范围20~80个月)和24个月(1~85个月),差异无统计学意义(Z=1.55,P=0.124)。
2.4 预测因素分析结果
与未达LVRR 标准者比较,达到LVRR 标准者PAH的发生率及中重度三尖瓣反流的发生率均较低、血清白蛋白水平较高、丙氨酸转氨酶水平较低,差异均有统计学意义(P<0.05)。见表1。
单因素分析显示,无PAH、无中重度三尖瓣反流、血清白蛋白升高是达到LVRR的预测因素(P均<0.05)。多元logistic 回归分析显示,无中重度三尖瓣反流是RODCM患儿达到LVRR的独立预测因素(OR=9.75,95%CI:1.03~87.62,P<0.05)。见表2。
2.5 长期预后随访结果
全体RODCM 患儿临床中位随访43 个月(范围1~96 个月)后,5 例因心脏原因死亡,无心脏移植病例。随访结束时,入选患儿存活率为90.9%(50/55)。未达到LVRR 患儿的1 年存活率为86.7%,5 年存活率为82.1%,达到LVRR 患儿的1 年及5 年存活率均为100%。经log-rank 检验发现,达到LVRR 患儿的生存时间明显长于未达到LVRR 患儿(χ2=4.56,P=0.033)。见图1。随访结束时,DCM 患儿的1 年存活率为76.9%,5年存活率为69.2%,EFE患儿1年及5 年存活率均为97.6%,EFE 患儿生存时间明显长于DCM患儿,差异有统计学意义(χ2=9.64,P=0.002)。见图2。
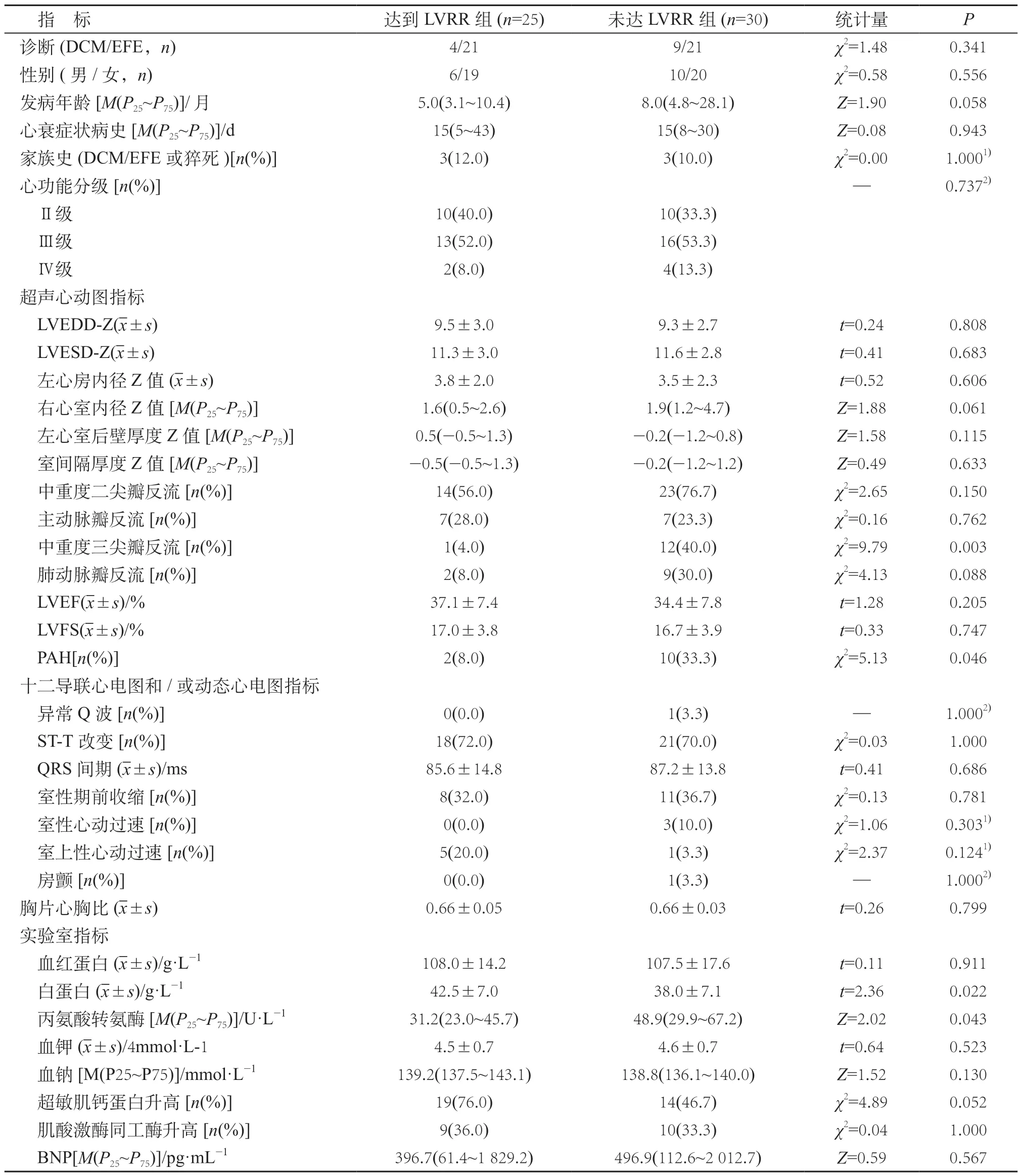
表1 达到与未达LVRR标准患儿基线资料比较

表2 影响RODCM患儿达到LVRR基线预测指标的logistic回归分析结果

图1 达到与未达到LVRR 标准患儿生存分析结果
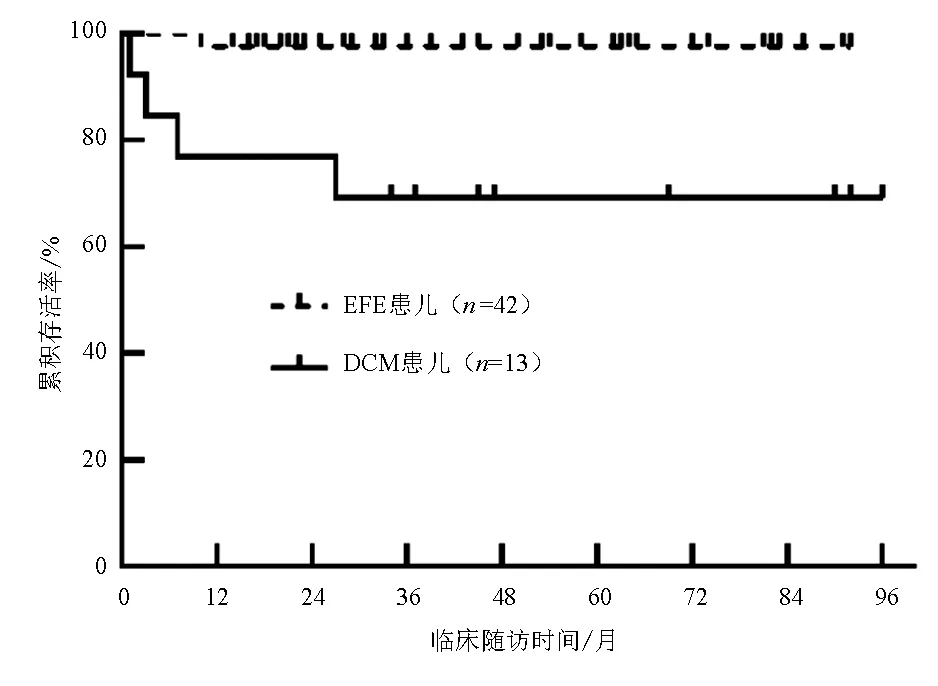
图2 EFE 与DCM 患儿生存分析结果
3 讨论
儿童DCM 和EFE 是一类以心室扩大及收缩功能障碍为主要特征的心肌疾病,通常预后差,病死率较高,是儿童行心脏移植的常见原因[8]。但有文献报道,部分儿童DCM经药物治疗后,LVEF及LVEDD可得 到改善,33%~39%患儿在长期随访中达到了超声心动图正常化[9-11]。本研究超声心动图随访33个月(范围1~85 个月)后发现,45.5%的儿童RODCM 达 到LVRR标准,LVEF及LVEDD均恢复正常。分析本研究LVRR发生率高的原因可能为:入选对象为心衰病史≤6个月的患儿,且均予以规范药物治疗并长期随访,同时采用BSA标准化后的Z值进行心脏结构的评估及设定LVRR标准,尽量消除了研究对象在年龄、体型、生长规律等方面的混杂因素。23.6%患儿在诊断后2年内达到LVRR标准,与文献报道基本相符[1,12]。
目前对儿童心肌病的分类标准尚存争议。1995年WHO/ISFC心肌病分类中将EFE列为未分类心肌病,2006 年AHA 提及EFE 是婴儿和儿童时期的DCM,2008年ESC制定的心肌病分类中未提到EFE的分类[2]。《实用小儿心脏病学》认为原发性EFE是婴儿DCM的一种[3]。2019年AHA“儿童心肌病的分类和诊断科学声明”中仍未提到EFE 的确切分类,但认为应首先采用心脏形态结构及功能的变化作为顶级分类依据[1]。本研究所纳入的EFE 患儿均表现为心室扩张伴收缩功能降低,故将其纳入DCM范畴。
本组EFE患儿基线左室心内膜厚度为(2.6± 0.7)mm,均伴有心内膜回声增强,随访时28例患儿心内膜厚度恢复正常,14 例患儿未见心内膜回声增强。EFE患儿治疗上除加用糖皮质激素及IVIG外,其余治疗同DCM患儿,均以ACEI、β受体阻滞剂、地高辛、醛固酮受体拮抗剂、利尿剂为标准药物治疗。本组EFE 患儿LVRR 发生率(50.0%)高于DCM 患儿(30.8%),但差异无统计学意义,可能与病例数较少有关。但EFE患儿的中位生存时间长于DCM患儿,多数学者亦认为EFE 长期预后优于DCM[2]。EFE 病因尚不明确,目前认为大多数病例与宫内病毒感染有关,机制为病毒直接持续损伤和病毒诱发的自身免疫介导的心肌组织损伤,并认为使 用免疫抑制剂治疗EFE有效[13]。本研究EFE 病例均加用糖皮质激素中长程疗法,病情稳定后小剂量长期维持,1/2 的EFE 患儿同时使用IVIG 抑制炎症反应,对EFE预后改善有益。相关研究回顾分析32 篇报道发现,DCM 发病年龄越小预后越好[14]。本研究EFE患儿中位发病年龄为5个月(范围23天~3 岁),明显小于DCM 患儿的6 岁9 个月(范围2 个月~11岁7个月),这可能与EFE长期预后较好有关。
基于741例儿童特发性DCM研究发现,LVEDD-Z、左心室收缩末期内径Z 值(LVESD-Z)、LVFS-Z 均与特发性DCM 患儿超声心动图恢复正常相关,其中基线LVEDD-Z 低是特发性DCM 患儿超声心动图恢复正常的独立预测因素[12]。另一项纳入175 例儿童DCM的研究发现,LVFS-Z是DCM患儿恢复正常的独立预测因素[9]。理论上讲,基线LVEDD-Z越低、LVEF或LVFS越高,提示左心室重构程度越低,LVRR的可能性越大[4]。但本研究显示,达到与未达到LVRR 标准的患儿相比,基线LVEDD-Z、LVESD-Z、LVEF-Z、LVFS-Z 差异无统计学意义,这可能与本研究对象为心衰症状病史≤6 个月的患儿,左室增大部分与心衰有关,也可能与样本量不够大有关。临床中LVEDD及LVEF仍是反映DCM患儿预后的重要指标。
本研究单因素分析提示,PAH、中重度三尖瓣反流与LVRR相关,多因素分析显示无中重度三尖瓣反流是RODCM 患儿发生LVRR 的独立预测因素。PAH及中重度三尖瓣反流均提示右心系统负荷增加。三尖瓣反流通常是由于右心室扩张后三尖瓣瓣环扩张和乳头肌移位导致[15],而在DCM 患儿中,右心室扩张是因左心室压力及容量超负荷传递导致,中重度三尖瓣反流间接提示左心室功能障碍程度重,故LVRR的可 能性小。文献报道,中重度二、三尖瓣或肺动脉瓣反流与儿童DCM患儿死亡相关,但未提及与LVRR的关系[14,16]。成人研究报道,三尖瓣反流患者手术治疗后可发生右心室逆重构,少数患者可发生LVRR,强调了三尖瓣闭合对心脏逆重构病理生理过程的有益影响[15,17]。在DCM 患儿中右心衰、继发性瓣膜改变应得到重视。
本研究单因素分析还显示,血清白蛋白与LVRR相关。研究发现低白蛋白提示心衰患儿预后差,是心衰患儿死亡率增加的独立危险因素[18]。心衰患儿的低白 蛋白状态可能与容量超负荷引起血液稀释、右心衰 致肝脏淤血、慢性炎症、营养不良和恶病质有关,而白蛋白对维持胶体渗透压和微血管完整性有重要作用[19]。低白蛋白可导致血管内胶体渗透压降低而促进水钠潴留、加重循环充血及心脏负荷,不利于LVRR,临床中需密切监测血清白蛋白水平。PAH、三尖瓣反流、低白蛋白均与右心衰相关,DCM患儿主要发生左心结构功能改变,但不能忽视右心系统改变伴有右心室功能不全的患儿可加重疾病的严重程度[8]。
本研究表明,近1/2 儿童RODCM 经药物治疗后可发生LVRR,表现为LVEDD 及LVEF 均恢复正常。PAH、中重度三尖瓣反流、血清白蛋白水平与RODCM 患儿LVRR 相关,其中无中重度三尖瓣反流是RODCM 患儿发生LVRR 的独立预测因素。发生LVRR 患儿长期预后明显优于未发生LVRR 者。本研究的局限性在于研究对象来自单中心、样本量不够大、随访时间不够长,尚需要多中心、大数据、长期的随访研究进一步证实。
