基底节区生殖细胞瘤7例临床分析
2020-12-03姚春美邓亚仙王雅洁高丽梅高宝勤
姚春美 邓亚仙 王雅洁 高丽梅 高宝勤
1.首都医科大学附属北京天坛医院儿科(北京 100070);2.北京市大兴区人民医院(北京 102600)
基底节区生殖细胞瘤(basal ganglia germinoma,BGC)是一类较为少见的颅内肿瘤,好发于儿童及青少年。由于早期BGC 临床症状与影像学检查常缺乏特异性表现,易致误诊误治。生殖细胞瘤对放射线高度敏感,早期治疗可达到临床治愈,延误治疗时间常导致不同程度的后遗症[1-2]。本研究分析7例BGC患儿的临床和影像学特点,明确BGC的临床特征,以提高对疾病的认识。
1 临床资料
收集自2017年1月至2019年12月收治的经立体定向活检组织病理学检查确诊的7 例BGC 患儿的临床资料。7例患儿中,男性6例、女性1例,中位年龄10岁8 个月(范围7 岁10 个月~13 岁5 个月),自发病到确诊的中位时间3个月(范围1~19个月)。
7 例患儿中,除1 例以不自主运动起病外,其余6例均以偏侧肢体无力起病,呈进行性加重。病程短者以偏侧肢体无力为唯一表现;2 例累及双侧基底节者出现智力倒退;2 例病史超过1 年者同时合并构音障碍,其中1例病程19个月者随着病程的进展出现吞咽困难、尿崩症、便秘和情绪改变。7例患儿中,3例既往诊断为脱髓鞘病(其中1 例因有头部外伤史曾诊断为脑外伤后遗症),2例诊断为基底节梗塞,1例累及双侧基底节者诊断为甲状腺功能减退症和线粒体脑肌病,1例诊断为胶质瘤。
除1 例患儿未行肿瘤标志物检测外,其余6 例行血清甲胎蛋白(AFP)和β-人绒毛膜促性腺激素(β-hCG)检测,结果均阴性。除1 例患儿外,其余6例送检脑脊液AFP、β-hCG、24小时鞘内IgG合成率(IgG-Syn)和特异性寡克隆区带(specific oligoclonal bands,SOB),6 例24 小时鞘内IgG 合成率、AFP 和β-hCG均阴性,5例脑脊液SOB阳性或弱阳性。见表1。
7例患儿均行影像学检查。5例患儿瘤体位于单侧基底节,2例累及双侧基底节;6例有肉眼可见的病灶侧大脑脚萎缩,环池增宽;5例出现肉眼可见的病灶侧皮层萎缩,表现为同侧脑沟、侧裂池增宽;2例病灶可见出血征象,2例病灶可见钙化,仅1例出现囊变。7例患儿的病灶强化不明显,增强扫描时,仅3例表现为小片状或点状强化影。1例患儿行磁共振波谱(MRS)检查,表现为N-乙酰天门冬氨酸(N-acetyl aspartic acid,NAA)明显降低,胆碱(CHO)明显升高,CHO/NAA比值>2。见图1。
7 例患儿于明确诊断前用激素、维生素类和营养神经药物,也有用丙种球蛋白(HGG)治疗;其他最常见治疗方式是康复治疗。所有患儿均因病情无好转或进行性加重,明确诊断后进一步行放疗或化疗。
2 讨论

图1 BGC 患儿双侧基底节受累的影像学表现
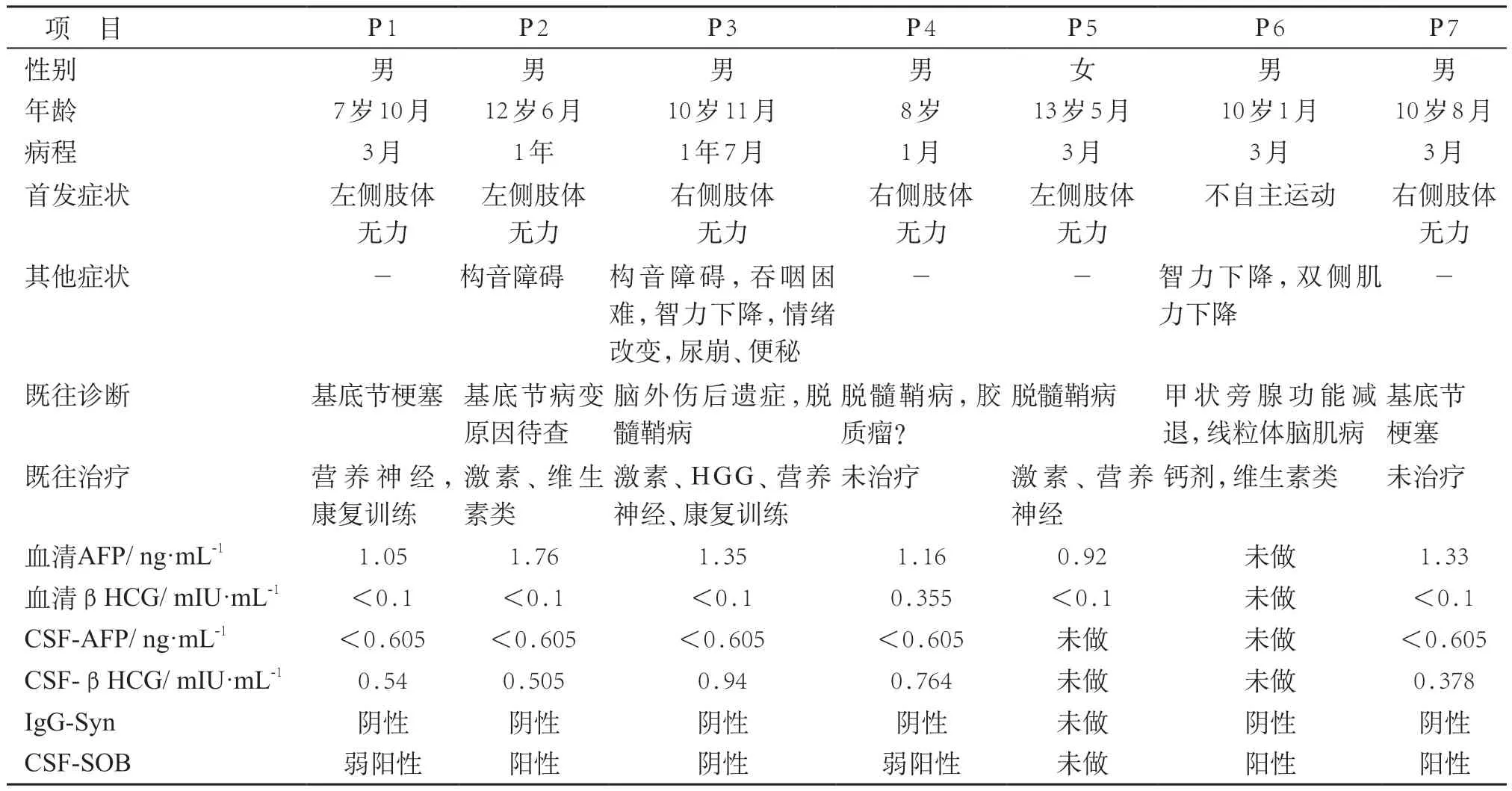
表1 7例患儿临床资料
BGC 以男性多见,研究显示,生殖细胞瘤男女发病率之间有差异约为5:1~30:1[3-8]。由于跨经基底节区的运动感觉通路受损,所以BGC最常见的表现为缓慢进行的偏侧肢体无力,其他表现有不自主运动、认知能力下降、语言障碍、性格改变等[1,3,6-7,9]。不同研究显示,以偏侧肢体无力起病者约占1/3~2/3[1,3,6,8]。本组患儿中除1 例以不自主运动起病外,其余6 例均以偏侧肢体无力起病,比例高于文献报道,可能与本组病例数较少有关。研究显示,认知功能减退更常见于双侧基底节病变患者[10-11]。本组患儿中2例智力减退者也为双侧基底节受累,其机制不明,考虑与损伤皮层有关。BGC起病方式隐匿,在出现症状前多有影像学改变,如P3患儿起病半年前曾因头部外伤行CT检查发现,基底节和同侧大脑脚已有萎缩表现,而患儿无任何肢体无力的症状。
传统上凡是生殖细胞来源的肿瘤统称为生殖细胞肿瘤,包含6大类:生殖细胞瘤、胚胎癌、内胚窦瘤、绒毛膜上皮癌、畸胎瘤和混合性生殖细胞肿瘤,以生殖细胞瘤最为常见。肿瘤标志物的产生与肿瘤成分密切相关,不同组织成分产生的标志物不同,如绒毛膜上皮癌中的合胞体滋养层产生促性腺激素,内胚窦瘤产生AFP,胚胎癌含有合胞体滋养层和内胚窦成分,因此具有促性腺激素和AFP两种标记物,仅胎盘碱性磷酸酶(PLAP)升高应考虑为生殖细胞瘤[12]。根据不同肿瘤成分所生成的标志物,生殖细胞肿瘤的常用标志物有PLAP、AFP 和β-hCG,在血清和脑脊液中均可检测到。受取材部位和大小的限制,肿瘤标志物甚至比病理检查结果要准确[12-13]。本组7例患儿AFP和β-hCG均在 正常范围,故考虑为单纯生殖细胞瘤,遗憾的是均未行PLAP检测,由于肿瘤成分不同,产生的标志物不同,不是所有的生殖细胞肿瘤都会出现AFP和β-hCG升高。
BGC 好发于左侧,占位效应及瘤周水肿不明显,可有囊变和钙化,同侧大脑半球萎缩伴大脑脚萎缩是BGC 的特征性表现[7,8,14-16]。本组7 例患儿影像学特点基本与之相符。
对于青春期前后的男性患者,出现隐匿起病缓慢进展的偏侧肢体无力,结合影像学特征如基底节萎缩、囊变、钙化及大脑半球和大脑脚萎缩等,应警惕BGC 可能[15-16]。故掌握其临床表现和影像学特点对BGC的诊断至关重要。虽然立体定向脑活检组织病理学检查是确诊颅内肿瘤的金标准,但是由于组织学检查受取材部位的影响,有可能遗漏一些有分泌功能的恶性细胞成分,所以需要结合肿瘤标志物检测[12-14]。生殖细胞瘤的特点是对放射线高度敏感,小剂量放疗后肿瘤可消失50%以上,且不良反应较少,诊断不清无法行脑活检时,可予诊断性放疗辅助诊断[8]。
BGC发病率低,尤其是早期临床表现和影像学特点不典型,主要应与以下疾病相鉴别。①特发性炎性脱髓鞘病:本症是一大类疾病,是指免疫因素介导的脑白质脱髓鞘改变,鞘内IgG合成是其重要的免疫学表现,脑脊液SOB是判定IgG鞘内合成的重要定性指标,是诊断脱髓鞘病的一项重要指标。本研究中多例患儿脑脊液SOB 阳性是导致误诊为脱髓鞘病的主要原因。在正常情况下,免疫系统对中枢神经系统的成分不识别,中枢神经系统是“免疫豁免区”。BGC患者之所以呈现阳性,推测可能是肿瘤发生时,血脑屏障破坏,免疫活性细胞进入,肿瘤细胞释放抗原刺激B细胞增殖产生特异性IgG,从而导致SOB 阳性,但具体机制仍待进一步研究。药物治疗是区别脱髓鞘病和BGC 的试验性诊断方法,一般BGC 对激素治疗不会有明显效果,且病灶很少缩小,但脱髓鞘病对激素治疗反应较好,本组几例应用激素的患儿也是因临床效果欠佳而就诊于我院进一步诊疗。两者主要鉴别点除对激素的反应性不同外,临床表现及影像学表现也有一定差异。一般情况下,BGC起病及病情进展相对缓慢,症状较轻或较少,而脱髓鞘病临床表现相对丰富,以精神和认知功能受累为多,早期肢体无力及感觉缺失较BGC更为明显[17]。影像学表现中脱髓鞘病在CT上呈低密度表现,而BGC可因囊变、出血、钙化,从而呈现一定的高信号特点;MRI增强扫描时在脱髓鞘病常可见到“开环样”强化,且强化随着病程的进展越来越不明显,而BGC多为点状或片状强化,随着病程的进展强化越来越明显[17]。②胶质瘤:基底节区肿瘤以胶质瘤和生殖细胞肿瘤最为常见,生殖细胞肿瘤发病年龄小于胶质瘤,男性更多见,影像表现上囊变概率更大,水肿比胶质瘤轻,BGC 常见华勒变性,后者为病变累及皮质脊髓束所致,极少见于胶质瘤[7,18]。并且神经胶质瘤多位于丘脑累及基底节区,而BGC则主要位于基底节区而累及丘脑,这一细微区别对于两者的鉴别诊断非常重要,BGC除非肿瘤巨大否则病变的占位效应不明显,这是BGC 和胶质瘤的重要区别之处[14]。③鉴于BGC的起病部位、临床表现和影像学易出现囊变、钙化等,还需要与基底节梗塞、肝豆状核变性、甲状旁腺功能减退、线粒体脑肌病等疾病相鉴别,根据不同疾病的起病方式、临床表现、实验室检查和特征性的影像学检查结果等一般不难鉴别。
