白细胞介素-7 促进原发性肾病综合征患儿外周血CD14+单核细胞活性
2020-12-03冯仕品
刘 君 冯仕品
电子科技大学医学院附属妇女儿童医院 成都市妇女儿童中心医院儿童肾脏内科(四川成都 610017)
儿童原发性肾病综合征(idiopaticnephrotic syndrome,INS)是多种病因造成的肾小球基底膜通透性增高,导致蛋白从尿中排出,表现为大量蛋白尿、低蛋白血症、水肿、高脂血症及其他代谢紊乱[1]。INS的病因尚未完全阐明,目前认为免疫系统功能失调、系统性循环因子异常分泌、肾脏足细胞遗传性结构异常等因素均参与了INS发病[1-2]。在非遗传因素中,多种免疫细胞和细胞因子功能失调所造成的免疫紊乱是INS的重要诱因之一[3]。白细胞介素-7(interleukin-7,IL-7)主要通过IL-7受体α链(即CD127)发挥作用,IL-7/CD 127 信号通路调控并维持免疫细胞分化、发育和增殖,在感染、肿瘤、自身免疫性疾病中发挥重要作用[4]。IL-7还可增强肺癌患者CD14+单核细胞的抗原提呈功能,诱导CD4+T细胞活化[5]。既往研究发现,激素敏感型INS患儿血清IL-7水平升高,且与机体凝血功能密切相关[6-7]。但有关IL-7对INS患者免疫细胞的调节作用尚未见相关报道。因此,本研究利用体外细胞培养系统,观察IL-7对INS患儿CD14+单核细胞活性的影响,初步探讨IL-7在INS发病中的作用。
1 对象与方法
1.1 研究对象
选择2019年1月—2019年7月在成都市妇女儿童中心医院儿童肾脏内科住院的INS患儿。研究对象入选标准:①年龄<16岁;②诊断符合中华医学会儿科学分会肾脏病学组2016年指南[8],即24 h尿蛋白定量>50mg/(kg·d),血清胆固醇>5.7 mmol/L,血清白蛋白<30 g/L;③未经糖皮质激素治疗;④排除慢性病毒感染、自身免疫性疾病、糖尿病、恶性肿瘤、重要脏器功能衰竭等疾病。选择同时期在本院体检中心接受健康查体的儿童作为对照组,入选标准:①年龄<16岁;②体检健康,无遗传代谢性疾病;③近半年内无其他疾病史。
本研究方案通过成都市妇女儿童中心医院伦理委员会批准,入组患儿法定监护人签署知情同意书。
1.2 方法
1.2.1 外周血单个核细胞分离 清晨空腹采集外周静脉血20 mL,EDTA 抗凝。使用人外周血淋巴细胞分离液(北京索莱宝公司)、采用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),调整细胞浓度至2×107个/mL,加入含10%DMSO的胎牛血清(fetal bovine serum,FBS),液氮冻存备用。
1.2.2 CD 14+单核细胞和CD 4+T 细胞分选和培养 采用磁珠分选法、使用人CD 14 MicroBeads(德国美天旎公司)和人CD4+细胞分选试剂盒(德国美天旎公司)对PBMC中CD14+单核细胞和CD4+T细胞进行分选,操作按说明书要求进行。分选的细胞使用含10% FBS的RPMI 1640于37 ℃、5%CO2条件下进行培养。从33 例INS 组中选取10 例INS 患儿分选的105个CD14+单核细胞,接种于96孔板,设立4个复孔,其中2 个复孔加入培养液,另外2 个复孔加入重组人IL-7(25 μg/L,美国Peprotech公司)刺激培养,12h后收集培养上 清。
1.2.3 CD 14+单核与CD 4+T 细胞共培养系统建立 选择17 例INS 患儿和7 例对照组纯化的CD 14+单核细胞,加入的重组人IL-7(25 μg/L)刺激培养12h,洗涤后建立间接接触和直接接触共培养系统[9]。间接接触培养系统:两种细胞以1:1的比例分别接种于Transwell培养平板上层小室与下层培养孔中,向下层培养孔中加入抗CD3抗体(1 μg/L)。直接接触培养系统:两 种细胞以1:1的比例直接混合,加入抗CD3抗体(1 μg/L)。将CD4+T细胞单独培养作为对照,培养48 h后收集细胞。另取8例INS患儿CD14+单核细胞 与自体CD 4+T细胞建立直接接触共培养系统,向培养液中加入抗人IL-6 中和抗体(20 ng/mL,美国Invi vogen公司),培养最后12 h加入布雷非德菌素A(10μg/mL)。
1.2.4 CD 127 表达以及CD 4+T 细胞分泌 干扰素-γ(IFN-γ)和IL-17的检测采用流式细胞术检测。PBMC 使用抗人CD-14-FITC 和抗人CD 127-PE 染色,4 ℃避光孵育30 min。CD14+单核细胞与CD4+T细胞 共培养的细胞加入抗人CD 4-PerCP 4 ℃避光孵育30 min,破膜后加入抗人IFN-γ-APC和抗人IL-17-PE,4 ℃避光孵育20 min。流式抗体购自美国BD公司。使用FACS Calibur流式细胞仪(美国BD公司)获取细胞,FlowJo10.6软件分析结果。
1.2.5 CD 14+单核细胞CD 127 mRNA 检测 采用实时定量PCR 进行检测。105个CD 14+单核细胞使用RNA提取试剂盒(德国Qiagen公司)抽提总RNA,取1 μg 总RNA,使用PrimeScript 反转录试剂盒(北京宝日生物技术有限公司)进行反转录,-20 ℃保存cDNA。使用TB Green实时定量PCR试剂盒(北京宝日生物技术有限公司)进行PCR 反应。引物序列为,①CD 127 上游:5’-AAA GTT TTA ATG CAC GAT GTA GCT T-3’;CD127下游:5’-TGT GCT GGA TAA ATT CAC ATG C-3’。②GADPH上游:5’-GCA CCG TCA AGG CTG AGA AC-3’;GAPDH下游:5’-TGG TGA AGA CGC CAG TGG A-3’。每个样本做3个重复,在ABI 7500实时定量PCR仪(美国Applied Biosystem公司)上进行检测。
1.2.6 培养上清中细胞因子表达检测 采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测。使用ELISA 检测试剂盒检测血清IL-7 水平、培养上清IL-1β、IL-6、IL-8、IL-12、IL-18、人单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和人肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。所有ELISA试剂盒均购自美国eBioscience公司,操作按说明书要求进行。
1.3 统计学分析
使用SPSS 17.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,多组间比较采用裂区设计资料的方差分析或单因素方差分析,存 在差异后进一步两组间比较采用SNK-q检验,两组 间比较采用两独立样本t检验或配对t检验;非正态分布计量资料以中位数(四分位数范围)表示,组间比 较采用Wilcoxon 秩和检验。计数资料以百分比表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
共纳入INS组患儿33例,男23例、女10例,年龄3.0~13.0 岁,平均年龄(6.9±2.9)岁,发病时间7.0~30.0 d,平均病程(20.0±8.0)d,24 h 尿蛋白(4.1±1.8)g,血清白蛋白(20.0±6.0)g/L,胆固醇(6.8±1.4)mmol/L。其中24 例表现为单纯型,9 例表现为肾炎型。对照组15 例,男11 例、女4 例,年龄4~14岁,平均年龄(7.9±2.5)岁。两组性别构成、年龄、身高、体质量、体质指数比较差异均无统计学意义(P>0.05)。见表1。
2.2 血清IL-7及CD14+单核细胞中CD127表达
INS 患儿血清IL-7 水平高于对照组,差异具有统计学意义(P<0.05)。见表1。CD 14+单核细胞中CD 127 平均荧光强度(mean fluorescence intensity,MFI)的典型流式图检测见图1。
CD14+单核细胞中CD127 MFI和mRNA的相对表达量在对照组和INS患儿之间的差异均无统计学意义(P>0.05)。见表1。

表1 对照组和INS患儿一般情况、血清IL-7及CD14+单核细胞中CD127表达比较

图1 CD14+单核细胞中CD127 平均荧光强度典型流式细胞检测图
2.3 IL-7对CD14+单核细胞分泌炎症细胞因子影响
经IL-7 刺激的CD 14+单核细胞分泌IL-1 β、IL-6、IL-8、MCP-1和TNF-α的水平高于无IL-7刺激的CD 14+单核细胞,差异有统计学意义(P<0.05)。见表2。
2.4 IL-7刺激对CD14+单核细胞诱导的CD4+ T细胞活化的影响
使用IL-7 刺激CD 14+单核细胞后,分别建立CD 14+单核细胞与自体CD 4+T 细胞间接接触和直接 接触共培养系统,CD 4+T 细胞单独培养为对照组。培养48 h后检测CD4+T细胞分泌IFN-γ(Th1细胞) 和分泌IL-17(Th17细胞)的比例,典型流式散点图见图2。
采用裂区设计的方差分析对INS 分选细胞和对照组分选细胞中Th1和Th17细胞比例的差异进行分析。培养方法作为一级处理因素,是否加入IL-7作为二级处理因素。INS分选细胞中,培养方法和是否加入IL-7两因素的交互作用有统计学意义(FA×B=15.79、11.09,P<0.001),直接接触培养中Th 1 和Th 17 细胞比例均高于间接接触培养系统(FA=50.67、34.94,P<0.001),IL-7 对Th 1 和Th 17 细胞比例有影响(FB=23.68、17.27,P<0.001)。进一步分析发现,在间接接触培养系统中,无IL-7刺激和经IL-7刺激Th1和Th17细胞比例与CD4+T细胞单独培养的差异均无统计学意义(P>0.05),在直接接触培养系统中,Th1和Th 17 细胞比例均显著高于CD 4+T 细胞单独培养(t=5.226、3.934,P<0.01);经IL-7 刺激后,Th 1 和Th17细胞比例显著高于无IL-7刺激(t=3.544、3.548,P<0.01)。见表3。对照组分选的细胞中,培养方法和是否加入IL-7 两因素的交互作用有统计学意义(FA×B=4.281、3.358,P<0.05),直接接触培养中Th1和Th17细胞比例均高于显著高于间接接触培养系统(FA=14.82、7.934,P<0.01),IL-7对Th1和Th17细胞比例有影响(FB=3.814、5.638,P<0.05)。在直接接触培养系统中,经IL-7刺激后,Th1和Th17细胞比例显著高于无IL-7刺激(t=3.999、4.150,P<0.01)。见表3。
2.5 抗IL-6抗体对IL-7介导INS患儿CD14+单核细胞诱导CD4+ T细胞活化的影响
表2 IL-7刺激对INS患儿CD14+单核细胞分泌细胞因子影响(,pg·mL-1)

表2 IL-7刺激对INS患儿CD14+单核细胞分泌细胞因子影响(,pg·mL-1)

图2 典型流式细胞检测图
INS患儿CD14+单核细胞在IL-7刺激后,与自体CD 4+T 细胞直接接触共培养,并向培养液中加入抗人IL-6中和抗体。
无刺激组、经抗IL-6 刺激组、经IL-7 刺激组、经IL-7+抗IL-6刺激组4组之间Th1比例差异有统计学意义(F=3.67,P<0.05)。两两比较发现,经IL-7 刺激组Th1比例均高于无刺激组和经IL-7+抗IL-6刺激组(P<0.05)。见表4。
3 讨论
IL-7 在感染、肿瘤和自身免疫性疾病中均发挥重要的免疫调控作用,通过CD 127 介导的信号通路增强CD 8+T 细胞杀伤功能,促进病原体和肿瘤细胞的清除[10-11]。人类免疫缺陷病毒慢性感染患者接受IL-7治疗可降低血浆可溶性CD14表达,提示IL-7可降低机体系统性炎症[12]。相反,IL-7外显子5缺陷基因编码的蛋白刺激可诱导CD 14+单核细胞促炎因子表型,增加脂类代谢相关基因表达[13]。本研究发现,INS患儿外周血IL-7表达升高,这与既往的研究结果一致[6-7]。但IL-7对INS患儿CD14+单核细胞调控作用的研究较少。本研究发现,CD14+单核细胞表面的模型CD127蛋白和总CD127(模型和可溶型)mRNA相对表达量在对照组和INS患儿之间的差异无统计学意义,与在肝癌患者中的研究结果一致[14],提示炎症和肿瘤均未改变单核细胞中CD127的表达,INS患儿CD14+单核细胞对IL-7的反应性升高与CD127水平无关。而IL-7刺激可促进INS患儿CD14+单核细胞分泌炎症细胞因子,提示INS患儿中升高表达的IL-7可增强CD14+单核细胞促炎功能,诱导INS病程中的炎症应答,促进疾病进展。
在类风湿性关节炎患者中,CD 14+单核细胞可诱导CD 4+T 细胞活化的过程依赖两种细胞的直接接触[5]。本研究发现,CD14+单核细胞在间接接触共培养系统中不能诱导Th 1 和Th 17 的表型活化,仅在CD 14+单核细胞和CD 4+T 细胞直接接触的条件下,CD 14+单核细胞才能有效介导INS 患儿CD 4+T 细胞 向Th 1 和Th 17 细胞的活化,这与既往的研究结果一致[5,9,15]。提示CD14+单核细胞主要通过其抗原提呈功能诱导CD 4+T 细胞活化,但细胞因子分泌在这一过程中是否发挥作用尚不清楚。由于IL-7主要通过促进IL-6分泌诱导病毒特异性CD8+T细胞和滤泡辅助性T 细胞的活性[10,16],而本研究发现,在INS 患儿中,IL-7均可增强CD14+单核细胞诱导的CD4+T细胞活化,说明IL-7可促进CD14+单核细胞功能。而抗IL-6中和抗体可抑制IL-7诱导的CD14+单核细胞对CD4+T细胞的调控作用,提示在INS患儿中,CD14+单核细胞对CD4+T细胞的调控作用亦有赖于IL-6的分泌。然而本研究具有一定局限性,未设立治疗前后INS 患儿的对比,因此,IL-7 对INS 患儿CD 14+单核细胞的调控机制仍有待深入探讨。
综上,INS 患儿升高表达的IL-7 可促进CD 14+单核细胞分泌炎症细胞因子,IL-7 刺激的CD 14+单核细胞可能通过直接接触和分泌IL-6 诱导INS 患儿CD4+T细胞活化,提示IL-7可增强CD14+单核细胞的功能,在INS 中发挥促进炎症影响、诱导疾病进展的作用。
表3 IL-7刺激对INS患儿CD14+单核细胞诱导Th1和Th17细胞活化影响(,%)
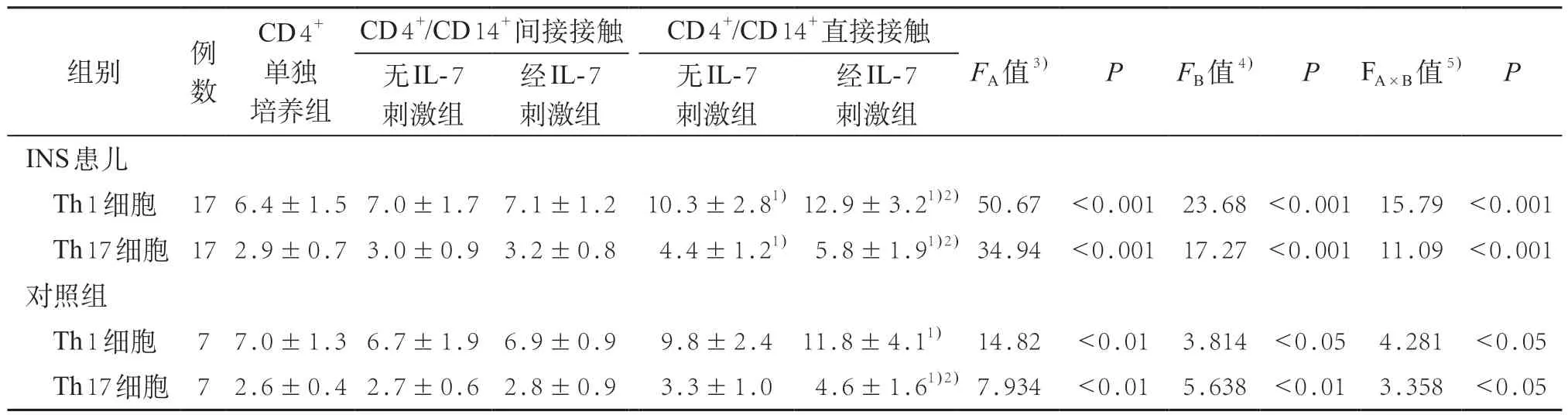
表3 IL-7刺激对INS患儿CD14+单核细胞诱导Th1和Th17细胞活化影响(,%)
注:1)与CD4+单独培养比较,P<0.05;2)与CD4+/CD14+直接接触无IL-7刺激比较,P<0.05;3)一级处理因素;4)二级处理因素;5)一级处理因素和二级处理因素的交互作用
表4 抗IL-6抗体对IL-7介导的CD14+单核细胞诱导Th1/Th17活化影响(,%)

表4 抗IL-6抗体对IL-7介导的CD14+单核细胞诱导Th1/Th17活化影响(,%)
注:1)与无刺激组比较,P<0.05;2)与经IL-7刺激组比较,P<0.05
