Fe3O4@ZIF-67分散微固相萃取法测定水中青霉素类抗生素
2020-12-03李彦妮胡艳云陈文军金忠秀
李彦妮,胡艳云,2,陈文军,金忠秀
由于食品与水中的青霉素类抗生素(penicillins, PCs)残留可能会带来健康风险[1-3],因此有必要对其进行检测。由于PCs在食品及水中常以痕量存在,检测前需要进行富集分离[4],常见的富集分离方法中,传统固相萃取柱如硅胶键合C8,其富集分离PCs的回收率不高且操作繁琐[5]。沸石咪唑酯骨架结构材料(zeolitic imidazolate frameworks, ZIFs)结合了无机沸石的高稳定性和金属有机骨架材料的孔隙率高、比表面积大等优点,是一种非常有潜力的高效吸附剂[6-8]。
该研究通过合成ZIFs磁性复合材料:Fe3O4@ZIF-67[9],并将其作为磁性分散微固相萃取(dispersive micro-solid phase extraction,DMSPE)吸附剂,结合液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS/MS)测定水样中6种PCs残留。对基于Fe3O4@ZIF-67的磁性DMSPE富集水样中6种PCs的富集效率、影响机理及影响因素进行了探讨。
1 材料与方法
1.1 化学试剂FeCl3·6H2O、NaHCO3、L-抗坏血酸、Co(NO3)2·6H2O、2-甲基咪唑(纯度≥98%,购自上海阿拉丁试剂有限公司);盐酸(质量分数为36%)、氨水(质量分数为28%,购自国药集团上海化学试剂厂);无水乙醇、甲醇、乙腈、丙酮、乙酸乙酯(色谱纯,购自美国TEDIA公司);超纯水均为本实验室自制。 阿莫西林(amoxicillin,AML)、氨苄西林(ampicillin,AMP)、青霉素V(penicillin V,PNV)、苯唑西林(oxacillin,OX)、氯唑西林(cloxacillin,OB)、双氯西林(dicloxacillin,DX)标准品(纯度≥98%,购自德国Dr.Ehrenstorfer公司)。标准溶液的配制:准确称取6种PCs标准品各5 mg(精确至0.01 mg),用乙腈定容到50 ml的棕色容量瓶中,作为储备液。工作溶液和混标溶液用超纯水将储备液稀释至所需浓度来制备。在-4 ℃下避光保存。Fe3O4@ ZIF-67根据唐祝兴 等[9]的方法合成。
1.2 仪器条件6种PCs通过配备Eclipse XDB-C18柱(3.5 μm,2.1 mm×150 mm)的HPLC-MS/MS(型号:4000,购自美国 AB SCIEX公司)进行检测。柱温:40 ℃;进样量:10 μl。流动相A为乙腈,流动相B为0.1%甲酸水溶液;洗脱梯度:0.00~3.00 min,95% B;3.01~13.00 min,50% B;13.01~16.00 min,25% B;16.01~20.00 min,95% B。流速:0.3 ml/min。检测模式:电喷雾源(ESI)正模式;离子源温度:400 ℃;电喷雾电压:5 500 V;雾化气电压:0.055 MPa;气帘气压力:0.079 MPa;辅助气流速:6 L/min;聚焦电压:90 V;碰撞室出口电压:10 V;采集方式为多反应监测(MRM)。表1为优化的质谱参数。
使用透射电子显微镜(transmission electron microscope,TEM,型号:JEM-2010)、扫描电子显微镜(scanning electron microscope,SEM,型号:JSM-6480LV)均购自日本电子株式会社,表征Fe3O4纳米颗粒与Fe3O4@ZIF-67的形态。使用自动比表面积和孔径分布分析仪(型号:Autosorb-iQ,购自美国Quantachrome公司)测定Fe3O4@ZIF-67的BET比表面积和平均孔径。使用能量色散X射线光谱仪(energy dispersive X-ray spectroscopy,EDS)(型号:IE 300 X,购自日本电子株式会社)对Fe3O4@ZIF-67进行元素分析。
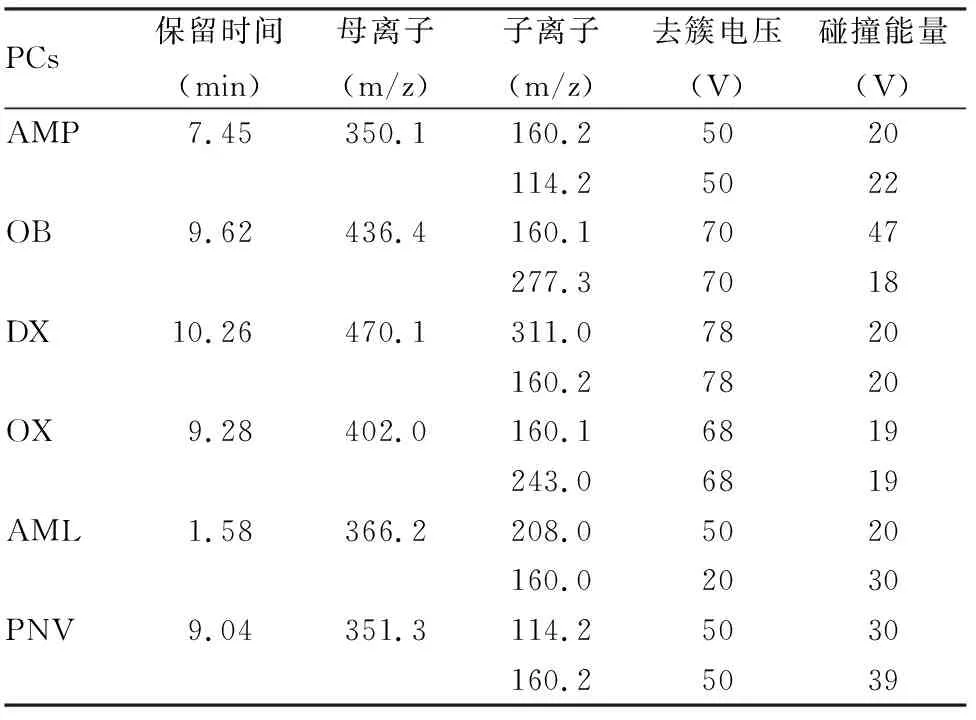
表1 6种PCs的质谱多反应监测参数
1.3 Fe3O4@ZIF-67对PCs药物的DMSPE条件实验
1.3.1吸附剂用量实验 取10、15、20、25 mg Fe3O4@ZIF-67,分别加入到含有每种PCs 500 ng的50 ml河水样品中,涡旋(2 000 r/min)10 min,将磁铁放在离心管的底部以聚集并分离Fe3O4@ZIF-67,以HPLC-MS/MS测定吸附后的样品溶液中PCs的含量。通过已吸附的PCs的量与样品溶液中的初始含量的比值来计算萃取效率(R)[10]。
1.3.2萃取时间实验 取10 mg的Fe3O4@ZIF-67加入到50 ml河水加标样品中(每种PCs 500 ng)。涡旋提取,采样间隔设置为0、1、3、5、7、10、15、20、30、60 min,磁铁分离后,测定样品溶液中PCs的浓度,计算萃取效率,确定最佳萃取时间。
1.3.3样品溶液pH 在样品溶液中加入甲酸或氨水溶液,调节样品溶液的pH 3.0~9.0之间,涡旋提取10 min。其他条件同“1.3.2”项,计算不同pH下的萃取效率。
1.3.4洗脱条件实验 10 mg的 Fe3O4@ZIF-67,加入到50 ml河水加标样品中,调节样品溶液的pH在6.0,涡旋提取10 min,磁铁分离后,用2 ml不同的洗脱溶剂[乙腈、甲醇 ∶乙腈(V ∶V,1 ∶1)和甲醇]洗脱PCs,共洗脱2次。涡旋2 min。合并2次洗脱液,使用氮气吹至干燥,用1 ml乙腈 ∶0.1%甲酸水溶液(V ∶V,5 ∶95)定容后,过0.22 μm滤膜进样。计算不同洗脱液的萃取效率。
1.4 基于Fe3O4@ZIF-67的DMSPE富集水样中的PCs所有的水样包括饮用水、河水、养殖水、池塘水收集于本地。取50 ml水样过0.22 μm的滤膜,调节pH调节至6.0。加入10 mg Fe3O4@ZIF-67,涡旋10 min,磁铁分离Fe3O4@ZIF-67。用2 ml甲醇溶液从Fe3O4@ZIF-67中洗脱PCs,共洗脱2次,涡旋2 min。磁铁分离后,合并萃取液并使用氮气吹至干燥,加入1 ml乙腈 ∶0.1%甲酸水溶液(V ∶V ,5 ∶95),涡旋1 min后过0.22 μm滤膜,供HPLC-MS/MS检测。
1.5 基质效应将空白河水样品、空白养殖水样按照上述前处理方法处理后,用空白基质溶液配制浓度为1.0、10.0、100.0 μg/L的PCs样品溶液,通过比较含有样品基质的标准化合物的峰面积和溶解在纯溶剂中的标准化合物的峰面积之比来计算基质效应(matrix effects ,MEs)[11]。相对标准偏差(relative standard deviations,RSD)用于检验分析结果的精密度:
数据用Excel软件进行初步处理,然后采用SPSS18.0软件进行单因素方差(One-Way ANOVA)分析,Duncan's法进行多重比较,以P<0.05表示差异显著。试验数据及结果以“平均值±标准差”表示。
1.6 标准曲线采用外标法定量,配制8个浓度为1.0、5.0、10.0、20.0、50.0、100.0、200.0、400.0 μg/L 的标准溶液,以浓度对峰面积作图,绘制标准曲线。以3倍信噪比(S/N=3)和10倍的信噪比(S/N=10)来计算水样中的6种PCs的检测限 (limits of detection, LOD)和定量限 (limits of quantitation, LOQ)。
2 结果
2.1 Fe3O4及Fe3O4@ZIF-67的表征Fe3O4纳米颗粒的粒径约5~10 nm,颗粒团聚但颗粒间有界限。见图1A。修饰后的Fe3O4@ZIF-67粒径约为500~600 nm,有具有核壳结构。见图1B。Fe3O4@ZIF-67的SEM图(图1C)可以看出材料表面具有ZIF-67特征的十二面体结构,由ZIF-67壳包裹着团聚的Fe3O4核组成。表征结果显示ZIF-67成功接枝在磁性Fe3O4颗粒上,形成了粗糙的表面。Fe3O4@ZIF-67的EDS元素分析图(图1D)表明,材料中主要含有C、Co、N、O和Fe元素。Fe3O4@ZIF-67的BET比表面积检测结果为841.7 m2/g,平均孔径3.37 nm。该材料的比表面积大,孔径较小,可为PCs的吸附提供了丰富的吸附位点。

图1 Fe3O4和Fe3O4@ZIF-67表征图
2.2 基于磁性Fe3O4@ZIF-67的DMSPE提取PCs的条件优化
2.2.1吸附剂用量的影响 吸附剂用量为10 mg时,6种PCs的萃取效率为90.2%~96.8%,吸附剂用量增加至25 mg时,萃取效率无明显变化。
2.2.2萃取时间的影响 萃取时间从1 min变化到10 min时,6种PCs的回收率随着萃取时间的增加逐渐增加,在1 min时,回收率低于80%,而10 min时6种PCs的回收率均能达到90%以上,并随着时间的增加无明显变化(图2A)。
2.2.3pH值的影响 在样品溶液pH 3.0~9.0范围内时,6种PCs的回收率呈现了先增加后减少的趋势。从pH 3.0到6.0,回收率从78.8%~89.0%增加到90.3%~97.5%。pH进一步增加,回收率缓慢下降。pH为6.0时回收率最高。见图2B。
2.3 基质效应采用基质效应来定量的评价DMSPE方法的净化效果以及样品中的共萃杂质对质谱响应的影响。如表2所示,在3个浓度水平下,河水和养殖水中的6个PCs的MEs分别为90.3%~102.2%和 89.6%~105.6%。MEs的结果显示采用本方法提取后,水样中可能的共萃杂质对质谱响应影响较小。
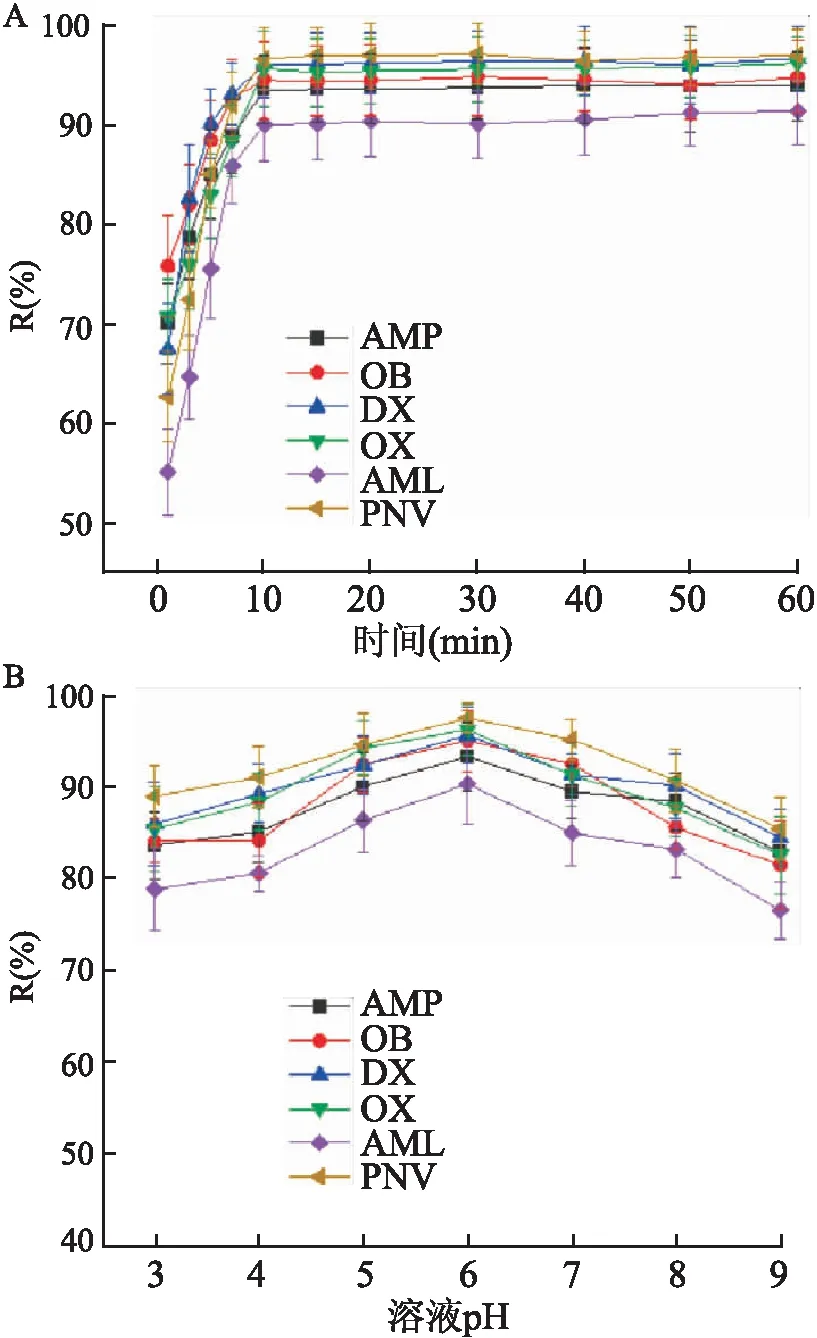
图2 萃取时间与pH值对PCs的萃取效率的影响
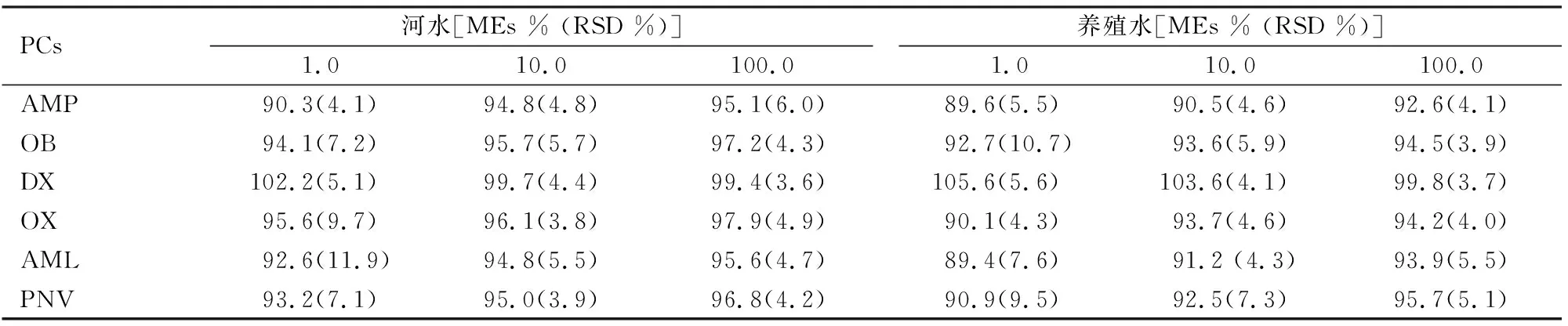
表2 不同浓度下河水样品与养殖水样品中Fe3O4@ZIF-67对6种PCs的基质效应 (n=3,μg/L)

图3 空白河水样品中添加浓度为0.1 μg/L的PCs的提取离子流色谱图
2.4 方法验证外标法标准曲线得到的6种PCs的线性相关系数R2为0.999 1~0.999 9,在1.0~400.0 μg/L浓度范围内显示了良好的线性关系。水样中6种PCs的LOD为0.01~0.06 μg/L,LOQ为0.03~0.19 μg/L(表3)。在河水和养殖水中分别添加浓度为0.1、1.0、10.0 μg/L 3个水平的PCs,并计算添加回收率,结果列于表3,在河水和养殖水中6种PCs的平均回收率分别为79.2%~96.6%和75.9%~94.8%。空白河水中添加浓度为0.1 μg/L的PCs的提取离子流色谱图见图3,在低浓度水平下可得到良好的质谱响应。
3 讨论
对基于磁性Fe3O4@ZIF-67的DMSPE提取PCs的条件进行优化。萃取时间、样品溶液的pH、洗脱溶液均影响着PCs的萃取效率。采用涡旋萃取时,PCs在吸附剂材料表面的吸附到10 min时可达到萃取平衡,低于10 min无法达到吸附平衡。由于PCs中含有β-内酰胺环,而ZIF-67为CoN4四面体和μ2-桥接的咪唑基连接组成,因此PCs与Fe3O4@ZIF-67之间的作用力推测主要来源于β-内酰胺环上N、O原子与咪唑环之间的氢键作用力以及疏水作用力,溶液的pH值会影响PCs和Fe3O4@ZIF-67的表面电荷及密度,进而影响到化合物和吸附剂之间的氢键作用力和萃取效率。在pH 3.0~9.0范围内,6种PCs的萃取呈现先增加后减弱的趋势,但增加和减弱的幅度不大。这可能是由于PCs和吸附之间以疏水作用力占主,氢键作用力为次。而pH值主要影响氢键作用力,因此对萃取效率的影响并不大。考虑到在pH为6.0时,萃取效率比其他pH值条件下稍高。选择样品溶液的pH值为6.0。由于Fe3O4@ZIF-67比表面积大,在吸附剂用量从10 mg增加至25 mg,6种PCs的萃取效率无明显变化。10 mg的Fe3O4@ZIF-67可足够吸附浓度水平为10 μg/ml的50 ml水样中PCs,这是由于吸附剂的比表面积大,吸附容量高。洗脱溶液使用甲醇洗脱的效果优于乙腈和甲醇∶乙腈(V∶V,1∶1)。这可能是因为PCs是偏极性化合物,而甲醇的极性比乙腈好,洗脱效果更佳。因此2×2 ml甲醇作为洗脱剂。

表3 河水和养殖水样品中6种PCs的平均回收率, RSD、LOD和LOQ(n=6)
方法验证的结果显示1.0~400.0 μg/L的浓度范围内,6种PCs具有良好的线性关系。在不同水样中三个添加浓度水平下,可以获得满意的回收率,得到较低LOD与LOQ,能够满足水中痕量污染物分析的要求。
以上研究说明,基于Fe3O4@ZIF-67的DMSPE方法简单快速、萃取效率高、重复性好、吸附容量高,结合LC-MS/MS可实现对水中6种PCs的同时快速灵敏的检测。本研究建立的磁性DMSPE方法进一步拓展了ZIFs材料在饮用水样品与环境水样品中有机污染物前处理分析中的应用。
