电针预处理对小鼠脑缺血后谷氨酸转运体2的影响
2020-12-03朱芳芸张霞婧邵勇平
朱芳芸, 张霞婧, 冯 燕, 翟 茜,邵勇平, 王 强
大脑是人体最为敏感的器官,发生脑缺血时,缺血时间越长脑组织损害越大,释放的兴奋性氨基酸谷氨酸越多,继而过度激活与之相结合的突触后膜受体N-甲基-D-天冬氨酸(N-Methyl-D-aspartic acid,NMDA),引起钙离子超载,导致神经元凋亡或者坏死,由于体内缺乏谷氨酸降解酶,因此谷氨酸的转运主要靠细胞膜上的谷氨酸转运系统(Excitatory amino acid transporters, EAATs),谷氨酸转运体中EAAT2完成谷氨酸转运的90%,因此EAAT2是最重要的谷氨酸转运体[1]。大鼠脑缺血前给予电针(electroacupuncture,EA)刺激即预处理可产生脑保护作用[2],该研究采用结扎小鼠双侧颈总动脉(Bilateral common carotid artery occlusion ,BCCAO)完成全脑缺血损伤模型,旨在探讨电针预处理脑保护作用的机制。
1 材料与方法
1.1 实验动物健康清洁级雄性C57BL/6小鼠32只,12周龄,体质量18~23 g,购于西安交通大学医学部动物实验中心,饲养于通风良好,室温(23±2)℃,湿度(50±5)%,自然光照,自由进食饮水。随机数表分4组(n=8):全脑缺血再灌注(BCCAO)组、电针预处理(EA+BCCAO)组、EAAT2抑制剂二氢卡因酸盐(DHK)+EA+BCCAO组、EAAT2激动剂头孢曲松钠(CXT)+BCCAO组。所有动物均遵循“NIH实验用动物管理和使用指南”,尽量减少实验动物数量和动物所受的痛苦,以及善待动物等。
1.2 方法
1.2.1实验动物处理 BCCAO组结扎动脉20 min;EA+BCCAO组麻醉后G6805-Ⅱ电针仪(青岛鑫升实业有限公司)电刺“百会穴”,参数:电流强度1 mA,频率2/15 Hz,疏密波,30 min/次/d,持续5 d,预处理后24 h结扎动脉20 min;DHK+EA+BCCAO组同EA+BCCAO组,结扎动脉前1 h注射DHK(批号:26All 12592,Tocris Bioscience公司,美国)200 μg/kg于侧脑室给药[3],末次处理24 h结扎动脉20 min;CXT+BCCAO组腹腔注射CXT(批号:SHl455,上海罗氏有限责任公司) 600 mg/kg,1次/d,连续5 d。
1.2.2全脑缺血再灌注损伤模型制备 预处理后24 h结扎小鼠双侧颈总动脉完成全脑缺血再灌注损伤模型[3]。将动物以InterMed AV600s麻醉机(Penlon公司,英国) 3%异氟醚吸入麻醉后,继续经异氟醚维持麻醉,保持自主呼吸,仰卧位固定动物,在颈正中部位显露游离并结扎双侧颈总动脉20 min。缺血成功的标准:嘴唇发绀和呼吸急促,眼球苍白和瞳孔散大;松开结扎线进行再灌注,再灌注成功的标准:瞳孔缩小,嘴唇红润,呼吸频率规律。
1.2.3神经行为学评分和海马CA1区凋亡神经元观察 再灌注24 h,按运动功能评分(total motor scores,TMS)[4]进行神经功能观察,由不清楚分组的一员执行。评分后,深麻醉暴露心脏,经升主动脉持续灌注肝素钠和4%多聚甲醛各20 ml,断头取脑组织,制备石蜡切片,进行HE染色,BX51多功能荧光显微镜(Olympus公司,日本)观察,随机选取5个视野,统计CA1区凋亡神经元数取平均值,凋亡神经元指:外形塌陷呈多角形或三角形,胞核溶解或固缩,胞浆嗜伊红染色。每个小鼠取3张切片,取均值。
1.2.4Western blot法 断头取海马脑组织,KeyGEN全蛋白提取试剂盒提取蛋白,并蛋白定量。30 μg总蛋白经10% SDS-PAGE 200 V 2 h分离,Bio-Rad电泳仪将蛋白转到PVDF膜上,放入5%脱脂奶粉室温孵育1 h,滴加兔源性β-tubulin(1 ∶5 000,康为世纪生物科技公司,北京)和兔源性EAAT2(1 ∶1 000,Abcam公司,英国)4 ℃孵育24 h,使用洗膜缓冲液漂洗,滴入辣根过氧化物酶标记山羊抗兔IgG(H+L)(1 ∶1 000,科昊生物,西安)室温孵育1 h,洗膜缓冲液漂洗,最后将PVDF膜放入ECL化学发光液,采用Bio-Rad扫描和发光。EAAT2的蛋白表达量:目的蛋白灰度值与内参β-tubulin灰度值的比值来表示。
1.2.5免疫荧光双标染色 先暴露心脏,经升主动脉,0.9%肝素钠生理盐水20 ml持续灌注,然后4%多聚甲醛缓冲液20 ml继续并行脑组织固定,后断头分离含有海马的脑组织浸入4%多聚甲醛缓冲液4 ℃固定,然后先在20%的蔗糖,再用30%蔗糖继续脱水。以10 μm厚度为冠状切片切脑片。切片晾干,洗涤后使用兔源性GFAP(1 ∶600,Abcam,英国)和豚鼠源性GLT-1(1 ∶200,Millipore,美国)混合液4 ℃孵育36 h,再次洗涤后加入山羊抗兔Cy3(1 ∶200,Abcam,英国)和抗豚鼠FITC(1 ∶200,Abcam,英国)室温避光孵育1 h。最后甘油密封荧光显微镜下观察 。
2 结果
2.1 电针预处理对全脑缺血再灌注小鼠行为的影响与BCCAO组(3.0±0.5)分比较,EA+BCCAO组(7.1±0.3)分和CXT+BCCAO组(6.7±0.8)分行为学评分增加(t=11.77与t=10.25,P<0.05);与EA+BCCAO组比较,DHK+EA+BCCAO组(2.3±0.3)分行为学评分降低(t=14.45,P<0.05)。
2.2 电针预处理对全脑缺血-再灌注小鼠海马CA1区凋亡神经元的影响与BCCAO组(36.1±3.0)个比较,EA+BCCAO组(15.2±2.0)个和CXT+BCCAO组(12.5±2.0)个凋亡神经元数目减少(t=19.96,t=24.31,P<0.05);与EA+BCCAO组比较,DHK+EA+BCCAO组(38.0±1.0)个凋亡神经元数目增加(t=18.22,P<0.05)。见图1。
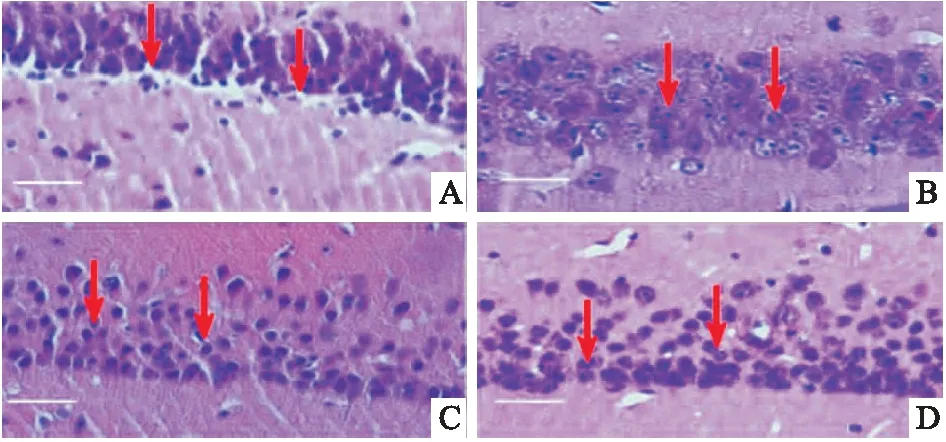
图1 小鼠海马CA1区凋亡神经元数目变化 ×400
2.3 电针预处理对全脑缺血-再灌注小鼠海马CA1区EAAT2表达的影响Western blot结果:与BCCAO组比较,EA+BCCAO组和CXT+BCCAO组EAAT2蛋白表达增加(t=7.028,t=4.243,P<0.05);与EA+BCCAO组比较,DHK+EA+BCCAO组EAAT2蛋白表达降低(t=4.692,P<0.05)。见图2A。免疫荧光双标染色结果:BCCAO组EAAT2蛋白表达较少,EA+BCCAO组和CXT+BCCAO组EAAT2表达增加,而DHK+EA+BCCAO组EAAT2表达减少。GFAP在EA+BCCAO和CXT+BCCAO组蛋白表达增加。EAAT2-GFAP荧光染色在EA+BCCAO和CXT+BCCAO组增强,说明两者蛋白表达增加。见图2B。
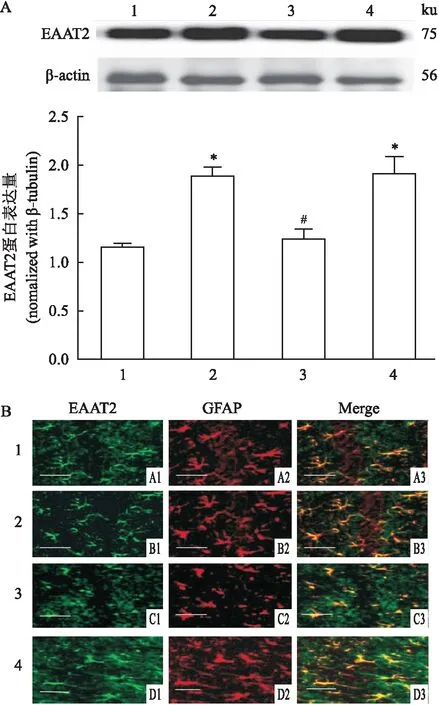
图2 Western blot和免疫荧光双标染色检测EAAT2的蛋白表达情况
3 讨论
脑卒中是发展中国家导致人群死亡的第二因素,我国卒中每年新增200多万例,但目前对其预防没有特别有效的措施[5]。C57BL/6小鼠因Willis环先天发育不全,因此可结扎双侧颈总动脉制备全脑缺血再灌注损伤模拟人类脑卒中[6]。使用电针刺激特异性穴位“百会穴”可以产生大鼠“脑缺血耐受”作用[7]。当脑部受到伤害或发生缺血损伤时,过量的谷氨酸积聚会导致神经元凋亡和坏死,而胞膜上的谷氨酸转运体EAAT包括5型,其中星形胶质细胞上的EAAT2更为重要,在脑损伤时EAAT2主动转运谷氨酸到胞内,进一步被谷氨酰胺合成酶降解为无神经毒性的谷氨酰胺[8-10]。实验发现小鼠脑缺血前给予电针预处理,与BCCAO组比较神经行为学评分增加和海马CA1区凋亡神经元数目减少。说明电针预处理可以减轻小鼠脑缺血损伤作用,产生脑保护作用。EAAT2拮抗剂DHK,因不能透过血脑屏障,选择侧脑室给药[3]。末次电针预处理结束,侧脑室给予DHK,给药1 h后制作脑缺血再灌注损伤模型,结果发现DHK可以逆转电针预处理的脑保护作用。CXT是EAAT2的特异性激动剂,连续腹腔注射可上调谷氨酸转运体数目,起到脑缺血保护效果,本研究采用CXT腹腔注射预处理,结果发现神经行为学评分明显提高和CA1区凋亡神经元数目降低,这与电针预处理产生作用相似[11],提示EAAT2参与电针预处理产生脑缺血耐受作用。
Western blot结果显示小鼠全脑缺血再灌注损伤组EAAT2蛋白表达上调,说明脑缺血损伤激活了谷氨酸转运体,而电针预处理提高EAAT2的蛋白表达水平。EAAT2不仅分布于皮层,而且海马也非常丰富,因此免疫荧光染色双标选择GFAP和EAAT2,结果显示EA+BCCAO组EAAT2表达明显增强,GFAP蛋白表达也明显多于BCCAO组,双标定位EAAT2-GFAP细胞数目明显比BCCAO组增加,结论电针预处理的脑保护作用通过上调星形胶质细胞膜上的EAAT2来实现的。
综上所述,小鼠脑缺血前给予电针刺激产生的脑保护是通过上调星形胶质细胞上的EAAT2来实现的,这也为临床使用电针刺激仪预防和治疗脑卒中奠定了一定的理论基础。但这一技术如何应用于临床还有待继续研究。
