肝细胞癌患者调节性T细胞与NK细胞相关性研究
2020-12-03孙丹丹马晴晴徐元宏郑美娟
孙丹丹,马晴晴,徐元宏,郑美娟
肝细胞癌(hepatocellular carcinoma,HCC)为最常见的致死性肿瘤之一,乙型肝炎病毒(hepatitis B virus,HBV)感染在其发病中具有重要作用[1]。研究表明HCC患者CD4+CD25+调节性T细胞可高表达CTLA-4,从而介导免疫负向调控[2]。亦有研究表明CD8+T细胞中存在类似CD4+CD25+调节性T细胞的细胞亚群,称为CD8+Treg[3-4],包括CD8+CD25+Treg、CD8+CD103+Treg以及CD8+CD28-Treg,参与抑制效应性T细胞的功能[5]。NK细胞是固有免疫系统的重要组成部分,有研究表明在肝癌患者中NK细胞比例降低且效应功能降低[6]。
该研究通过检测HBV阳性的HCC患者外周血CD8+CD25+Treg以及CD8+CD103+Treg以及NK细胞的水平,同时分析CD8+CD25+Treg与NK细胞的相关性,进而探讨HCC可能的免疫逃逸机制。
1 材料与方法
1.1 病例资料收集安徽医科大学第一附属医院2018年1月~2020年1月期间55例HCC患者及22例健康对照者临床资料。
1.2 主要试剂与仪器FITC-CD4、FITC-CD56、FITC-CD103、PE-CD25、Percp-cy5.5-CD3、Percp-cy5.5-CTLA-4、APC-CD8、APC-FoxP3、红细胞裂解液均购自美国BD公司;细胞固定液和穿膜液购自美国赛默飞公司;Ficoll液购自天津TBD公司;FACSCalibur流式细胞仪为美国BD公司;4 ℃离心机为德国Eppendorf公司。
1.3 样本采集采集患者外周血分别置于分离胶管和EDTA抗凝管;EDTA抗凝血用于流式细胞术检测CD8+CD103+Treg、CD8+CD25+Treg、CTLA-4+CD8+Treg、CD4+Treg、CTLA-4+CD4+Treg和NK细胞的比例。
1.4 PBMC的分离取1支15 ml离心管,加入2 ml Ficoll液,采集2 ml患者或健康人的抗凝全血,使用PBS进行1 ∶1稀释。然后将稀释后的血液缓慢加入Ficoll液面上方,注意不要破坏液面。然后于水平离心机中1 900 r/min,升0降0离心30 min后,使用平口吸管吸取中间白膜层,即为外周血PBMC。
1.5 CD8+CD25+Treg、CD8+CD103+Treg、CD8+CTLA-4+Treg和NK细胞的检测在流式管中加入全血50 μl,加入10 μl小鼠血清室温避光封闭10 min,再分别加入相应抗体FITC-CD103/PE- CD25/Percp-cy5.5-CD3/APC-CD8或FITC-CD56/Percp-cy5.5-CD3各10 μl;混匀后流式管置于室温、避光孵育15 min;然后加入红细胞裂解液1 ml,混匀后流式管置于室温,避光孵育10 min,PBS洗涤2次,300 μl PBS重悬细胞沉淀,FACSCanto II Plus仪器检测,Flowjo软件分析结果。
1.6 CD4+CD25+FoxP3+Treg和CTLA-4+CD4+Treg细胞的检测在流式管中加入全血50 μl,加入10 μl小鼠血清室温避光封闭10 min,再分别加入相应抗体FITC-CD4/PE- CD25/Percp-cy5.5-CTLA-4各10 μl;混匀后流式管置于室温、避光孵育15 min;然后加入红细胞裂解液1 ml,混匀后流式管置于室温,避光孵育10 min, PBS洗涤2次,加入100 μl细胞固定液置于4 ℃冰箱避光固定40 min,然后加入1 ml穿膜液,洗涤弃上清液后加入10 μl APC-FoxP3抗体。避光孵育1 h后,加入1 ml PBS洗涤2次,300 μl PBS重悬细胞沉淀,FACSCanto II Plus仪器检测,Flowjo软件分析结果。
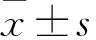
2 结果
2.1 患者一般资料55例HCC患者中男性44例,女性11例,年龄35~73岁,中位年龄58岁,四分位数间距为20.00岁。22例健康对照组中男性13例,女性9例,年龄28~77岁,中位年龄52岁,四分位数间距为20.75岁。
2.2 HCC患者外周血CD8+Treg比例及组织中CTLA-4+CD8+Treg比例的检测利用流式细胞术检测外周血HCC患者CD8+Treg的比例,设计方案如图1A。我们发现,HCC患者组外周血CD8+CD25+Treg比例为(6.22±0.49)%,高于健康对照组为(4.56±0.44)%,差异有统计学意义(P<0.05,t=1.996),代表性流式图见图1B,统计图见图1E。同时,CTLA-4+CD8+Treg在患者癌组织中表达比例(41.00±4.00)%也高于癌旁组织(6.23±2.75)%,差异有统计学意义(P<0.05,t=7.158),代表性流式图见图1D,统计图见图1G。此外,我们检测患者组CD8+CD103+Treg比例为(2.92±0.22)%,与健康对照组(2.69±0.37)%比较,差异无统计学意义(P>0.05,t=0.437),代表性流式图见图1C,统计图见图1F。
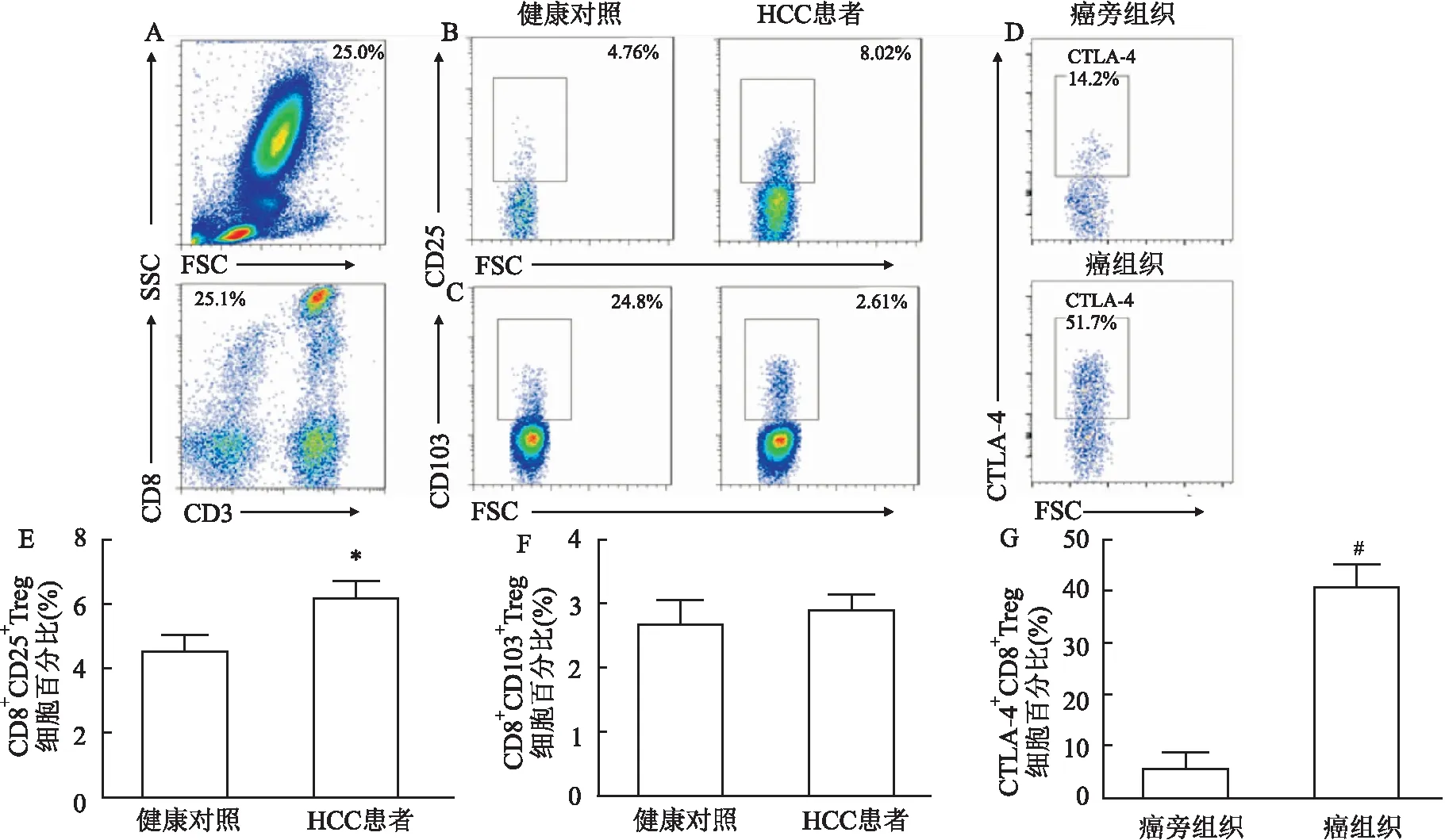
图1 HCC患者外周血CD8+Treg的比例
2.3 HCC患者组织中CD4+Treg比例的检测利用流式细胞术检测HCC患者癌组织中及癌旁组织中CD4+Treg的比例,发现癌组织中CD4+CD25+FoxP3+Treg比例为(23.28±6.78)%,高于癌旁组织中(10.18±4.04)%,差异有统计学意义(P<0.05,t=1.965),代表性流式图见图2A,统计图见图2B。CTLA-4+CD4+Treg在癌组织中(61.53±11.37)%比例也高于癌旁组织(16.33±2.38)%,差异有统计学意义(P<0.05,t=3.889),代表性流式图见图2C,统计图见图2D。
2.4 HCC患者外周血及组织中NK细胞表达比例的检测利用流式细胞术检测HCC患者外周血NK细胞的比例,患者外周血NK细胞表达比例为(13.57±1.39)%低于健康对照组(21.44±1.23)%,差异有统计学意义(P<0.05,t=4.227),代表性流式图见图3A,统计图见图3B。患者癌组织中NK比例为(8.99±1.64)%,低于癌旁组织中NK细胞比例(24.13±3.10)%,差异有统计学意义(P<0.05,t=4.314),代表性流式图见图3C,统计图见图3D。
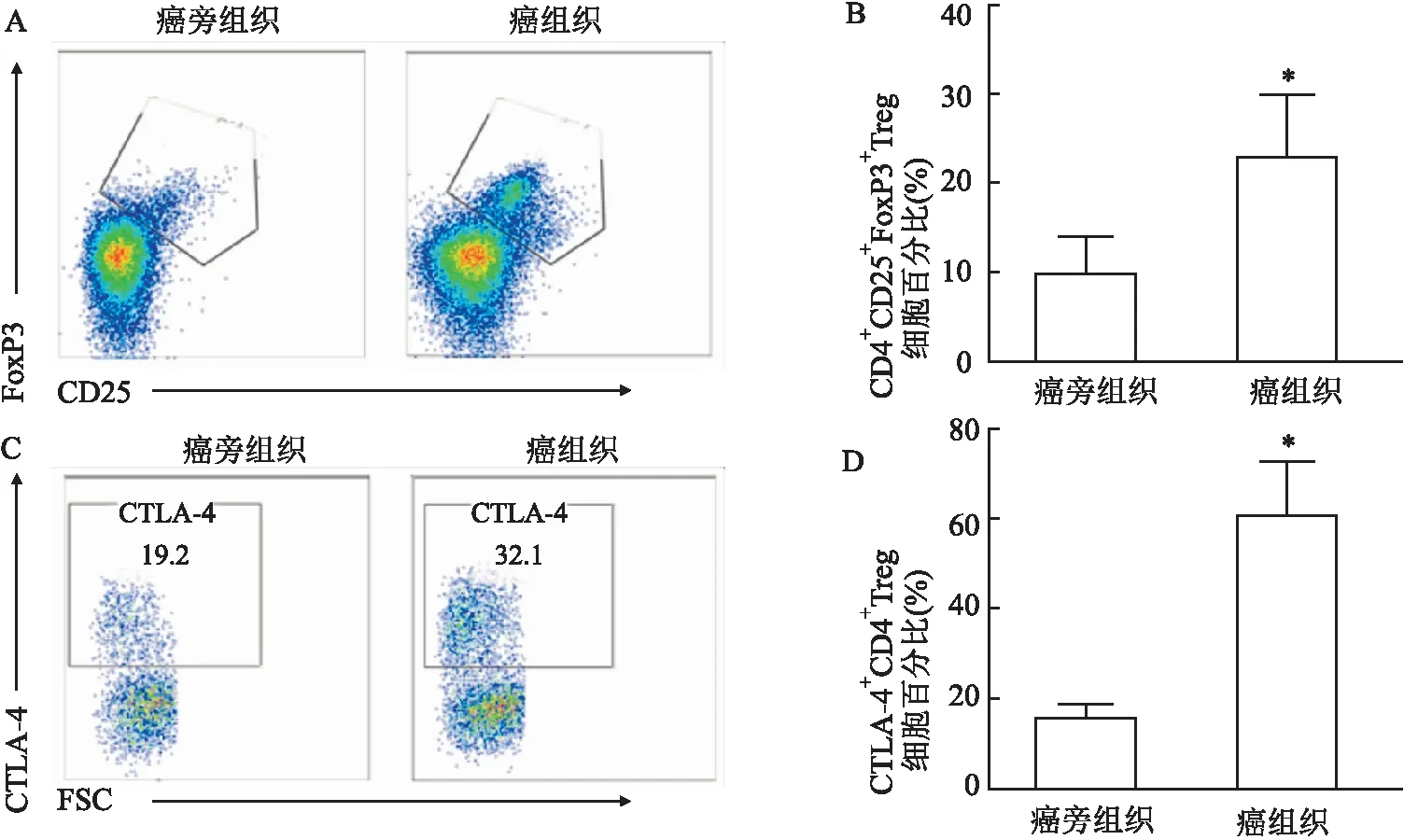
图2 HCC患者癌组织和癌旁组织中CD4+Treg的比例
图3 HCC患者外周血及肝组织中NK细胞比例
2.5 HCC患者NK细胞含量与CD8+Treg以及CD4+Treg含量的相关性分析为进一步探究HCC患者NK细胞与CD8+Treg、CD4+Treg的相关性,本研究分析了外周血NK细胞与CD8+CD25+Treg含量的相关性,结果表明二者呈负相关,差异有统计学意义(r=-0.66,P<0.05),见图4A。接下来分析癌组织中NK细胞与CD4+CD25+FoxP3+Treg的比例相关性,发现二者同样呈负相关(r=-0.76,P<0.05),见图4B。
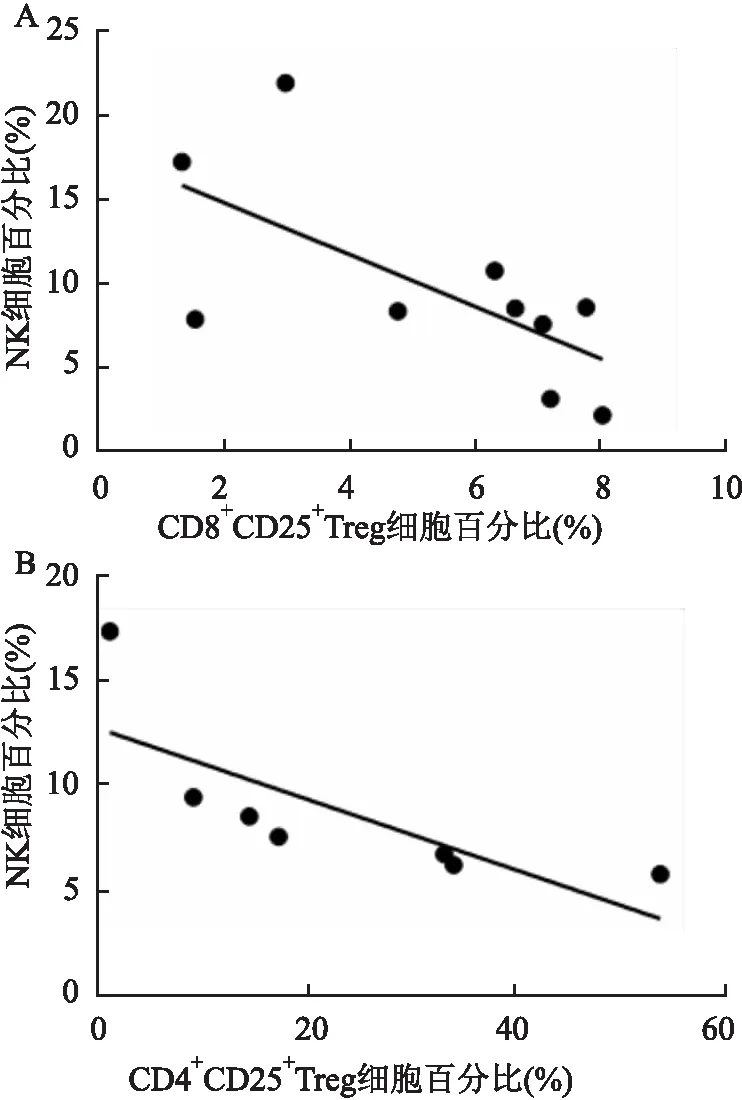
图4 HCC患者NK细胞与CD8+Treg、CD4+Treg的相关性
3 讨论
HCC在我国发病例数较高,研究表明肿瘤细胞为避免机体免疫系统的攻击,具有免疫逃逸的机制。CD4+Treg、CD8+Treg细胞是具有免疫负调功能的免疫细胞[7-9],参与肿瘤细胞逃逸、免疫监视和防御。亦有研究[10]指出CTLA-4可以增强Treg细胞的免疫抑制功能。NK细胞作为固有免疫细胞,参与机体抗肿瘤免疫,有研究[11-12]表明患者的NK细胞能够介导肿瘤细胞的免疫逃逸。而在HCC患者中,CD4+Treg和CD8+Treg具体参与何种角色,与NK细胞有何相关目前尚不清楚。
研究[13]表明HCC患者与健康对照者比较外周血中具有高比例的CD8+Treg。在本研究中,HCC患者外周血CD8+CD25+Treg细胞比例升高且CTLA-4+CD8+Treg细胞在癌组织中比例明显高于癌旁组织,这提示在肿瘤患者体内CD8+Treg细胞介导的免疫抑制作用可能要高于正常机体。对CD4+Treg进行研究后发现,在癌组织中同样存在CD4+CD25+Foxp3+Treg以及CTLA-4+CD4+Treg的高表达,提示CD4+Treg细胞也参与了这一免疫抑制过程。本研究中显示的上述细胞亚群的上调现象,可能是导致患者抗肿瘤免疫功能减低的重要原因。而在这两种Treg细胞中均高表达的CTLA-4,提示它可能同样参与了肿瘤微环境中的免疫抑制,然而这种现象的产生的原因及其具体影响机制并不清晰。
本研究显示NK细胞在HCC患者外周血及癌组织中表达降低,这与前期研究[14]报道相符。通过相关性分析显示外周血CD8+CD25+Treg、癌组织中CD4+Treg的比例与NK细胞比例呈负相关,提示他们之间可能存在某种关联,与HCC的免疫逃逸相关。
总之,通过分析Treg细胞与NK细胞的关系,提示这两种细胞都可以参与HCC患者体内异常的免疫反应过程,且CTLA-4在此过程中可以抑制NK细胞的抗肿瘤作用,其可能与HCC的进展相关。因而对于设计抗肿瘤免疫方案具有重要的参考价值及临床应用前景。
