子宫内膜间质细胞来源外泌体miRNA表达谱的差异分析
2020-12-03王礼贤胡月阳
王礼贤,胡月阳,李 琰,杨 漪,康 山
子宫内膜异位症(endometriosis,EMs)是子宫内膜细胞生长到子宫内腔以外位置[1],异位组织中子宫内膜间质细胞(endometrial stromal cells,ESC)围绕、内膜腺体生长,ESC、内膜腺体类似肿瘤特征可向周围器官转移,导致多种并发症产生[2]。EMs发病率在育龄期妇女中高达10%~15%,且有不断上升的趋势,严重影响女性生活质量和身心健康。微小RNA(microRNA,miRNA)是一段短链非编码RNA,表达异常与肿瘤的发生发展息息相关,已经证明可参与子宫肌瘤[3]、卵巢癌[4]、宫腔黏连[5]等妇科疾病免疫逃逸及微环境形成等过程。为探究miRNA与EMs的关系,该研究对两组外泌体miRNA表达谱进行检测,分析其差异表达,为下一步miRNA靶基因预测信号通路富集分析做铺垫。
1 材料与方法
1.1 一般资料2017年1月~2018年12月河北医科大学第四医院确诊为EMs患者为研究对象,40例,年龄24~37(30.58±4.18)岁,病灶分布特点:腹膜型9例,卵巢型21例,深部型10例;根据美国生殖医学协会EMs分期标准,Ⅰ期6例,Ⅱ期12例,Ⅲ期14例,Ⅳ期8例;另选取同一时期腹腔镜检查子宫内膜正常子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅲ子宫手术(其中23例宫颈病变表面破坏术、17例宫颈局部切除术,月经结束3~7 d手术)患者为对照组,40例,年龄24~38(30.51±3.69)岁,两组患者年龄比较差异无统计学意义(P>0.05),具有可比性。EMs诊断标准:腹腔镜手术确诊[6]。EMs患者纳入标准:① 均已确诊为EMs患者;② 月经规律的育龄期妇女;③ 年龄>20岁;④ 本研究患者知情同意,经医院伦理委员会审查并通过。排除标准:① 子宫内膜病变接受激素治疗患者;② 急性全身感染性疾病患者;③ 怀孕期及哺乳期妇女;④ 多种药物过敏者;⑤因精神或其他疾病情况无法参加该项研究者。
1.2 试剂与器材磷酸缓冲盐溶液(phosphate buffer saline,PBS)(美国HyClone公司);10%胎牛血清、DMEM(美国Gibco公司);I型胶原酶(美国ATCC公司);4%多聚甲醛(北京索莱宝科技有限公司);3%双氧水(江山市双氧水有限公司);醋酸双氧铀(青岛捷世康生物科技有限公司);波形蛋白单抗、角蛋白单抗(上海碧云天公司);Total Exosome Isolation试剂盒、RNA提取试剂盒(美国Invitrogen公司); cDNA反转录试剂盒(美国Fermentas公司);2×Hi SYBR Green QPCR Mix(北京百奥莱博科技有限公司)。光学显微镜(日本Olympus公司);Spectra S/TEM 扫描透射电子显微镜[赛默飞世尔科技(中国)有限公司];Agilent 2200 TapeStation(中国安捷伦科技有限公司);Illumina HiSeqTM 2500测序仪(南京迪康金诺生物技术有限公司);qRT-PCR仪(美国ABI公司)。
1.3 样本采集钝器刮取EMs患者异位内膜组织、CIN Ⅲ患者正常内膜组织,放入预冷的装有无菌的广口瓶中清洗3次,浸泡在含10%胎牛血清的DMEM培养基中,立即送回实验室处理。
1.4 ESC外泌体收集
1.4.1ESC原代培养与纯度鉴定 ESC原代培养参考文献[7]中方法并改进进行。眼科剪剪碎上述组织,加入无血清DMEM培养基反复吹打后移至离心管中,加400 μl 0.25% Ⅰ型胶原酶消化,组织呈絮状即可终止消化,消化时间80~160 min,用400目过滤,过滤液放入离心管中,1 000 r/min离心5 min,弃上清液,加入含12%胎牛血清的DMEM培养液,置37 ℃ CO2培养箱培养,每天观察细胞形态,常规换液培养细胞,细胞24 h开始贴壁,72 h细胞贴壁完成。4%多聚甲醛固定、3%双氧水封闭细胞,分别加入波形蛋白单抗、角蛋白单抗孵育;同时设置阴性对照,二抗孵育后滴加辣根酶标记的链酶卵白素工作液封片,光学显微镜观察。培养结果:研究组收集成功37例,对照组收集成功36例。鉴定成功细胞置于新的培养皿中培养,细胞培养5 d拍照。
1.4.2ESC外泌体的分离与鉴定 ESC外泌体分离与鉴定参考文献[8],Total Exosome Isolation试剂盒法提取ESC外泌体,具体步骤:收集ESC后2 000 r/min离心30 min,转移上层清液至新离心管中,加1/2样本量的试剂,混匀后4 ℃过夜,10 000 r/min离心1 h后弃上清,50 μl PBS重悬沉淀后至-80 ℃保存。醋酸双氧铀负染透射电镜观察外泌体形态并鉴定。
1.5 ESC外泌体miRNA表达谱芯片检测从Ⅰ、Ⅱ、Ⅲ、Ⅳ期EMs患者外泌体中随机选出3期,再每期中随机选1例为代表;对照组则采用随机数字法抽3例进行芯片表达谱实验。Agilent 2200 TapeStation进行RNA建库,Illumina HiSeqTM 2500测序仪对质检文库运进行测序,分析两组外泌体miRNA差异性。
1.6 qRT-PCR检测ESC外泌体miR-205、miR-542-3p水平取-80 ℃冰箱两组ESC外泌体,RNA提取试剂盒提取总RNA,cDNA反转录试剂盒反转录cDNA,qRT-PCR仪对miR-205、miR-542-3p、U6扩增。miR-205-F:5′-CACGTCCCAGGCTCCA-3′,miR-205-R:5′-CGGGCATCGAAACTGCCAAT-3′;miR- 542-3p-F:5′-TGTGACAGATTGATAACT-3′,miR-542-3p-R:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTC GCACTGGATACGACCTGCGGTTTCAGT-3′;U6-F:5′-ATTGGAACGATACAGAGAAGATT-3′,U6-R:5′-GG AACGCTTCACGAATTTG-3′。上样体系:cDNA 1 μl(50 ng/μl),F/R(10 μmol/L)各0.5 μl,2×Hi SYBR Green QPCR Mix 10 μl,ddH2O 8.0 μl。反应条件:95 ℃、90 s;95 ℃、30 s;60 ℃、55 s;45个循环。2-ΔΔCt法对miR-205、miR-542-3p表达水平定量分析。
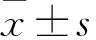
2 结果
2.1 两组ESC比较研究组细胞平铺贴壁生长,细胞呈长梭形,边缘清晰,形状规则。对照组细胞虽平铺贴壁生长,部分细胞呈长梭形,亦有细胞呈三角形或多角形,边缘轮廓不清晰,形状相对研究组不规则。见图1。

图1 两组ESC培养过程中代表性相衬图像 ×100A:研究组;B:对照组
2.2 两组细胞外泌体鉴定ESC外泌体直径在30~150 nm之间,球形,囊泡状结构。两组ESC外泌体结构类似。见图2。
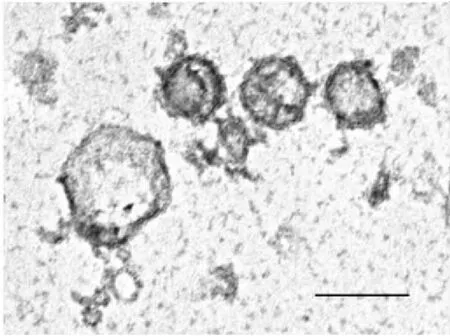
图2 醋酸双氧铀负染后ESC外泌体透射电镜下形态 ×200
2.3 两组ESC外泌体差异miRNA筛选研究组与对照组ESC外泌体有39种miRNA的表达差异有统计学意义(P<0.05)。与对照组比较,研究组上调miRNA 14个,下调25个,部分差异表达的miRNA见表1。双聚类分析图显示关系相近的miRNA聚在一起。见图3。
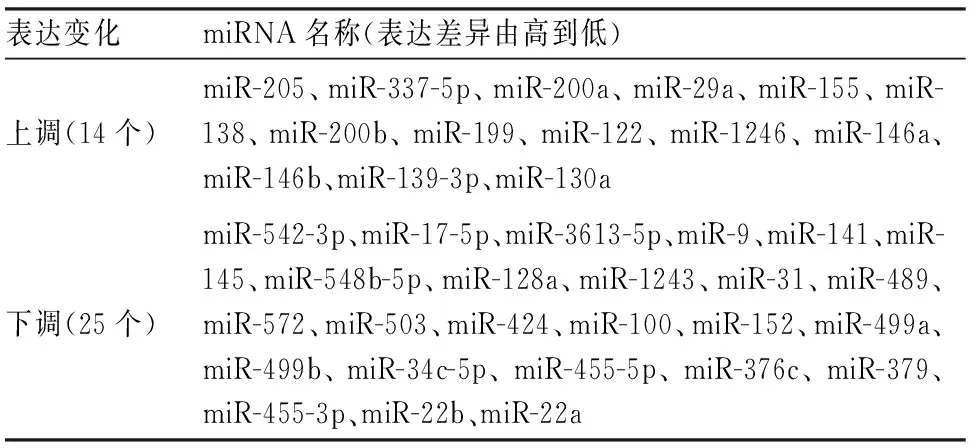
表1 研究组差异表达的miRNA

图3 两组ESC外泌体中差异miRNA双聚类分析
2.4 两组ESC外泌体中qRT-PCR检测miR-205、miR-542-3p表达量与对照组比较,研究组ESC外泌体miR-205表达量升高,miR-542-3p表达量降低(P<0.05)。见表2。
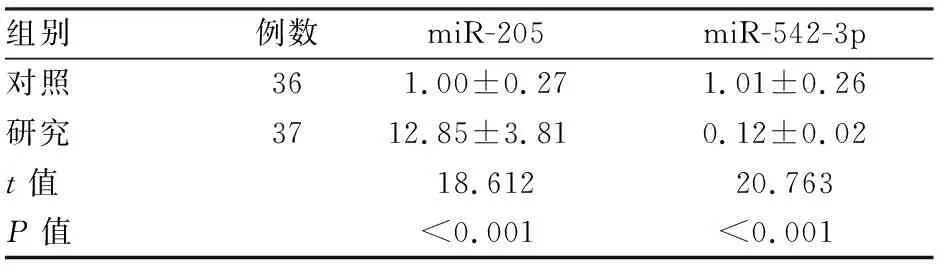
表2 两组ESC外泌体qRT-PCR检测miR-205、miR-542-3p水平
2.5 miRNA芯片检测与qRT-PCR检测ESC外泌体差异倍数比较miRNA芯片检测与qRT-PCR检测ESC外泌体差异无统计学意义(P>0.05)。见表3。
2.6 靶基因预测microTv3.0、Targestscan、PicTar 3种靶基因预测网站预测ESC外泌体上调倍数最高的7个、下调倍数最高的8个miRNA与EMs有关预测的靶基因,2种或2种以上预测网站中出现靶基因。见表4。

表3 miRNA芯片检测与qRT-PCR检测ESC外泌体比较
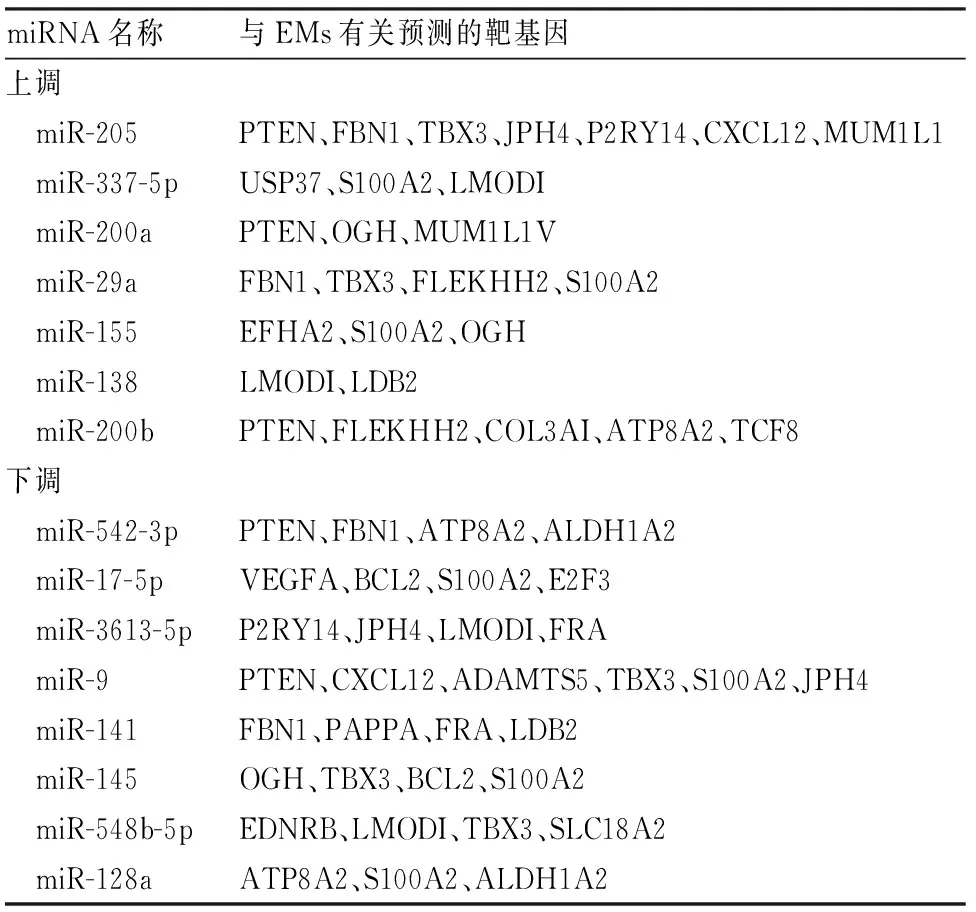
表4 EMs中差异靶位点预测
3 讨论
EMs属良性疾病,但有侵袭、种植、转移等恶性生物学行为,被称为“良性癌症”。临床并发症主要表现为痛经、慢性盆腔痛、月经紊乱和不孕等[9]。需长期使用药物治疗,副作用大、效果不理想,且术后复发率高[10],严重影响患者身心健康。因此寻找早期生物学标志物可提早预防疾病。外泌体是由细胞向细胞外间隙处释放的脂质双分子层小囊泡,内含多种RNA,其中成熟的miRNA含量最高,约占41.72%[11]。肿瘤细胞源外泌体miRNA参与肿瘤发生、转移、免疫逃逸以及微环境的形成等过程,与肿瘤的发生发展息息相关。
以往研究[12]中已发现外泌体miRNA影响疾病发生进程。外泌体miR-210是肾癌的标志物,在肾癌组织中高表达,影响肾癌疾病进程;外泌体miRNA在胃癌中可影响胃癌的生长、复发、肿瘤耐受等,且稳定性较好[13]。有临床研究[14-15]显示,EMs患者外泌体中miR-21较非EMs患者明显增加,对血管生成具有重要作用,与EMs发生发展存在一定联系。亦有研究[16]报道,miR-183在细胞增殖、凋亡中发挥重要作用,其表达下调可抑制凋亡,增强侵袭能力。本研究以EMs患者异位内膜ESC外泌体为研究对象、CIN Ⅲ患者正常内膜组织ESC外泌体为对照组,体外离体培养两组ESC发现外观相似,细胞均贴壁生长、呈长梭形,少部分呈星形,提示ESC分离成功,电镜下观察两组ESC外泌体直径均在30~150 nm之间,球形,囊泡状结构,且纯度较高。miRNA芯片检测人类847种miRNA发现在两组ESC外泌体中39种miRNA表达有差异;与对照组比较,研究组上调14个,下调25个,与梁静 等[17]子宫内膜样腺癌组织中microRNA差异表达谱部分miRNA相同,却不完全一致。本研究中研究组miR-205相对表达量升高最多,miR-542-3p相对表达量降低最多,qRT-PCR验证ESC外泌体miR-205、miR-542-3p表达倍数与芯片检测结果类似,提示miR-205、miR-542-3p与EMs关系密切,提示外泌体可作为非侵入性诊断EMs有效生物标志物,其功能与特性为临床靶向治疗提供新方向。
miR-205表达升高在食管癌中可加快细胞侵润迁移、在乳腺癌中可促进淋巴结转移和肿瘤生长[18]。miR-542-3p在肿瘤细胞转移过程中发挥抑癌作用,表达量降低可加速结肠癌、星型细胞瘤细胞的增殖、侵袭和转移[19]。靶基因预测发现miR-205、miR-200a、miR-200b、miR-542-3p、miR-9都可调控PTEN基因,PTEN是第一个迄今为止发现有双特异性磷酸活性的肿瘤抑制基因,在EMs中可判断预后[20];提示这些miRNA可能通过调控PTEN进而影响肿瘤发生。miR-205、miR-200a、miR-200b都位于1号染色体且表达上调,提示EMs患者可能在1号染色体上发生基因重组,影响EMs表达差异。miR-542-3p、miR-9在EMs中表达下调,与陈观盛等[21]的研究结果一致,提示可能以原癌基因为靶点,表达下降可促进原癌基因表达,影响EMs发生发展进程,但关于EMs病因有待进一步探究,故外泌体在EMs中的作用机制仍待阐明。
本研究借助芯片数据,挖掘与EMs有重要影响的ESC外泌体miRNA,并对其差异miRNA分析,初步验证ESC外泌体中上调倍数最多的7个、下调倍数最多的8个与EMs有关的靶基因,对EMs患者ESC外泌体中miRNA表达水平有了进一步了解,为分子靶向治疗、探讨相关疾病提供分子理论基础。
