长链非编码RNA NRON促进NFATc3磷酸化减轻心房纤维化的机制研究
2020-12-03郭志祥葛圣林
王 泽,郭志祥,葛圣林
心房纤颤(atrial fibrillation, AF)是目前最常见的心律不齐之一,AF发作会造成血流动力学改变,极易引起血栓的形成。所以AF是引发中风、心力衰竭和死亡的重要危险因素。由于AF对医疗系统带来的负担持续上升,因此临床医师准确鉴别出高风险的AF患者并及时采取预防和治疗手段已变得至关重要。活化T细胞因子(nuclear factor of activated T cells, NFAT)是一种受Ca2+调节以控制基因表达的转录因子家族。越来越多的数据表明钙调神经磷酸酶(calcineurin,CaN)/ NFAT信号通路在心脏肥大和纤维化中起重要作用[1-2]。长链非编码RNA(long non-coding ribonucleic acid , LncRNA)是一组非蛋白质编码的RNA分子,长度大于200个核苷酸。现国外尚未有研究结果证实NRON对于NFAT的具体作用机制,该研究探讨LncRNA NRON影响NFAT的具体机制及其对心肌纤维化进程的影响,从而为临床预测和治疗AF提供了新的可行性。
1 材料与方法
1.1 病例资料选取2018~2019年安徽医科大学第一附属医院心脏大血管外科包括心脏瓣膜置换术在内的34例AF患者(AF组)和20例窦性心律(sinus rhythm, SR)患者(SR组)。排除标准如下:服用抗心律失常药物(β受体阻滞剂除外)的AF患者或有其他心律不齐病史的患者;植入永久起搏器的患者;既往或计划进行Cox迷宫手术的患者;中重度二尖瓣疾病患者;有二尖瓣置换术手术史患者;先天性心脏畸形患者;急诊手术患者;全身性炎症或癌症患者;人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染或营养不良患者。在收集入组患者组织样本时,所有患者未接受过皮质类固醇或非类固醇抗炎药治疗。本研究得到安徽医科大学第一附属医院人类伦理委员会的批准,严格遵守《赫尔辛斯基宣言》实施试验,并获得了所有入组患者或其直系家属的书面知情同意。
1.2 主要试剂胎牛血清(上海斯信生物科技有限公司);DMEM培养基(美国R&D Systems公司);ECL发光试剂盒(美国Thermo Fisher Scientific公司); troponin IF一抗、vimentin IF一抗(美国Cell Signaling Technology公司);IF二抗(武汉三鹰生物技术有限公司);vimentin免疫印迹一抗、troponin免疫印迹一抗(武汉莫纳生物科技有限公司),GAPDH免疫印迹一抗、免疫印迹二抗(上海斯信生物科技有限公司),引物(美国Thermo Fisher Scientific公司);荧光定量 PCR 试剂盒(日本Takara公司);其它生化试剂均为进口分装或国产分析纯化。
1.3 主要方法
1.3.1细胞分离、培养和转染 术中从SR患者中取出心脏组织,并在PBS培养基中洗涤。胶原酶和蛋白酶消化后,将原发性心房成纤维细胞进行原代培养。3次传代后,收集细胞,更换培养基培养24 h。之后将pcDNA-NRON和si-NRON转染至原代心房成纤维细胞。培养48 h后,收集细胞用于进一步实验。
1.3.2qRT-PCR 提取总RNA。对High Capacity cDNA进行逆转录。然后在PCR检测仪上进行qRT-PCR反应,选择GAPDH作为内参。 数据是针对每个cDNA标准化为参考基因GAPDH样品。本研究中使用的引物序列包括: NRON forward:5′-AC GTTCCTTAATGTACGCCTTTGC-3′,reverse: 5′-TTGG CCGTGTCCTGAGTCCTT-3′;Collagen Ⅰ forward:5′-GCTCCTCTTAGGGGCCACT-3′,reverse:5′-CCACGT CTCACCATTGGGG-3′;Collagen Ⅲ forward:5′-TTTTG CAGTGATATGTGATGTT-3′,reverse:5′-GGATGGTGG TTTTCAGTTTA-3′。
1.3.3免疫组织化学 将组织分离物制成4 μm石蜡切片,然后进行脱蜡并通过分级乙醇水化。 孵育切片并用PBS冲洗后进行抗原恢复。然后加入胶原蛋白Ⅰ一抗(1 ∶200),在4 ℃下孵育过夜并用PBS冲洗,然后添加第二种抗体在37 ℃下孵育2 h并用PBS冲洗。染色后用水洗涤。将它们在梯度乙醇系列和二甲苯中脱水,然后覆盖。最后用显微镜观察免疫组织化学结果。
1.3.4Western blot 使用RIPA裂解缓冲液从成纤维细胞中提取总蛋白,并用BCA套件进行定量检测。将等体积的蛋白质进行SDS-PAGE,经过转膜、封闭、洗膜, 孵育一抗 (1 ∶500) , 4 ℃摇床过夜。二抗 (1 ∶5 000) 孵育, 洗膜, ECL发光法显影。
1.3.5免疫荧光染色 首先用PBS处理成纤维细胞,在室温下用0.5%Triton X-100处理20 min,再冲洗3次,1%BSA封闭过夜,波形蛋白抗体(1 ∶100)和肌钙蛋白抗体(1 ∶100)在4 ℃孵育过夜,用PBS冲洗3次,每次2 min。将制剂在37 ℃下温育30 min,然后将PBS漂洗3次,将DAPI ∶缓冲液按1 ∶1 000配置DAPI工作液,在每张玻璃片上都滴加DAPI工作液,室温下避光孵育5 min,对细胞爬片进行核染,然后使用激光扫描共聚焦显微镜观察并拍照。
1.3.6CCK-8增殖实验 常规消化与不同来源的成纤维细胞,接种于96孔板,每孔3 000个细胞,CCK-8法检测转染pcDNA-NRON和si-NRON后的成纤维细胞增殖能力,使用未参与转染的成纤维细胞作为对照。将对数生长期细胞用胰蛋白酶消化,配制成细胞悬液接种于96孔板,每组的样本设5个重复,置于培养箱中培养,待检测前每孔中加入10 μl CCK-8溶液,将培养板放入培养箱中孵育1~4 h。使用酶标仪测定450 nm吸光度值,以溶剂处理的细胞为对照组,不含细胞的培养基为空白组,按公式计算细胞的增殖率。细胞增殖率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.3.7HE染色和Masson染色 收集入组样本组织并固定在4%中性多聚甲醛中,进行石蜡包埋。常规使用苏木精/伊红(HE)染色以进行组织学检查。同时,使用Masson三色染色法,对心房组织内的纤维组织进行定位。使用Image-Pro plus分析系统对纤维化进行半定量评估。
1.3.8动物实验 将小鼠随机分为4组,每组6只:正常对照组(control组)、血管紧张素Ⅱ诱导的纤维化组(Ang-Ⅱ组)、 Ang-Ⅱ+pcDNA组和Ang-Ⅱ+ pcDNA-NRON组。经腹膜注射Ang-Ⅱ 1.5 μg/g/d,持续4周,同时对Ang-Ⅱ+pcDNA组和Ang-Ⅱ+pcDNA-NRON组小鼠经尾静脉注射pcDNA和pcDNA-NRON。2周后,将小鼠麻醉并取出心脏组织进行进一步分析。所有动物实验均得到安徽医科大学附属第一医院动物伦理委员会批准。
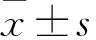
2 结果
2.1 AF患者心房组织中LncRNA NRON的表达和心房纤维化蛋白的表达为了研究lncRNA NRON在AF患者中的表达,收集了AF组和SR组患者的心房组织。与SR患者比较,AF的心房组织中NRON表达明显降低,见图1A。根据纽约心脏协会(NYHA)制定标准,将34例AF患者分为不同的病理等级(Ⅰ~Ⅱ、Ⅲ、Ⅳ)(图1B)。AF患者心房组织中NRON的mRNA水平显着降低。检测心房纤维化相关蛋白的表达,AF心房中胶原Ⅰ和胶原Ⅲ表达水平明显上调(图1C~E),差异有统计学意义(P<0.05)。免疫组织化学结果显示AF心房组织中胶原Ⅰ在心肌间质、血管内皮细胞和血管基底膜中的表达和分布比SR心房组织中更广泛(图1F)。
2.2 LncRNA NRON过表达对心房纤维化的影响从SR患者的心房组织中分离出了心房成纤维细胞,并在体外进行传代培养,通过免疫荧光染色得出的结果表明波形蛋白(vimentin)高表达和肌钙蛋白(troponin)低表达(图2A)。用pcDNA-NRON或siRNA NRON转染心房成纤维细胞,转染效率如图2B所示,用pcDNA-NRON转染的成纤维细胞中NRON的表达高于用pcDNA-vector质粒转染的成纤维细胞,NRON在si-NRON中的表达较低。使用Ang-Ⅱ诱导纤维化后使用CCK-8进行增殖能力检测,结果显示NRON过表达抑制了成纤维细胞增殖,而si-NRON促进了增殖(图2C)。过度表达的NRON明显抑制了Ang-Ⅱ诱导的成纤维细胞中Ⅰ型胶原和Ⅲ型胶原的表达,而si-NRON组与pcDNA组相比差异无统计学意义(P>0.05)(图2D)。NRON明显诱导NFATc3磷酸化,从而导致Ang-Ⅱ诱导的成纤维细胞中p-NFATc3 / NFATc3的比例升高(图2D、E)。如图2F所示,蓝绿色重叠表示成纤维细胞核中的NFATc3表达,Ang-Ⅱ处理组的NFATc3表达比对照组多,NRON过表达抑制了NFATc3从细胞质向细胞核的转运。
2.3 过表达LncRNA NRON对Ang-Ⅱ诱导的小鼠心脏纤维化影响在动物实验结束时测试了小鼠的心脏功能水平和相关的血液动力学指标,结果表明NRON过表达组显著抑制了Ang-Ⅱ诱导的左室舒张末期直径(left ventricular end distolicdimension,LVDd)、左室收缩末期直径 (left ventricular end-systolicdimension,LVDs)、室间隔舒张末期厚度(inter-ventricular septal thickness at diastole,IVSd)、室间隔收缩末期厚度 (interventricular septal thickness at end-systole,IVSs) 的增加,并显著促进了Ang-Ⅱ诱导的左室射血分数(left ventricular ejection fraction,LVEF)和左室射血缩短分数(left ventricular fraction shortening,LVFS)降低(表1)。HE染色结果显示,与对照组比较,Ang-Ⅱ组心肌间质纤维紊乱的发生率更高,而核与核之间的距离更宽,但是pcDNA-NRON减轻了纤维化的发生率,使心肌间质纤维减少(图3A)。通过Masson染色检测心肌纤维化的程度,结果如图3B所示,Ang-Ⅱ组心肌纤维明显增厚且胶原纤维沉积很多。然而,pcDNA-NRON使心肌之间纤维减少变薄,从而改善纤维化。同时,胶原Ⅰ、胶原Ⅲ、NFATc3和p-NFATc3的蛋白质水平结果显示NRON过表达组显着减少了Ang-Ⅱ诱导的心房组织胶原Ⅰ和胶原Ⅲ和NFATc3的表达(图3C、D)。此外,NRON过表达株显著提高了NFATc3的磷酸化水平,导致p-NFATc3/NFATc3的比例增加(图3E、F)。以上的动物实验数据显示,过表达的NRON抑制了小鼠的心脏纤维化。
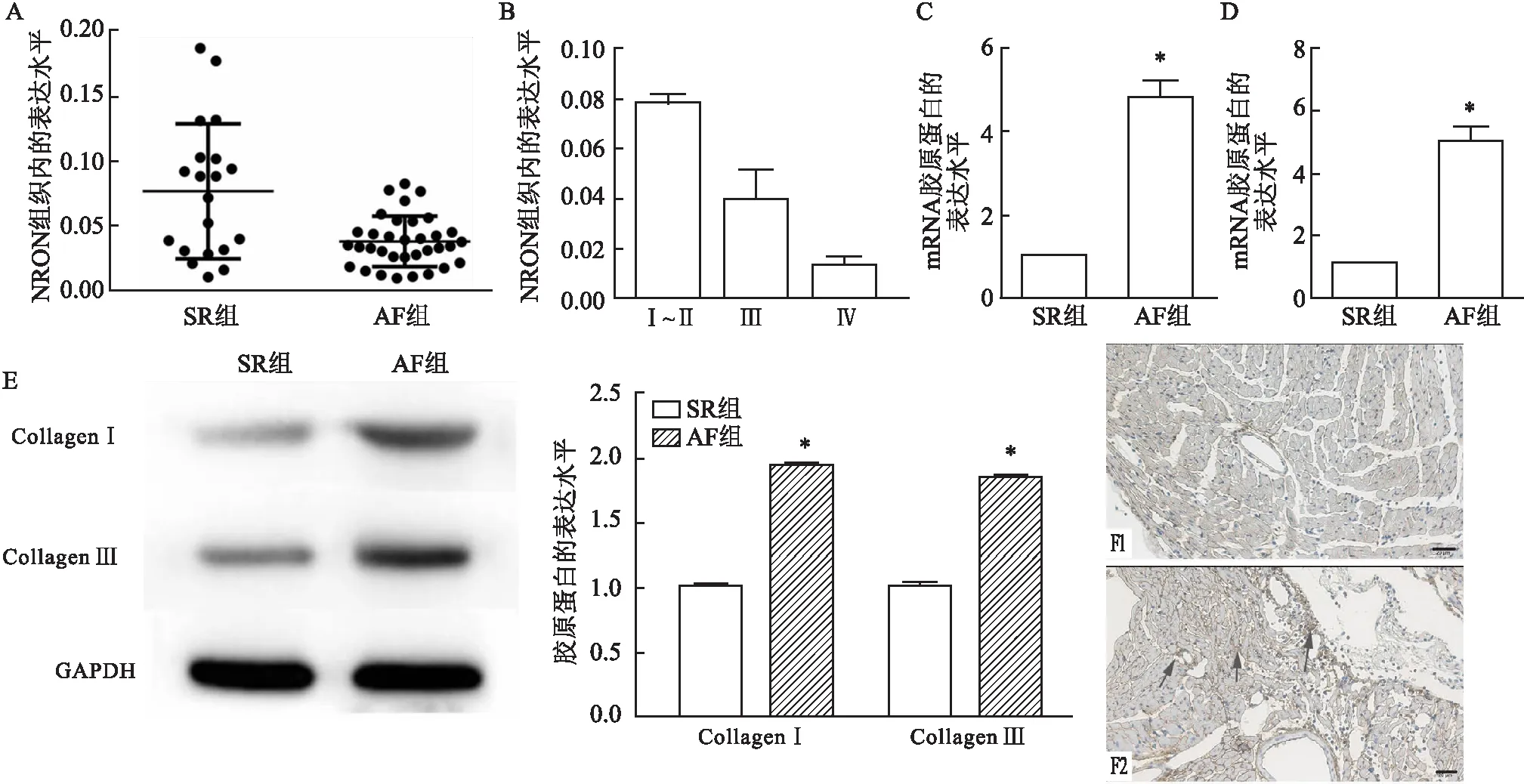
图1 AF中NRON表达和心房纤维化蛋白表达
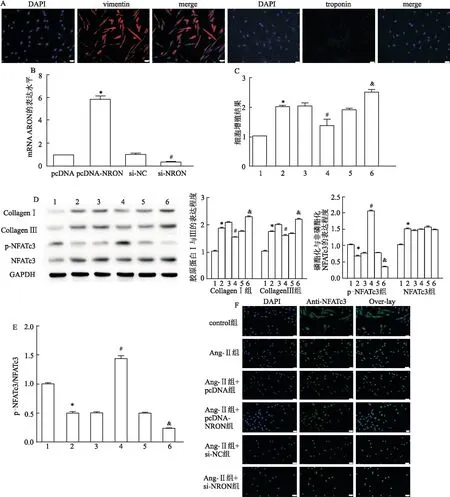
图2 过表达NRON对心房成纤维细胞纤维化影响
表1 过表达NRON对小鼠心脏功能和血液动力学的影响
3 讨论
LncRNA已显示在许多心脏发育或心脏疾病中起关键作用[3]。LncRNA是一组非蛋白质编码的RNA分子,长度大于200个核苷酸。LncRNA在过去曾被认为并不具有调控基因转录及蛋白翻译的作用。但如今越来越多的证据支持LncRNA在健康和疾病中对基因表达调控的生物学意义[4],它们已经参与了许多生物学过程,例如表观遗传调控、细胞周期控制、细胞分化、剪接、核/细胞质运输以及转录/翻译。最近,在心脏和血管系统中已经证明存在有几种与调节功能相关的LncRNA,包括Braveheart、Fendrr、CHRF、MALAT、LIPCAR和SENCR[5-7]。但是,还需要研究其他与AF相关的LncRNA以便更好地了解AF的发病机制。
NFAT是一种受Ca2+调节以控制基因表达的转录因子家族,首次被发现于T淋巴细胞。NFAT的显著特征是其受Ca2+和依赖Ca2+/钙调蛋白的丝氨酸磷酸钙调磷酸酶调节。CaN是一种依赖Ca2+/钙调蛋白的磷酸酶,可将大量的磷酸蛋白去磷酸化[1]。尽管该酶在多种类型的组织和细胞中表达,但其与NFAT转录因子家族的核定位转导的调节密切相关[2]。
有实验[8]表示NRON在心肌组织中表达水平较高,并已通过影响其核运输而被认为是NFAT的阻遏物。本研究,根据qRT-PCR分析得出结论,相对于SR组,AF组患者心房组织样本lncRNA NRON的表达水平较低。已知NFAT是调节细胞内Ca2+稳态和基因表达的关键蛋白,在心脏疾病中其表达和活性发生了很大变化。Sharma et al[9]发现敲除LncRNA NRON的细胞里出现NFAT的去磷酸化和核易位的大量增加,这与本研究关于AF中NRON增强的NFATc3磷酸化的发现一致。NRON对NFAT脱磷酸作用的抑制作用先前归因于其螯合参与核转运的蛋白质的能力,特别是KPNB1、importin-beta和CSE1L,后者将importin-alpha从细胞核循环到细胞质。
磷酸化的NFAT1存在于大的细胞质RNA-蛋白质复合物中,该复合物包含支架蛋白,包含GTPase活化蛋白(IQGAP),钙调蛋白和3个NFAT激酶的IQ基序,酪蛋白激酶1,糖原合酶激酶3和双重特异性酪氨酸磷酸化调节激酶。NRON和IQGAP1的组合敲低增加了刺激后NFAT的去磷酸化和核输入。支架复合物不仅将NFAT定位在促进其在细胞质中处于失活状态的维持激酶附近,而且还可能阻碍钙调神经磷酸酶在静息细胞中接近NFAT,并且还可以作为核转运因子和所需钙调蛋白的储库在刺激的细胞中激活钙调神经磷酸酶。此外,NRON还通过以下途径抑制成纤维细胞增殖抑制NFAT活性,这一结果与肿瘤细胞的作用一致[10]。结合以上结论分析,作为NFAT的阻遏物,NRON是AF中一种抑制纤维化的LncRNA,并可以影响AF的进展过程。
本研究揭示了NRON与AF和心房心肌的纤维化进程有关。此外,验证了NRON抑制成纤维细胞的增殖以及Ⅰ型和Ⅲ型胶原的表达。临床证据和体外分析均表明NRON可通过促进AF中NFATc3磷酸化来减轻心房纤维化。这一发现为AF在分子层面的发展机制提供了新的见解,有望为AF治疗提供新的干预靶点。

图3 过表达NRON对Ang-Ⅱ诱导的小鼠心脏纤维化影响
