土茯苓降尿酸活性成分研究
2020-12-03徐梦琪徐德平
徐梦琪,徐德平
江南大学食品学院,无锡 214122
在人体代谢机制中,黄嘌呤氧化酶(xanthine oxidase,XOD)能催化黄嘌呤和次黄嘌呤产生尿酸,是人体内尿酸生成关键的酶。XOD抑制剂可通过抑制XOD活性,从而减少尿酸的生成,被认为是治疗高尿酸血症的潜在因素。高尿酸血症与肿瘤、心血管疾病、肾病以及三高等疾病密切相关[1-4]。临床常用降尿酸药物别嘌呤醇和秋水仙碱及其他合成药常伴随着耐受性差、肝肾功能损害和肠胃反应等[5],限制了这些药物在临床上的应用。因此寻找天然来源的抗高尿酸血症活性药物一直是国内外研究的热点。
土茯苓为百合科植物光叶菝葜(SmilaxglabraRoxb.)的干燥根茎,又名禹余粮、冷饭团、红土苓等。土茯苓中主要化学成分有黄酮类、生物碱类、皂苷类、多糖类等。药理研究显示,其在体外抑菌、免疫抑制、抗炎镇痛、治疗肾病、保护心脑血管系统方面有明显疗效。临床常用治疗高尿酸血症及痛风的药物中均含有土茯苓[6,7]。Shi[8]、Zhang[9]等研究发现复方土茯苓颗粒能使高尿酸血症患者的尿酸有效降低,且远期疗效和安全性好。目前对土茯苓的研究多集中在粗提物或复方的作用机制,对其降尿酸的具体功效成分尚不清楚。
本文通过建立高血尿酸小鼠模型,对土茯苓中降尿酸的活性成分进行系统分离和筛选,结合黄嘌呤氧化酶体外抑制实验,寻找降尿酸的功效化合物,旨在明确土茯苓中降尿酸的物质基础,为降尿酸药物的开发提供理论依据。
1 实验材料
1.1 材料与试剂
土茯苓(安徽亳州中药材市场);硅胶板(GF254,山东烟台芝罘化厂);无水乙醇、正丁醇、冰醋酸、茴香醚、浓硫酸、磷酸氢二钠、磷酸二氢钠、二甲亚砜(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,国药集团化学试剂有限公司);大孔吸附树脂(AB-8型,天津南开大学化学工厂);ODS填料(Nacalai Tosoh Inc);MCI GEL填料(Mitsubishi Chemical Corporation);黄嘌呤、次黄嘌呤、氧嗪酸钾(批号:B31M9D62661,纯度﹥98%, 上海源叶生物有限公司);黄嘌呤氧化酶(BR,50 U/mg protein,上海源叶生物有限公司);别嘌醇片(合肥久联制药有限公司);SPF级雄性ICR小鼠(上海斯莱克实验动物有限公司)。
1.2 实验仪器
提取罐(RAT-100型,无锡申科仪器有限公司);旋转蒸发器(R-1002型,上海申顺生物科技有限公司);恒流泵(SYB 106-100型,天津市科器高新技术公司);暗箱式紫外透射仪(ZF-90型,上海顾氏光电仪器有限公司);可见分光光度计(HY-727 S型,无锡市英之诚高速分析仪器有限责任公司);pH计(PHS-3E型,上海仪电科学仪器股份有限公司);核磁共振仪(Avance 500 MHz,美国Bruker公司)。
2 实验方法
2.1 土茯苓提取物制备与粗分离
称取土茯苓10,粉碎后过40目筛,置于100 L提取罐中,以1∶10(g∶mL)料液比加入体积分数75%的乙醇,60 ℃条件下搅拌提取4 h,过滤,取滤液,滤渣按上述方法再次醇提,取滤液。合并两次滤液,减压浓缩至合适体积,即为土茯苓醇提物。滤渣再以1∶10(g∶mL)料液比加入去离子水,65 ℃条件下搅拌提取4 h,过滤取滤液,减压浓缩至合适体积,即为土茯苓水提物。将土茯苓醇提物与水提物合并,即得到土茯苓的混合提取物,于-25 ℃冷冻保存。
取适量土茯苓混合提取物上AB-8型大孔树脂柱(10 cm×150 cm)[10],依次用水,30%,70%,95%的乙醇进行梯度洗脱,薄层色谱法(TLC)跟踪监测洗脱液中的成分,并根据TLC检测结果将具有相同成分的洗脱液合并,得到A(水洗脱)、B(30%洗脱)、C(70%洗脱)、D(95%洗脱)4个组分。将各组分分别减压浓缩后冷冻保存。
2.2 土茯苓粗组分降尿酸活性的检测
四周龄 SPF 级雄性小鼠购回后适应性喂养7天,饲养温度为25 ℃,相对湿度为50%,动物照度为15 LX。将小鼠随机分为7组,每组10只。各实验组按1.0 g/(kg·d)剂量灌胃相应的洗脱组分,别嘌呤醇作为阳性对照组按30 mg/(kg·d)剂量给药,空白组和模型组则给正常饮用水,连续灌胃7天。
除空白组外,其余各组在末次给药1 h前腹腔注射氧嗪酸钾和次黄嘌呤,剂量均为300 mg/kg,造成小鼠高血尿酸模型,空白组腹腔注射0.5%的CMC-Na。
各组小鼠在末次给药1 h后,摘眼球取血,离心机分离血清后采用全自动生化分析仪测定其血清尿酸(UA)、肌酐(CRE)、总蛋白(TP)、白蛋白(ALB)。采用双缩脲法测定TP含量,溴甲酚绿法测定ALB含量,肌氨酸氧化酶法测定CRE含量,计算A∶G=ALB∶(TP-ALB)。
2.3 大孔树脂洗脱活性组分的分离
将具有降尿酸活性的C组分上样到MCI柱(5 cm×100 cm),依次用30%、50%和95%的乙醇进行梯度洗脱,流速15 mL/min,自动收集器每管20 mL收集洗脱液,用TLC法跟踪监测洗脱液中的成分,并根据Rf值和显色反应的结果合并相同组分,得到C-1(30%洗脱)、C-2(50%洗脱)、C-3(95%洗脱)三个组分。
2.4 MCI柱洗脱组分降尿酸活性的检测
按2.2方法对MCI柱分离得到的C-1、C-2、C-3三个组分进行动物实验,测定各组分的降尿酸活性。
2.5 降尿酸的单一成分分离与结构鉴定
将具有降尿酸活性的C-1组分反复上样到ODS柱(3 cm×100 cm),直至得到5个单体化合物1~5。以氘代二甲亚砜为溶剂,进行1H NMR和13C NMR等光谱数据分析,确定其结构。
2.6 单体化合物对XOD活性的抑制作用
由于分离到的单体化合物的量不足以做动物实验,则采用XOD体外抑制实验,测定其对XOD活性的抑制作用。
2.6.1 XOD活力的测定
XOD的活力测定是基于黄嘌呤在XOD的催化作用下生成尿酸,尿酸在294 nm处有特征吸收峰[11]。
实验方法参考文献[12]并加以改进,在石英比色皿中加入2.5 mL 0.2 mol/L的磷酸盐缓冲溶液(pH 7.5)、1 mL 0.1 mmol/L的黄嘌呤氧化酶(终浓度为0.025 mmol/L)和0.5 mL 2 U/mL的黄嘌呤氧化酶溶液(终浓度为0.25 U/mL),充分混合。在 294 nm 条件下运用动力学软件,从酶加入时开始监测,每1 s测定反应的吸光度值,连续测定3 min。以吸光度对时间作图,进行线性回归,计算斜率Rate酶(dA/s),平行操作三次,取斜率平均值。测定前将1 mL的黄嘌呤溶液和3 mL的PB在比色皿充分混合后进行调零校准。
2.6.2 样品与别嘌呤抑制率的测定
在石英比色皿中加入2 mL的缓冲盐溶液、1 mL的黄嘌呤氧化酶、0.5 mL 160 μg/mL的各样品溶液及别嘌呤溶液(终浓度为20 μg/mL)和0.5 mL的黄嘌呤氧化酶溶液,充分混合。测定方法同“2.6.1”。各组分对黄嘌呤氧化酶的抑制率为:I=[(Rate酶-Rate样品)/Rate酶]×100%。
2.7 数据处理

3 实验结果
3.1 大孔树脂粗组分降尿酸活性分析
经大孔树脂分离的各组分对小鼠血清UA、CRE、TP、ALB、A∶G的影响如表1所示。由表1可知,与空白组相比,模型组小鼠的血尿酸值显著升高(P<0.01),则说明高血尿酸小鼠模型建立成功。相较于空白组,模型组的血肌酐值显著升高(P<0.01),白球比显著降低(P<0.01),则说明在高尿酸状态下,小鼠的肾脏和肝脏都有明显损伤。作为阳性对照组的别嘌呤能够使小鼠的血尿酸值显著降低(P<0.01),但其肌酐值与白球比相比于模型组并无明显变化,说明别嘌呤并不能改善小鼠由于高尿酸造成的肝肾损伤。
由表可知,样品C能够显著降低(P<0.01)高尿酸症小鼠的血尿酸值,且相比于模型组其肌酐值有显著降低(P<0.01),白球比有显著升高(P<0.01),则说明C组分是土茯苓中降尿酸的活性成分,且其对高尿酸导致的小鼠肝肾损伤有一定的改善。对土茯苓大孔树脂70%乙醇洗脱物(C)进行进一步的分离纯化。
3.2 MCI洗脱各组分降尿酸活性分析
经大孔树脂分离的各组分对小鼠血清UA、CRE、TP、ALB、A∶G的影响如表2所示。由表2可知,各组分中只有C-1组显著降低(P<0.01)了高尿酸小鼠的血尿酸值,说明其是降低尿酸的有效成分。相比于模型组,C-1组的肌酐值显著降低,白球比显著升高,说明C-1组在降低小鼠尿酸的同时也能明显改善其由于高尿酸导致的肝肾损伤。对MCI柱30%乙醇洗脱物(C-1)进行下一步的分离纯化。
3.3 单体化合物的鉴定
化合物1白色粉末,不溶于水,易溶于乙醇、甲醇;1H NMR(500 MHz,DMSO-d6)δ:6.89(1H,s),6.74(2H,s),5.91(1H,d,J=2.5 Hz),5.88(1H,d,J=2.5 Hz),5.24(1H,d,J=10 Hz),4.65(1H,d,J=10 Hz),4.02(1H,s),3.15~3.90(4H,m),1.06(3H,d,J=6.5 Hz);13C NMR(125 MHz,DMSO-d6)δ:194.7(C-4),167.0(C-7),163.5(C-5),162.2(C-9),145.9(C-3′),145.2(C-4′),127.0(C-1′),119.0(C-6′),115.4(C-5′),114.8(C-2′),101.1(C-10),100.1(C-1′′),96.1(C-6),95.1(C-8),81.6(C-2),75.7(C-3),71.7(C-4′′),70.5(C-3′′),70.2(C-2′′),69.0(C-5′′),17.8(C-6′′)。以上数据与文献[13]报道一致,因此鉴定该化合物为落新妇苷。

表1 大孔树脂洗脱各组分对高血尿酸症小鼠血清UA、CRE、TP、ALB、A∶G的影响Table 1 Effects of macroporous resin elution on serum UA,CRE,TP,ALB,A∶G in hyperuricemia mice

表2 MCI洗脱各组分对高血尿酸症小鼠血清UA、CRE、TP、ALB、A∶G的影响Table 2 Effects of MCI elution of components on serum UA,CRE,TP,ALB,A∶G in hyperuricemia
化合物2淡黄色粉末,不溶于水,易溶于乙醇、甲醇;1H NMR(500 MHz,DMSO-d6)δ:6.88(1H,s),6.75(2H,s),5.85(1H,d,J=2 Hz),5.82(1H,d,J=2 Hz),5.20(1H,d,J=9.5 Hz),4.70(1H,d,J=11 Hz),4.02(1H,s),3.15~3.90(8H,m),1.06(3H,d,J=6.5 Hz),1.02(3H,d,J=6 Hz);13C NMR(125 MHz,DMSO-d6)δ:195.4(C-4),169.3(C-7),164.0(C-5),162.5(C-9),146.0(C-3′),145.2(C-4′),127.7(C-1′),119.4(C-6′),115.4(C-5′),114.8(C-2′),101.3(C-10),100.6(C-1′′),100.4(C-1′′′),96.8(C-6),95.6(C-8),81.4(C-2),75.6(C-3,C-2′′),71.7(C-4′′),71.3(C-4′′′),70.5(C-3′′),70.4(C-3′′′),70.2(C-2′′′),69.9(C-5′′),69.0(C-5′′′),17.8(C-6′′),17.7(C-6′′′)。从1H NMR和13C NMR可知,该化合物与化合物1结构类似,不同的是化合物2的糖上有12个碳信号,从糖的信号来看为两个鼠李糖残基。从δ75.6碳信号来分析,鼠李糖的2号位被取代。鉴定该化合物为花旗松素-3-O-α-L-吡喃鼠李糖基-α-L-吡喃鼠李糖苷。
化合物3淡黄色粉末,不溶于水,易溶于乙醇、甲醇;1H NMR(500 MHz,DMSO-d6)δ:11.83(1H,s),7.34(2H,d,J=8.5 Hz),6.80(2H,d,J=8.5 Hz),5.96(1H,d,J=2.0 Hz),5.88(1H,d,J=2.0 Hz),5.29(1H,d,J=10.4 Hz),4.76(1H,d,J=10.4 Hz),3.95(1H,br s),3.10~3.92(4H,m),1.06(3H,d,J=6.3 Hz);13C NMR(125 MHz,DMSO-d6)δ:194.9(C-4),167.1(C-7),163.5(C-5),162.3(C-9),157.9(C-4′),129.2(C-6′,C-2′),126.6(C-1′),115.3(C-3′,C-5′),101.1(C-10),100.4(C-1′′),96.2(C-6),95.2(C-8),81.6(C-2),76.1(C-3),71.7(C-4′′),70.5(C-3′′),70.2(C-2′′),69.1(C-5′′),17.8(C-6′′)。化合物3与化合物1相似,仅在B环不同,通过与文献[14,15]比对,鉴定该化合物为黄杞苷。
化合物4淡黄色粉末,不溶于水,易溶于乙醇、甲醇;1H NMR(500 MHz,DMSO-d6)δ:7.26(2H,d,J=8.6 Hz),6.76(2H,d,J=8.6 Hz),5.95(1H,d,J=2.0 Hz),5.92(1H,d,J=2.0 Hz),5.60(1H,d,J=2.4 Hz),4.73(1H,br s,H-1′′),4.16(1H,d,J=2.4 Hz),2.3~3.45(4H,m),0.80(3H,d,J=6.2 Hz);13C NMR(125 MHz,,DMSO-d6)δ:194.8(C-4),167.6(C-7),163.5(C-5),162.6(C-9),157.9(C-4′),129.1(C-6′,C-2′),127.8(C-1′),115.2(C-3′,C-5′),100.9(C-10),100.1(C-1′′),96.4(C-6),95.3(C-8),81.5(C-2),76.0(C-3),71.6(C-4′′),70.4(C-3′′),70.2(C-2′′),69.0(C-5′′),17.8(C-6′′)。对比文献[14,15],鉴定该化合物为异黄杞苷。
化合物5红褐色粉末,不溶于水,易溶于乙醇、甲醇;1H NMR(500 MHz,DMSO-d6)δ:7.40(2H,d,J=8.5 Hz),6.95(1H,d,J=16 Hz),6.84(1H,d,J=16.5 Hz),6.77(2H,d,J=8 Hz),6.41(1H,s),6.15(1H,s);13C NMR(125 MHz,DMSO-d6)δ:158.6(C-4,C-4′),157.4(C-9),139.4(C-8),128.1(C-1′),128.0(C-2′,C-6′),125.7(C-6),115.7(C-3′,C-5′),104.4(C-2),101.9(C-7)。由13C NMR可知该化合物有11个碳信号,其中有6个为苯环上的碳信号,由化学位移可知该苯环为对位取代。余下的5个碳信号,结合1H NMR谱,推测为吡咯并嘧啶结构,结合HMBC谱,该化合物中吡咯并嘧啶的结构为吡咯并[3,2-d]嘧啶。从δ158.6、157.4碳信号来分析,吡咯并嘧啶的4号位被取代。鉴定该化合物为4-(吡咯并[3,2-d]嘧啶-4-基)苯酚,该化合物在土茯苓中首次发现。
通过以上分析得出化合物1~5的结构如图1所示。
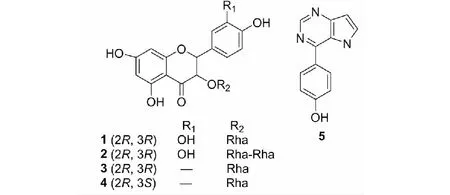
图1 化合物1~5的化学结构Fig.1 The chemical structures of compounds 1-5
3.4 单体化合物对XOD活性抑制作用分析
5个单体化合物对XOD的抑制效果如表3所示。从表中可知,化合物2~5均能显著(P<0.01)降低黄嘌呤氧化过程的速率,明显抑制XOD活性,由此可知化合物2~5均是有效的XOD抑制剂。其中化合物5的抑制率达到了80.47%±3.83%,其抑制效果与阳性对照组别嘌呤无显著差异(P<0.01)。
表3 化合物1~5对XOD活性的影响Table 3 Effect of compound 1-5 on XOD activity
黄杞苷(3)与异黄杞苷(4)为一对异构体,构型分别为(2R,3R)和(2R,3S)。由表可知,其抑制率基本一致,则说明这一空间构型的变化对XOD活性的抑制效果没有影响。
4 结论
土茯苓醇提物大孔树脂70%乙醇洗脱组分具有降尿酸的活性,该组分经MCI分离后,降尿酸的组分集中在MCI 30%乙醇洗脱物中,对其进一步分离得到5个单体化合物,分别为落新妇苷、花旗松素-3-O-α-L-吡喃鼠李糖基-α-L-吡喃鼠李糖苷、黄杞苷、异黄杞苷、4-(吡咯并[3,2-d]嘧啶-4-基)苯酚,其中花旗松素-3-O-α-L-吡喃鼠李糖基-α-L-吡喃鼠李糖苷和4-(吡咯并[3,2-d]嘧啶-4-基)苯酚为首次在土茯苓中发现。经过黄嘌呤氧化酶的体外抑制实验,初步判断土茯苓中具有降尿酸活性的是花旗松素-3-O-α-L-吡喃鼠李糖基-α-L-吡喃鼠李糖苷、黄杞苷、异黄杞苷和4-(吡咯并[3,2-d]嘧啶-4-基)苯酚,落新妇苷体外对黄嘌呤氧化酶无抑制作用。
有关土茯苓降尿酸的活性成分,目前研究都认为是土茯苓中的黄酮类化合物在起作用[16,17]。本文分离得到4-(吡咯并[3,2-d]嘧啶-4-基)苯酚对黄嘌呤氧化酶抑制率虽然很高,但其在土茯苓中含量低,而花旗松素-3-O-α-L-吡喃鼠李糖基-α-L-吡喃鼠李糖苷、黄杞苷和异黄杞苷在土茯苓中含量高,故推测黄杞苷和异黄杞苷为土茯苓粗组分中主要起降尿酸活性的物质。本文试验分离得到的4个有效的黄嘌呤氧化酶抑制剂体内降尿酸作用有待进一步实验验证。
