N-烷基羟胺与苯丙炔酸酯的加成反应合成β-氨基酸衍生物硝酮*
2020-12-02张志豪李宁杰曾宇航刘益林
张 豪,张志豪,李宁杰,孙 禺,曾宇航,刘益林
(怀化学院化学与材料工程学院,湖南 怀化 418008)
硝酮是一类非常重要的偶极子,通过与多种多样的亲偶极子发生偶极环加成反应可以构筑杂环化合物,因而被广泛应用于天然产物和生物活性分子的合成中,硝酮的合成引起了化学家们的极大关注,人们发展了许多硝酮合成方法,如取代的胺、羟胺、亚胺的氧化反应、羰基化合物与羟胺的缩合反应等是常用的制备硝酮的方法[1]。近年来,化学家们报道了许多新颖的硝酮合成方法[2]。2014年,Nakamura课题组[3]报道了一种O-炔丙基羟胺在铜的催化下高效转化为N-烷基α,β-不饱和的酮硝酮的策略;2017年,Mo等[4]发展了一种铜催化吲哚酮肟与烯基硼酸的交叉偶联反应合成N-烯基吲哚酮硝酮的方法,该方法底物范围广,选择性高、反应条件温和,控制实验表明吲哚酮中的羰基在N-烯基化过程中起到了非常关键的作用。这些方法虽然为新型硝酮的合成提供很好途径,但需要使用过渡金属催化剂。羟胺与炔烃的加成反应是合成硝酮的一种非常重要方法,Winterfeldt[5]首次报道了N-烷基羟胺与丁炔二酸二酯的加成反应合成硝酮;非活化的炔烃也能与N-烷基羟胺加成生成硝酮,但该方法需要高温而且产率不高[6]。最近,我们发展了常温下,没有过渡金属参与的,羰基导向的N-烷基羟胺与非活化炔烃的加成反应合成酮硝酮,该方法具有很好的化学选择性、区域选择性和立体选择性[7]。2010年,Dujardin等[8]通过α-酮酸酯与N-烷基羟胺的缩合反应合成α-硝酮羧酸酯,该方法具有很好的立体选择性。这里,我们报道一种N-烷基羟胺与苯丙炔酸酯的加成反应,合成β-硝酮羧酸酯的方法。
1 实 验
1.1 仪器和试剂
GC-MS QP-2010联用仪,日本岛津;400型核磁仪,Bruker;DF-101S集热式恒温加热磁力搅拌器,巩凡市予华仪器有限责任公司;常用玻璃仪器,北京欣维尔玻璃仪器有限公司。
苯丙炔酸乙酯,苯丙炔酸甲酯,苄基羟胺盐酸盐,环己基羟胺盐酸盐,EtN(Me)2,EtN(n-Pr)2,Et2NCH3,DABCO,Et2NH,1-碘萘,丙炔酸乙酯,碘化亚铜,PdCl2(PPh3)2为进口分析纯试剂,溶剂等为国产试剂。
1.2 典型实验方法
在Schlenk管中加入苯丙炔酸乙酯1a(52.3 mg,0.3 mmol),苄基羟胺盐酸盐2a(47.9 mg,0.3 mmol),Et2NMe(34.0 mg,0.39 mmol),甲苯(1.0 mL),密封后于室温下反应,用TLC板监控反应完全后,旋转蒸发出溶剂,最后用适宜比例的石油醚和乙酸乙酯作流动相,经柱层析分离提纯得目标产物3a(77.6 mg),产率87%。
1.3 产物的表征
1.3.1 (Z)-N-benzyl-3-ethoxy-3-oxo-1-phenylpropan-1-imine oxide(3a)
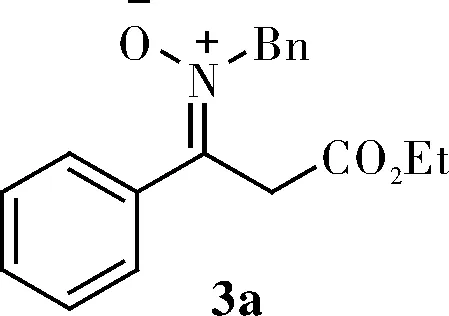
Light yellow oil;1H NMR(400 MHz, CDCl3)δ 7.96(d,J=8.0 Hz, 0.1H), 7.60~7.46(m, 2H), 7.43(d,J=8.0 Hz, 2H),7.34~7.27(m, 5H), 7.11(t,J=4.0 Hz, 0.9H), 5.44(s, 0.4H), 5.04(s, 1.4H), 4.70(s, 0.9H), 4.16(q,J=8.0 Hz, 1.5H), 4.06(s, 0.1H), 3.99(s, 0.1H), 3.80(s, 1.3H), 3.70(q,J=8.0 Hz, 0.2H), 1.26(t,J=4.0 Hz, 0.7H), 1.21(t,J=4.0 Hz, 2.2H);13C NMR(100 MHz, CDCl3)δ 171.0, 169.2, 168.3, 144.2, 135.1, 134.1, 132.9, 131.8, 129.8, 129.6, 129.2, 128.9, 128.8, 128.7, 128.7, 128.3, 128.2, 128.2, 128.0, 127.8, 93.3, 64.1, 61.4, 57.3, 40.1, 14.2; HRMS(ESI)calcd for C18H20NO3[M+H]+298.1438,found 298.1441。
1.3.2 (Z)-N-benzyl-3-methoxy-3-oxo-1-phenylpropan-1-imine oxide(3b)

Light yellow oil;1H NMR(400 MHz, CDCl3)δ 7.94(d,J=8.0 Hz, 0.1H), 7.60~7.48(m, 2H), 7.44~7.41(m, 2H),7.34~7.27(m, 5H), 7.13~7.10(m, 1H), 5.43(s, 0.5H), 5.04(s, 1.4H), 4.70(s, 1H), 4.05(s, 0.1H), 4.01(s, 0.1H), 3.80(s, 1.5H), 3.75(s, 0.2H), 3.71(s, 2H), 3.45(s, 0.2H);13C NMR(100 MHz, CDCl3)δ 170.9, 169.3, 168.8, 144.0, 135.1, 134.2, 133.0, 131.9, 129.8, 129.6, 129.2, 129.2, 129.0, 128.9, 128.8, 128.8, 128.7, 128.7, 128.3, 128.3, 128.2, 128.1, 127.9, 127.7, 93.3, 64.2, 58.5, 57.4, 52.4, 45.9, 39.9, 29.9。
1.3.3 (Z)-N-benzyl-3-ethoxy-1-(naphthalen-1-yl)-3-oxopropan-1-imine oxide(3c)
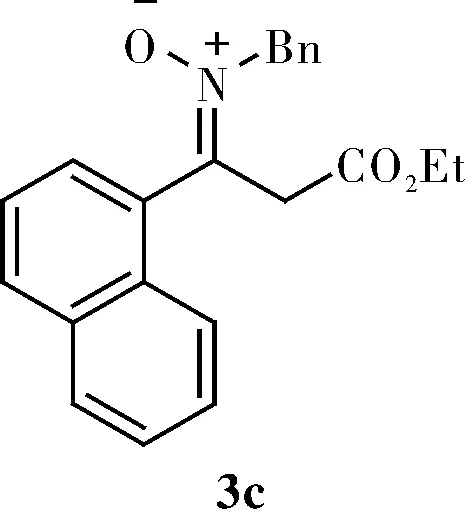
Light yellow oil;1H NMR(400 MHz, CDCl3)δ 7.96~7.93(m, 2H), 7.87(t,J=6.0 Hz, 1H), 7.60~7.55(m, 2H), 7.52~7.46(m, 2H), 7.26(d,J=4.0 Hz, 3H), 7.18~7.16(m, 2H),4.87(s, 2H), 4.18(q,J=8.0 Hz, 2H), 4.05(d,J=16.0 Hz, 1H), 3.62(d,J=16.0 Hz, 1H), 1.21(t,J=8.0 Hz, 3H);13C NMR(100 MHz, CDCl3)δ 168.3, 142.5, 134.0, 133.8, 132.2, 130.7, 130.5, 129.0, 128.8, 128.6, 128.4, 127.8, 127.3, 127.1, 125.5, 124.9, 64.7, 61.4, 40.1, 14.2。
1.3.4 (Z)-N-cyclohexyl-3-ethoxy-1-(naphthalen-1-yl)-3-oxopropan-1-imine oxide(3d)
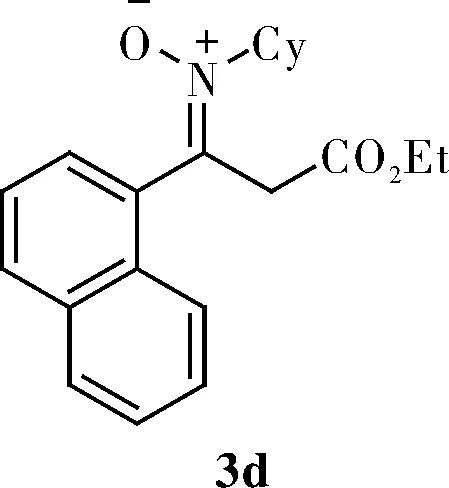
Light yellow oil;1H NMR(400 MHz, CDCl3)δ 7.95~7.89(m, 3H), 7.59~7.48(m, 4H), 4.18(q,J=8.0 Hz, 2H), 3.95(q,J=16.0 Hz, 1H), 3.85~3.77(m, 1H), 3.53(q,J=16.0 Hz, 1H), 2.14~1.98(m, 2H), 1.86(d,J=12.0 Hz, 2H), 1.74~1.64(m, 3H), 1.47(d,J=12.0 Hz, 1H), 1.25(t,J=8.0 Hz, 3H), 0.99~0.79(m, 2H);13C NMR(100 MHz, CDCl3)δ 168.4, 140.2, 133.9, 132.6, 130.9, 130.1, 128.9, 127.6, 126.9, 126.3, 125.6, 124.7, 68.1, 61.2, 40.0, 29.9, 24.9, 24.8, 24.6, 14.2; HRMS(ESI)Calcd forC21H26NO3[M+H]+340.1907, found 340.1906。
2 结果与讨论
2.1 反应条件的优化
我们以苯丙炔酸乙酯和苄基羟胺盐酸盐的加成反应为模板,探究了制备硝酮的可行性。在前期的研究基础上,我们发现用Et3N作碱于DCM中,苯丙炔酸乙酯和苄基羟胺盐酸盐的加成反应能顺利进行,生成了中等产率的目标产物硝酮2a。接下来,我们进一步筛选了反应溶剂,结果如表1所示,在所使用的溶剂中,反应都能顺利进行,生成中等到优秀产率的硝酮。氯代溶剂的反应效果一般(表1,Entries 1~3)。令我们高兴的是,换用THF做溶剂时,反应的活性明显增加,产率提高至71%(表1,Entry 4)。dioxane同样给出了相同的反应效果(表1,Entry 5)。当加成反应在EA中进行时,目标产物的产率提高至82%(表1,Entry 6)。在非极性溶剂苯中的加成反应给出了高达88%的产率的硝酮产物,甲苯中反应具有同样效果(表1,Entries 8~9)。综合考虑,我们确定甲苯作为苯丙炔酸乙酯和苄基羟胺盐酸盐的加成反应的最优溶剂。

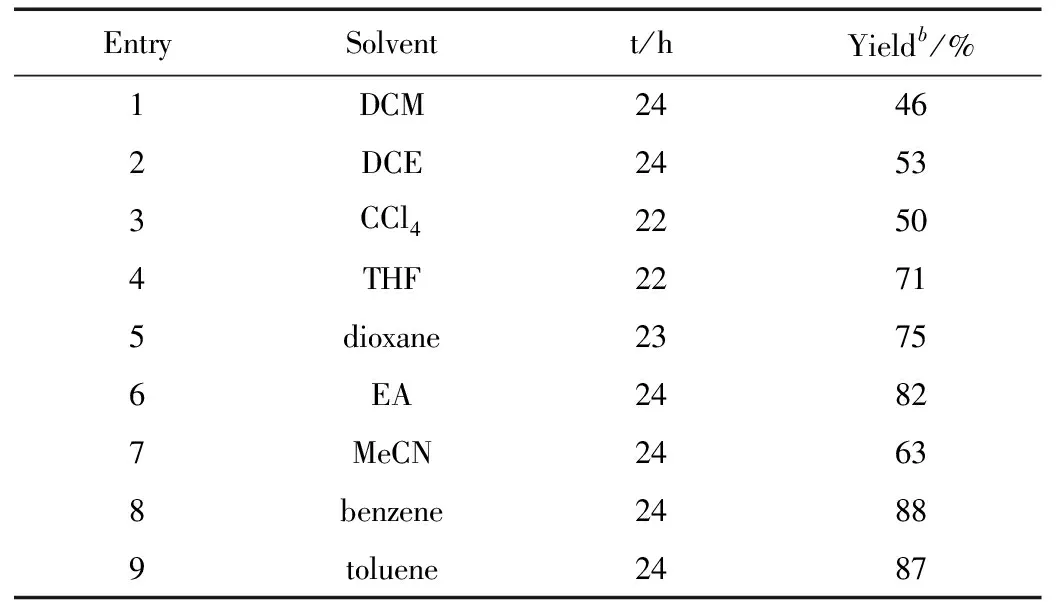
表1 反应溶剂的优化a
接着,我们以甲苯做溶剂,考察了各种碱对加成反应的影响,如表2所示,结果表明碱对反应效果的影响很大。当加成反应使用各种有机碱时,反应都给出了优秀产率的硝酮(表2,Entries 1~6),其中Et2NCH3做碱的反应给出了89%的产率(表2,Entry 2);使用二级胺Et2NH时,反应也能顺利进行,生成了78%的目标产物(表2,Entry 5)。相对于有机碱而言,无机碱的反应效果较差,如使用KOAc做碱,反应只给出了51%的产率(表2,Entry 7)。碱的用量还可以降至1.3 equiv,反应的效果基本不变(表2,Entry 8)。升高温度至50 ℃,反应活性虽然增加,但产率有所下降(表2,Entry 10)。因此,我们确定苯丙炔酸乙酯和苄基羟胺盐酸盐的加成反应生成硝酮的最优条件是:用1.3 equiv Et2NCH3做碱,toluene为溶剂,在常温下反应(表2,Entry 8)。
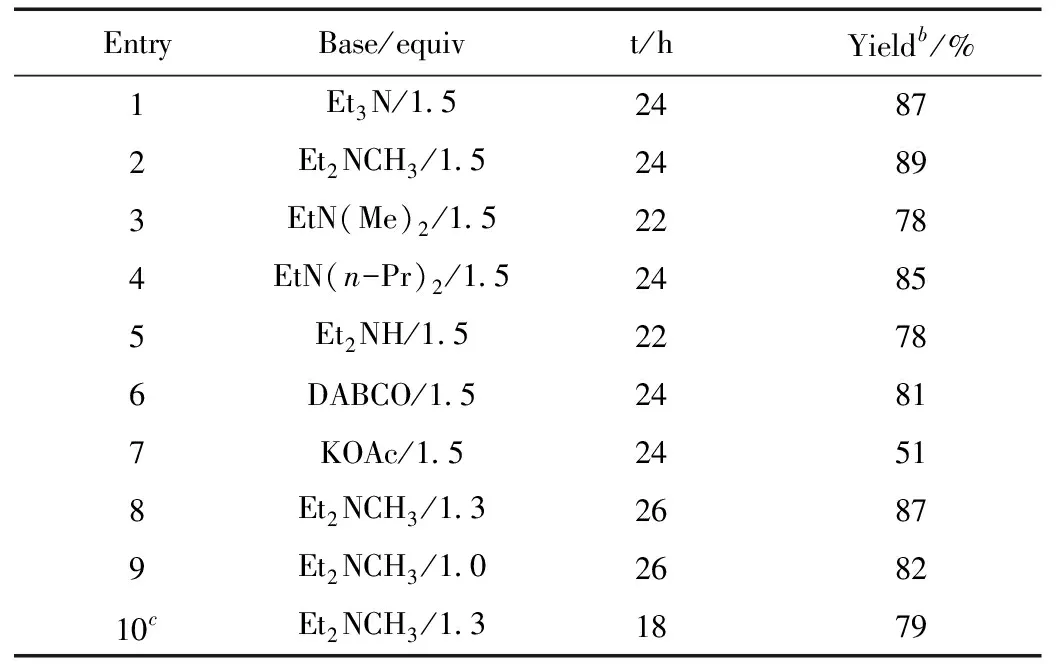
表2 碱的筛选a
2.2 底物拓展

在最佳的反应条件下,我们考察了反应的底物范围,代表性的结果如表3所示,3种苯丙炔酸酯和2种烷基羟胺的反应都表现出了非常高的反应活性,当换用苯丙炔酸甲酯时,反应给出了产率高达89%的目标产物硝酮3b(表3,entry 2)。值得注意的是,苯丙炔酸乙酯和苯丙炔酸甲酯的反应产物都存在Z式和E式,以Z式为主(表3,entry 1,Z:E=3:1; entry 2,Z:E=2:1),主要原因是苯基和N上的苄基存在空间范德华斥力(图1)。把苯基换成萘基,通过增加范德华斥力,反应得到了单一的硝酮产物(表3,entries 3~4);当把苄基羟胺换成亲核性更强的环己基羟胺时,加成反应给出了更高的产率。

表3 底物范围a

图1 Z-式异构体稳定的原因
3 结 论
我们首次实现了苯丙炔酸酯衍生物和N-烷基羟胺的加成反应,以78%~89%的产率合成了β-氨基酸衍生物硝酮,硝酮的Z,E式异构体可以有效通过范德华斥力来调节,而且反应条件温和。更重要的是,这类硝酮可以通过选择性的还原将得到β-氨基酸酯,因而具有重要的潜在应用价值。
