黄秋葵对南方根结线虫抗性的转录组分析
2020-12-02练冬梅赖正锋姚运法林碧珍洪建基
练冬梅 赖正锋 姚运法 林碧珍 洪建基
(福建省农业科学院亚热带农业研究所,福建 漳州 363005)
黄秋葵(AbelmoschusesculentusL.)锦葵科(Malvaceae)秋葵属(Abelmoschus)[1],又名秋葵(okra)、补肾草、咖啡葵等,一年或多年生草本植物。原产于非洲,20世纪20年代初从印度引入我国。黄秋葵作为一种特色的保健型蔬菜,在广东、福建、山东等地区均有大规模种植[2]。在福建省,漳州地区每年黄秋葵种植面积累计达到1 333 hm2,建宁、泰宁和将乐等地区种植的黄秋葵品种洋辣、痴椒也已有百年之久[3]。黄秋葵根结线虫病害主要由南方根结线虫(Meloidogyneincognita)引起[4]。随着黄秋葵生产规模化、设施化和连作化,南方根结线虫已成为分布最广、危害最大的植物寄生线虫之一,严重影响黄秋葵的生长和产量[5]。因此,黄秋葵南方根结线虫病防控技术的研究受到越来越多关注,包括黄秋葵嫁接玫瑰茄砧木[6]、筛选抗病品种[5,7-8]等手段。抗性品种的选育或抗性基因的挖掘与利用是防治黄秋葵南方根结线虫最有效的方法之一。
基于测序技术的进步,近年来在番茄[9]、甘薯[10]、烟草[11]、火参果[12]、苜蓿[13]等植物上已利用转录组测序技术对寄主与南方根结线虫分子互作机制进行了较深入的研究。邢雪霞[11]对抗、感南方根结线虫病烟草表达的289个差异基因进行功能注释和富集分析,发现细胞壁修饰、蛋白激酶、激素信号转导和转录因子等相关基因共同参与了烟草抗线虫反应。Ye等[12]发现火参果木质素的沉积、有毒化合物的合成、细胞壁的增强、线虫摄食的抑制和抗性蛋白的积累以及多种转录因子的激活都可能参与了南方根结线虫的抗性反应。Olga等[13]研究了苜蓿抗感材料在被南方根结线虫侵染时的差异表达基因,认为常见基因如抗病蛋白、类受体蛋白、假想蛋白等的差异表达对苜蓿抗性品种的抗病途径具有特殊作用。转录组分析是揭示植物抗病分子机制的主流方法,可以全面、系统地反映植物的抗病分子机制。张少平等[14]和姚运法等[15]通过转录组测序技术对黄秋葵的功能基因组学进行相关研究,但高抗南方根结线虫病种质资源在根结线虫侵染下的分子调控机制仍不清楚。本研究采用Illumina Hiseq 2500高通量测序技术,从分子层面研究和解析黄秋葵抗南方根结线虫病基因的表达变化,以期寻找黄秋葵抗病关键基因,为黄秋葵南方根结线虫病的防治和抗病品种选育奠定基础。
1 材料与方法
1.1 试验材料
供试虫源:南方根结线虫由海南省农业科学院植物保护研究所提供,并长期培养保存于易感黄秋葵上。
黄秋葵种质来自于福建省农业科学院亚热带农业研究所,为高抗南方根结线虫种质资源12C2[16]。
1.2 盆栽接种
黄秋葵种子经3% H2O2消毒3 min,流水冲洗数次,将种子催芽露白后播种于盆中,花盆规格为直径10 cm、高20 cm。基质采用消毒培养土。每盆播5粒种子,播种6盆,待黄秋葵幼苗长至三叶一心时,每盆选取长势一致的3株留作接种试验。接种前,挑取黄秋葵根上南方根结线虫卵块,于蒸馏水中孵化24~72 h,制备浓度为1 000 头·mL-1的2龄幼虫悬浮液。每盆接种2 mL悬浮液(约2 000头线虫),接种3盆,作为接种线虫处理组;3盆接种等量清水,作为对照组。
1.3 采样
分别取未接种和接种18 h后的黄秋葵根尖约1.5 cm,各3个重复(未接种的3次生物学重复分别记为T01、T02、T03;接种的3次生物学重复分别记为T04、T05、T06)。迅速放入液氮速冻,存于-80℃超低温冰箱备用。
1.4 转录组测序和分析
采用RNAprep Pure Plant Kit试剂盒(天根科技公司)提取黄秋葵根尖总RNA。分别采用Nanodrop、Qubit 2.0、Aglient 2100技术检测RNA样品的纯度、浓度和完整性,构建cDNA文库,再使用实时荧光定量PCR(quantitative real-time, PCR)方法对文库的有效浓度进行准确定量,以保证文库质量。库检合格后,用Illumina Hiseq TM2500(美国Illumina公司)进行高通量测序。运用生物信息学技术和方法对测序数据进行前期处理、序列比对、基因及基因组的注释、基因表达分析等。按照每千个碱基转录每百万映射读取的片段(fragment per kilobase of exon per million reads mapped, FPKM)法计算差异基因的表达量,若log2Fold change>0,则上调表达,反之,下调表达。
2 结果与分析
2.1 数据组装与分析
接种和未接种南方根结线虫的黄秋葵根尖经高通量测序和质量控制,共获得71.49 Gb有效数据(clean data),其Q30碱基百分比均达到94.0%以上(表1),表明测序结果可靠,可用于后续分析。对组装结果进行统计(表2),共产生53 556条单基因序列(unigene)和166 549条转录本序列(transcipt),N50分别为1 654 和1 682 bp,组装完整性较高;其中长度为300~500 bp的单基因序列数量最多,为20 844条,占38.92%,且随着长度的增加,单基因序列的数目减少。
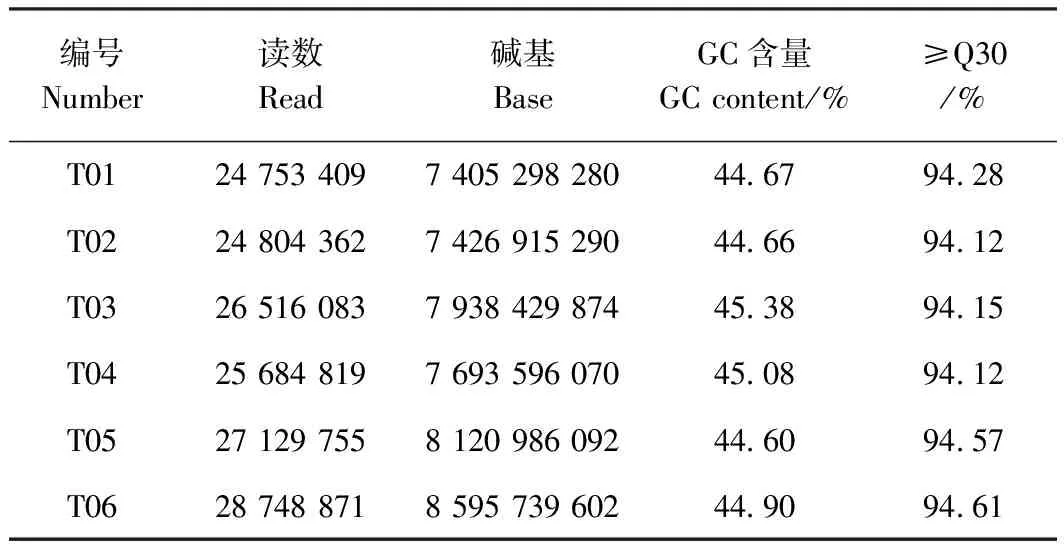
表1 有效数据评估统计Table 1 Statistics of clean data
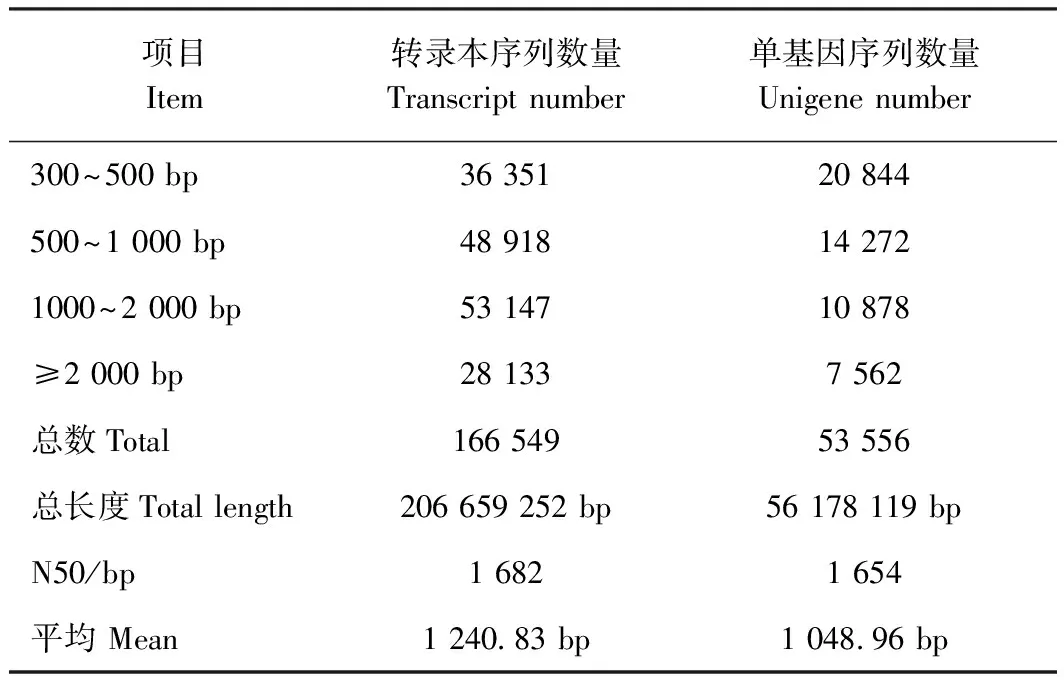
表2 组装结果统计Table 2 Statistics of assembled results
2.2 unigene功能注释
为获得unigene的功能注释信息,通过NR、Swiss-Prot、KEGG、COG、KOG、eggNOG、GO和Pfam等8个数据库进行注释分析(表3),在53 556条unigene中,共获得38 196条(71.32%)注释,以上8个数据库分别获得37 555 (70.12%)、25 627 (47.85%)、15 453
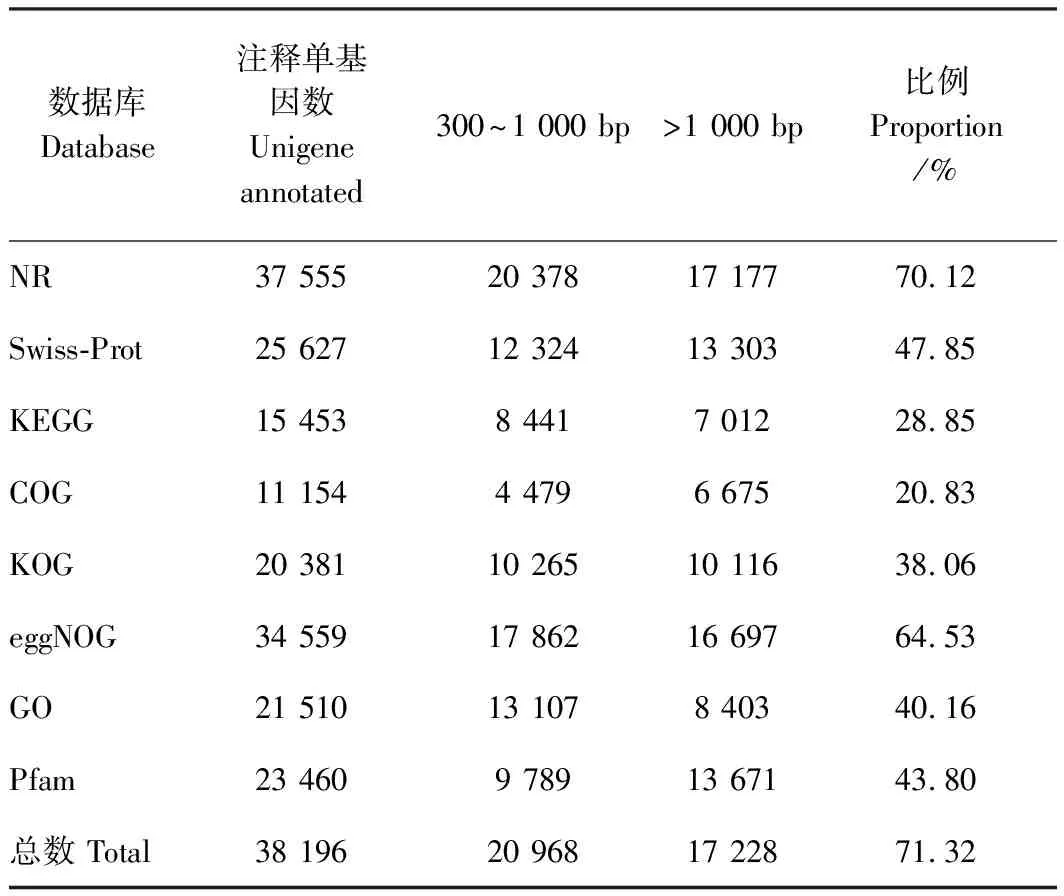
表3 单基因序列的功能注释Table 3 Function annotated of unigenes
(28.85%)、11 154 (20.83%)、20 381 (38.06%)、34 559(64.53%)、21 510(40.16%)和23 460条(43.80%)注释。
2.3 差异表达基因分析
抗病黄秋葵种质12C2未接种和接种18 h后根尖差异基因的表达分析,共获得2 318个差异表达基因(differential expression genes,DEGs),包括1 156个上调基因,1 162个下调基因,将其DEGs单基因序列分别在8个数据库中进行注释,共获得2 202条基因功能注释,COG、GO、KEGG、KOG、Pfam、Swiss-Prot、eggNOG和NR分别注释839、1 122、821、1 102、1 719、1 763、2 095和2 199条,其中以NR数据库注释比率最高,达99.86%。
2.3.1 DEGs的GO功能注释 抗病黄秋葵种质12C2未接种和接种18 h后根尖差异基因GO功能注释的1 122条DEGs,共分为三大类,分别为生物过程、细胞组分和分子功能,共划分为44个功能小类(表4),生物过程的DEGs以代谢过程(49.2%)、细胞过程(38.8%)和单一生物过程(33.9%)3个功能小类的数量最多;细胞组分的DEGs以内膜(40.2%)、内膜组分(34.2%)、细胞(33.2%)、细胞组分(32.7%)和细胞器(20.8%)5个功能小类的数量最多;分子功能的DEGs以催化活性(56.3%)和结合活性(43.9%)2个功能小类的数量最多。
2.3.2 DEGs的KOG功能注释 抗病黄秋葵种质12C2未接种和接种18 h后根尖差异基因KOG数据库注释的1 102条DEGs进行直系同源分类,并获得24个功能分类(图1),主要集中在R(一般性功能预测,17.8%)和O(翻译后修饰、蛋白质转换、伴侣,11.7%)。植物生长发育过程有大量基因表达,在南方根结线虫侵染下,部分涉及到了碳水化合物转运与代谢(9.3%),以及次生代谢产物的合成、转运和分解代谢(9.1%)、脂质转运与代谢(9.1%)、信号转导机制(8.5%)等过程,说明这些生物学过程对于黄秋葵生命活动具有重要作用。
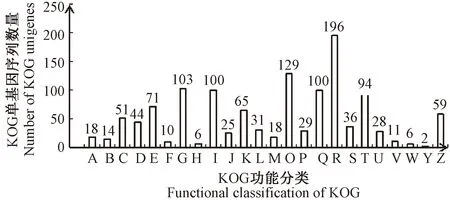
注:A:RNA的加工和修饰;B:染色体结构和动态变化;C:能源的产生和转化;D:细胞周期调控、细胞分裂和染色体分配;E:氨基酸转运与代谢;F:核苷酸转运与代谢;G:碳水化合物转运与代谢;H:辅酶转运与代谢;I:脂质转运与代谢;J:翻译、核糖体结构和生物合成;K:转录;L:复制、重组和修复;M:细胞壁/细胞膜的生物发生;O:翻译后修饰、蛋白质转换和伴侣;P:无机离子转运与代谢;Q:次生代谢产物的合成、转运和分解代谢;R:一般性功能预测;S:未知功能;T:信号转导机制;U:细胞内运输、分泌和囊泡运输;V:防御机制;W: 细胞外结构;Y:核结构;Z:细胞骨架。Note: A: RNA processing and modification. B: Chromatin structure and dynamics. C: Energy production and conversion. D: Cell cycle control, cell division, chromosome partitioning. E: Amino acid transport and metabolism. F: Nucleotide transport and metabolism. G: Carbohydrate transport and metabolism. H: Coenzyme transport and metabolism. I: Lipid transport and metabolism. J: Translation, ribosomal structure and biogenesis. K: Transcription. L: Replication, recombination and repair. M: Cell wall/membrane/envelope biogenesis. O: Posttranslational modification, protein turnover, chaperones. P: Inorganic ion transport and metabolism. Q: Secondary metabolites biosynthesis, transport and catabolism. R: General function prediction only. S: Function unknown. T: Signal transduction mechanisms. U: Intracellular trafficking, secretion, and vesicular transport. V: Defense mechanisms. W: Extracellular structures. Y: Nuclear structure. Z: Cytoskeleton.图1 差异表达基因KOG功能注释Fig.1 KOG annotation of DEGs
2.3.3 DEGs的KEGG功能注释 由表5可知,抗病黄秋葵种质12C2未接种和接种18 h后根尖差异基因分别富集在821条KEGG代谢通路,通路主要分为五类:第一类为细胞过程,涉及3个通路,分别为内吞作用、过氧化物酶体和吞噬体;第二类为环境信息处理,共有1个通路,为植物激素信号转导;第三类为遗传信息处理,涉及5个通路,以DNA复制最多;第四类为新陈代谢,共有40个通路,最多的为碳代谢(4.4%)、淀粉和蔗糖的代谢(4.4%),其次为氨基酸的生物合成(3.4%);第五类为有机系统,共有1个通路,为昼夜节律-植物。

表4 差异表达基因GO功能注释Table 4 GO annotation of DEGs

表5 差异表达基因KEGG功能注释Table 5 KEGG annotation of DEGs

表5(续)
2.4 差异基因分析
通过对抗病黄秋葵种质12C2未接种和接种18 h后根尖转录组测序结果进行功能注释、功能分类及代谢途径分析表明(表6),线虫侵染黄秋葵根部时,4个内切葡聚糖酶基因、4个聚半乳糖醛酸酶基因、5个葡聚糖内-1,3-β葡糖苷酶基因、4个果胶裂解酶基因下调表达,主要参与细胞壁组成成分纤维素和果胶质的生物代谢过程;生长素响应蛋白基因、生长素流入运输载体基因下调表达,茉莉酸合成酶基因上调表达,其主要参与植物激素调控;3个WRKY转录因子基因、2个MYB转录因子基因上调表达,其主要参与相关基因表达调控;2个膜联蛋白基因上调表达,6个植物细胞周期蛋白基因下调表达,其主要参与植物细胞相关基因的表达。
3 讨论
运用转录组测序技术研究南方根结线虫与黄秋葵的互作,挖掘抗病基因的研究尚鲜见报道。转录组主要指所有编码蛋白质的mRNA总和[17],能够从整体水平探索基因的结构和功能。黄秋葵为非模式植物,需要通过与同源物种的测序信息进行比对分析,研究各种特定的生物学过程和分子机理。本研究利用Illumina HiSeq TM2500高通量测序技术构建了黄秋葵在南方根结线虫侵染下的根尖转录组数据库,借助其他物种已有数据库信息,对差异表达基因进行比对分析,表明线虫侵染后黄秋葵高抗种质12C2根尖的植物防御反应、植物激素代谢、转录因子及其他相关功能蛋白基因的表达发生了改变。
植物细胞壁由纤维素、亚纤维素和果胶质组成,它作为第一道防线阻止线虫入侵[18]。线虫能够分泌细胞修饰酶类侵染植物根部,诱导植物细胞壁中的修饰蛋白基因表达[19]。在本研究中,内切葡聚糖酶基因家族、聚半乳糖醛酸酶基因家族和葡聚糖内-1,3-β葡糖苷酶基因家族在抗病种质12C2中下调表达,抑制细胞壁降解,这可能是黄秋葵对南方根结线虫侵染的一种防御反应。
植物激素几乎参与了所有的生命活动,其对线虫侵染的响应也不例外。植物体中的激素没有明显的专一性,一种激素可以调节多种生理过程,而多种激素又具有调节同一生理过程的作用[20]。在植物激素信号转导途径中,生长素和茉莉酸主要调控植物生长发育以应对线虫入侵。在本研究中,生长素响应蛋白基因、生长素流入运输载体基因下调表达,导致细胞中生长素含量下降,生长素无法大量积累可能导致根部巨型细胞的大量形成受阻,这与前人研究黄瓜[21]和烟草[22]对南方根结线虫抗性的结论一致。茉莉酸作为一种信号物质,其过量表达可以提高番茄对南方根结线虫的防御[23],说明茉莉酸合成酶上调表达,有利于黄秋葵抗南方根结线虫。
在植物根部受根结线虫侵染后形成根结的过程中,转录因子对相关基因表达调控起关键性作用[24-26]。郑井元[27]研究发现,辣椒受到南方根结线虫侵染后会引起WRKY转录因子的强烈表达。魏潇[28]研究表明,红根甘肃桃通过MYB调控增加南方根结线虫抗性。本研究通过转录组测序发现,黄秋葵高抗种质12C2受南方根结线虫侵染后,WRKY、MYB转录因子基因家族上调表达,有利于增强南方根结线虫抗性,与前人研究结果一致。

表6 南方根结线虫侵染下黄秋葵部分差异基因的表达Table 6 Some DEGs of okra under M. incognita infect
膜联蛋白是一种位于质膜上的钙磷脂结合蛋白,在植物应对不良环境时具有重要作用[29]。当植物受到逆境胁迫时,膜联蛋白生物活性被激活,特异地提高细胞内Ca2+浓度,提高植物抗逆性[30]。在本研究中,膜联蛋白基因家族上调表达,增加了黄秋葵种质12C2对南方根结线虫的抗性。在植物与线虫亲和反应中,细胞周期蛋白基因在线虫侵染后被激活[31],本研究中植物细胞周期蛋白基因家族下调表达,能够抑制根部巨型细胞的形成。
4 结论
在南方根结线虫侵染下,抗病黄秋葵种质12C2在一系列关键基因家族(内切葡聚糖酶基因家族、聚半乳糖醛酸酶基因家族、葡聚糖内-1,3-β葡糖苷酶基因家族、果胶裂解酶基因家族、生长素响应蛋白基因、生长素流入运输载体基因、茉莉酸合成酶基因、WRKY、MYB转录因子基因家族、膜联蛋白基因和植物细胞周期蛋白基因家族)共同作用下进行自我防御,能够抵御南方根结线虫的侵染。本研究从分子水平分析了抗病基因及其差异表达,为筛选黄秋葵抗南方根结线虫关键基因和功能验证提供了重要的基础,同时对黄秋葵南方根结线虫病防治及抗病品种选育具有重要意义。
