茶树CsDREB-A2转录因子基因的克隆与非生物胁迫响应分析
2020-12-02韩妙华滕瑞敏林士佳
韩妙华 滕瑞敏 李 辉 刘 昊 林士佳 庄 静
(南京农业大学园艺学院/茶叶科学研究所,江苏 南京 210095)
茶树[Camelliasinensis(L.) O. Kuntze]作为一种重要的经济作物,在我国已有几千年的栽培历史。我国茶区分布较广,地形复杂,且茶树具有喜湿耐荫、喜温惧寒的特性,在引种和栽培过程中,盐碱、高温、干旱、强光等各种非生物胁迫严重影响茶树的生长发育,降低茶叶的产量和品质[1]。非生物胁迫下,转录因子胁迫相关蛋白合成,在植物逆境信号转导中起关键作用[2]。
转录因子是一种能够与DNA启动子区域相互作用的蛋白质,抑制或激活其他基因转录表达[3]。干旱应答元件结合蛋白(DRE-binding protein,DREB)属于APETALA2/ethylene responsive foutor(AP2/ERF)转录因子家族,主要参与植物多种生理生化反应的信号转导,如对逆境(低温、干旱、盐渍)、激素、病害等的应答[4]。DREB转录因子存在1个保守的DNA结合域AP2,能够与脱水响应元件(dehyaration responsive element,DRE)或CRT(C-repeat)等顺式作用元件结合,部分成员能特异性地结合其基因上游GCC-box元件或耦合元件(coupling element, CE1),从而促进或抑制低温、高盐、干旱等相关基因表达。DRE核心序列元件TACCGACAT调节脱落酸(abscisic acid, ABA)独立途径,可以不依赖ABA在逆境胁迫下完成抗性调节[2]。DREB蛋白碱性核定位信号区位于N端,酸性转录激活区位于C端,中间是AP2结构域,由57~70个氨基酸残基组成,含有RAYD和YRG保守序列块。RAYD元件存在一个由18个氨基酸残基组成的高度保守的核心序列,形成1个双亲性α-螺旋结构,可能参与AP2/ERF转录因子与其他转录因子或DNA的相互作用;YRG元件具有保守的YRG氨基酸基序。AP2结构域第2个β-折叠中第14和第19位氨基酸残基存在差异,决定了AP2/ERF转录因子能够与不同顺式作用元件特异性结合。
植物中DREB转录因子最早在拟南芥中分离得到[5]。Liu等[6]从拟南芥的cDNA文库中克隆了5个与DRE元件结合的转录因子(DREB1A、DREB1B、DREB1C、DREB2A以及DREB2B)。随后,在水稻[7]、棉花[8]、胡萝卜[9]、大白菜[10]、巴哈雀稗[11]等物种中均克隆得到DREB基因。在拟南芥中,DREB亚族被分为6个亚组(A1~A6),DREB1/CBF和DREB2蛋白分别归入A1和A2亚组[12]。DREB-A1亚组基因响应低温诱导;DREB-A2亚组与植物在高盐、干旱下的逆境耐受性有关,其他4个亚组基因响应其他非生物胁迫诱导。已有研究证明,水稻、拟南芥、烟草DREB基因过表达可能使种子在发芽期间降低对高盐的敏感性,并促进根的早期生长[13]。过表达菊花DmDREBa和DmDREBb能够提高转基因烟草耐寒性,DmDREBb还可加强转基因植物在高盐下的耐受性[14]。齿肋赤藓ScDREB10过表达显著提高拟南芥种子在渗透和盐胁迫下的发芽率,提高了活性氧的清除能力[15]。
目前,茶树中DREB转录因子的调控网络和作用机理尚不清楚,因此,研究茶树CsDREB-A2基因在非生物胁迫下的表达情况,对于进一步了解CsDREB转录因子的功能具有重要的作用。本研究以茶树龙井43为材料,克隆得到1个编码CsDREB-A2转录因子的基因,对该基因编码的氨基酸序列进行了序列比对、亚细胞定位、理化性质、亲水性和疏水性等方面的分析,并研究了其进化树、二级和三级结构。通过实时荧光定量PCR技术研究了茶树CsDREB-A2基因在低温、高温、干旱和高盐胁迫下的响应情况,旨在为进一步研究茶树CsDREB基因对逆境胁迫的响应机理提供一定的参考。
1 材料与方法
1.1 试验材料及处理
供试材料龙井43(Camelliasinensiscv. Longjing 43)二年生茶树扦插幼苗,种植于南京农业大学茶叶科学研究所。摘取龙井43无病虫害植株的幼嫩叶片为试验材料。
选取长势良好的龙井43盆栽幼苗,分别进行高温(38℃)、低温(4℃)、高盐(200 mmol·L-1NaCl)和干旱[200 g·L-1聚乙二醇(polyethy lene glyco, PEG)]胁迫处理,处理时间分别为2、4、8和24 h,以未处理的植株作为对照(CK),在各时间段采集不同处理的茶树叶片。取样时,每处理从50株龙井43茶树群体中随机选取5株健康植株,每株摘取一芽二叶初展叶片,全部进行混样。每个处理设置3个生物学重复。
1.2 试验方法
1.2.1 总RNA提取和cDNA合成 茶树叶片总RNA提取方法参照北京华越洋生物科技有限公司Quick RNA Isolation Kit试剂盒说明书。RNA样品浓度采NanoDrop ND 1000微量紫外检测仪(上海谱元仪器有限公司)测定,采用1.2%琼脂糖凝胶电泳检测RNA质量[16-17]。按照大连TaKaRa公司Prime Script RT Reagent Kit试剂盒说明书将总RNA反转录成cDNA模板。
1.2.2CsDREB-A2基因的克隆 基于南京农业大学茶树逆境生理课题组转录组数据[18],设计1对特异引物,上游引物CsDREB-A2-QF序列为5′-ATGATAGCTCAGAACATTGA-3′,下游引物CsDREB-A2-QR序列为5′-TTAAAGACCCAAATCTGAGTA-3′。PCR扩增体系为20 μL,包含7 μL ddH2O、10 μL 2×TaqPlus Master Mix酶、1 μL cDNA模板、上下游引物各1 μL。PCR扩增程序:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min[19]。用1.2%琼脂糖凝胶电泳分离PCR产物,参照杭州维特洁生化技术公司DNA回收试剂盒说明书将其回收,与pMD 19-T载体连接,转化至大肠杆菌DH 5α中。挑取阳性克隆菌液送至南京金斯瑞公司测序。
1.2.3 生物信息学分析 在NCBI网站(http://www.ncbi.nlm.nih.gov)预测序列保守域,并用BLAST进行序列同源性比较[20]。利用DNAMAN 8.0软件进行氨基酸序列多重比对和亲/疏水性分析。登陆SMS(http://www.bio-soft.net/sms)和ExPASy-ProtParam(http://web.expasy.org/protparam)分析氨基酸序列组成及理化性质[21]。利用FoldIndex网站(https://fold.weizmann.ac.il/fldbin/findex)分析氨基酸折叠无序化特性。蛋白亚细胞定位采用LocTree3(https://rostlab.org/services/loctree3)和SoftBerry ProtComp 9.0(http://linux1.softberry.com/berry.phtml)预测。拟南芥AP2/ERF转录因子家族蛋白全长序列登陆Tair(https://www.arabidopsis.org)下载,并利用MEGA 7.0软件构建系统进化树。采用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点。跨膜结构和信号肽分别利用TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html)和SignalP4.1 (http://www.cbs.dtu.dk/services/SignalP-4.1)进行预测。蛋白质二级结构预测采用SOPMA在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行。登陆Swiss-Model(http://www.Swissmodel.expasy.org)预测蛋白质三级结构[19],并利用PyMOL软件生成三级结构模型。
1.2.4 茶树CsDREB-A2基因的表达特性分析 提取非生物胁迫处理样品的RNA,反转录成cDNA,用于实时荧光定量PCR。按照大连TaKaRa公司SYBR PremixExTaqKit试剂盒说明书以及CFX96TMreal-time PCR system平台完成荧光定量,分析CsDREB-A2基因在高温、低温、干旱、高盐处理下茶树中的表达情况。茶树GAPDH基因作为内参基因[22]。检测目标基因表达的引物为CsDREB-A2-qrtF(5′-TTAAAGACCCAAATCTGAGTA-3′)和CsDREB-A2-qrtR(5′-TTAAAGACCCAAATCTGAGTA-3′)。内参基因的引物为CsGAPDH-JF(5′-TTGGCATCGTTGAGGGTCT-3′)和CsGAPDH-JR(5′-CAGTGGGAACACGGAAAGC-3′),采用2-ΔΔCT法[23]分析结果。采用IBM SPSS Statistic 25和Micosoft Office Excel 2010进行数据分析并制作图表。
2 结果与分析
2.1 茶树CsDREB-A2基因的克隆
以茶树叶片cDNA为模板,通过引物CsDREB-A2-QF和CsDREB-A2-QR进行PCR扩增,得到1 000 bp左右的扩增片段。对扩增产物进行序列测定与分析,结果显示,茶树CsDREB-A2基因开放阅读框为1 056 bp,共编码351个氨基酸(图1),GenBank登录号为MN082027。

图1 茶树CsDREB-A2基因核苷酸序列与推测的氨基酸序列Fig.1 The nucleotide acid and deduced amino acid sequence of CsDREB-A2 gene in C. sinensis
2.2 茶树CsDREB-A2转录因子进化树分析
茶树CsDREB-A2转录因子与拟南芥AP2/ERF家族成员进化分析结果显示,茶树CsDREB-A2属于DREB亚族的A2组(图2-A)。将其氨基酸序列进行BLAST比对发现,CsDREB-A2 转录因子与猕猴桃(Actinidiachinensis)、葡萄(Vitisvinifera)等物种有较近的亲缘关系,与梅花(Prunusmume)、甜樱桃(Prunusavium)等物种亲缘关系较远(图2-B)。

图2 茶树CsDREB-A2转录因子进化树(A)及与部分物种氨基酸序列进化分析(B)Fig.2 Phylogenetic tree of CsDREB-A2 from C. sinensis (A) and phylogenetic analysis of amino acid sequences with some species (B)
2.3 茶树CsDREB-A2转录因子与其他植物相关氨基酸序列比对
茶树CsDREB-A2转录因子保守域预测结果显示(图3-A),AP2保守结构域位于该转录因子第9~第154氨基酸位点之间,N端含有典型的保守YRG元件和WLG基序,其中AP2保守结构域第14、第19位氨基酸分别为缬氨酸(V)和谷氨酸(E)。第254~第263氨基酸位点之间存在1个LM无序化区域(FDxxELLxxL)。将茶树CsDREB-A2 氨基酸序列与其他物种DREB类转录因子氨基酸序列进行BLAST比对,结果显示,茶树与川桑(Morusnotabilis)、木豆(Cajanuscajan)、马铃薯(Solanumtuberosum)等物种的DREB类转录因子相似性为52.56%(图3-B)。

图3 茶树CsDREB-A2转录因子保守域(A)与其他物种氨基酸序列的多重比对(B)Fig.3 Conserved domains of CsDREB-A2 transcription factor (A) and multiple alignment of relative amino acid sequences in C. sinensis and other species (B)
2.4 茶树CsDREB-A2转录因子氨基酸组成及理化性质分析
由表1可知,DREB类转录因子蛋白相对分子量在33.78~44.25 kDa之间,蛋白残基数为304~402,理论等电点为4.63~5.32。不同植物中各氨基酸种类所占比例不同,其中酸性氨基酸所占比例普遍高于碱性氨基酸,脂肪族氨基酸高于芳香族氨基酸;蛋白质总平均疏水性为-0.77左右,表现出较强的亲水性。利用NetPhos 3.1对CsDREB-A2蛋白磷酸化位点进行预测,结果表明,该多肽链0.5以上分值的氨基酸位点为47个,其中包含29个丝氨酸(S)、12个苏氨酸(T)和6个酪氨酸(Y)磷酸化位点。
2.5 茶树CsDREB-A2蛋白亚细胞定位预测
CsDREB-A2蛋白亚细胞定位预测结果显示,CsDREB-A2蛋白主要定位于细胞核(表2)。在线预测网站LocTree3对该蛋白的亚细胞定位预测分析结果与SoftBerry ProtComp 9.0一致,由此推断,茶树CsDREB-A2蛋白主要在细胞核中发挥生物学作用。
2.6 茶树CsDREB-A2蛋白氨基酸亲、疏水性和无序化分析
CsDREB-A2蛋白氨基酸序列的亲水性和疏水性分析结果显示,该转录因子疏水性最强的位点是第351位亮氨酸(Leu),其次是第261位甘氨酸(Gly);亲水性最强的是第34位精氨酸(Arg),其次第33位赖氨酸(Lys)、第35~第37位赖氨酸、丝氨酸(Ser)、精氨酸;大部分氨基酸属于亲水性氨基酸(图4)。利用FoldIndex对CsDREB-A2转录因子进行氨基酸序列折叠无序化分析,结果表明,该转录因子存在5个氨基酸无序化区域,共包含258个氨基酸,无序化比例为73.50%,无序化特征明显(图5)。
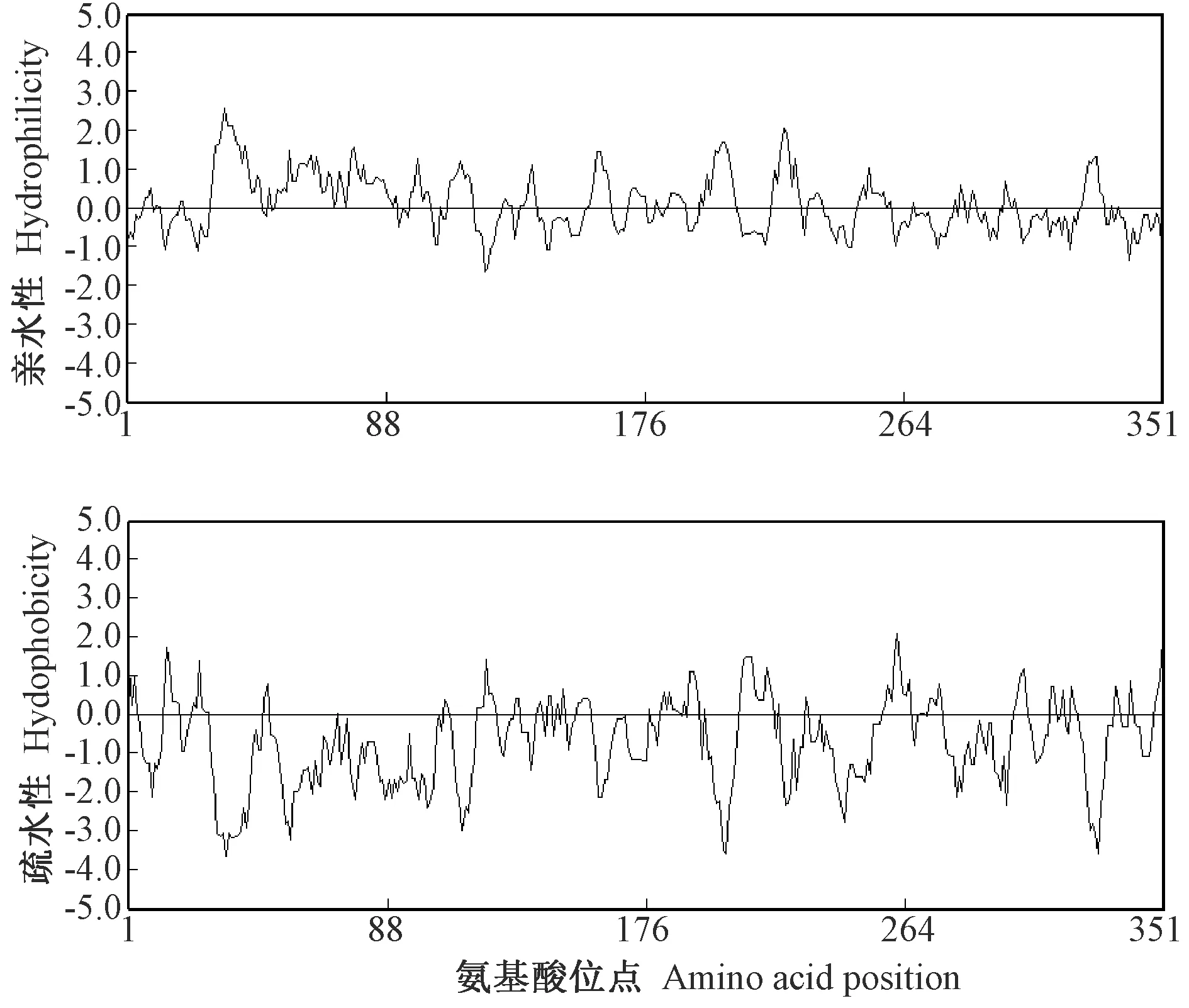
图4 茶树CsDREB-A2氨基酸序列疏水性和亲水性分析Fig.4 Hydrophobicity and hydrophilicity of amino acid sequence of CsDREB-A2 in C. sinensis

表1 不同植物中DREB氨基酸组成成分及理化性质分析Table 1 Analysis of composition and physicochemical properties of DREB amino acids in different plants
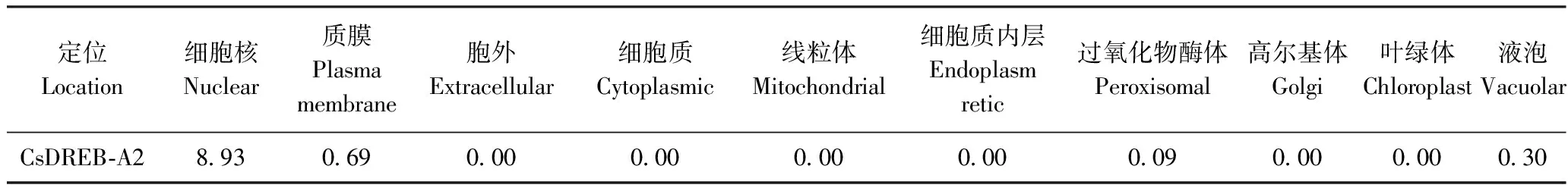
表2 CsDREB-A2转录因子亚细胞定位预测Table 2 The prediction of subcellular localization of CsDREB-A2 transcription factor

注:正值表示蛋白的有序状态,负值表示蛋白的无序状态;下划线标注为有序状态氨基酸,无下划线标注为无序状态氨基酸。Note:The positive value indicates the ordered state of the protein,while the negative value indicates the disordered state of the protein.The underline indicates the ordered state of the amino acid,and the ununderlined indicates the disordered state of the amino acid.图5 茶树CsDREB-A2转录因子折叠状态的分析Fig.5 Analysis of folding state of CsDREB-A2 transcription factor in C. sinensis
2.7 茶树CsDREB-A2转录因子信号肽、跨膜结构预测与分析
经信号肽预测分析可知(图6),CsDREB-A2转录因子mean S-score的值小于0.5,表明CsDREB-A2蛋白不存在信号肽序列,可能不属于分泌蛋白。利用Tmpred在线网站进行跨膜结构预测,结果显示,CsDREB-A2蛋白在269~285氨基酸位点之间存在1处由内至外螺旋,分值为88,远低于500,不存在由外至内螺旋,由此推测CsDREB-A2转录因子属于非跨膜蛋白,没有跨膜区域。
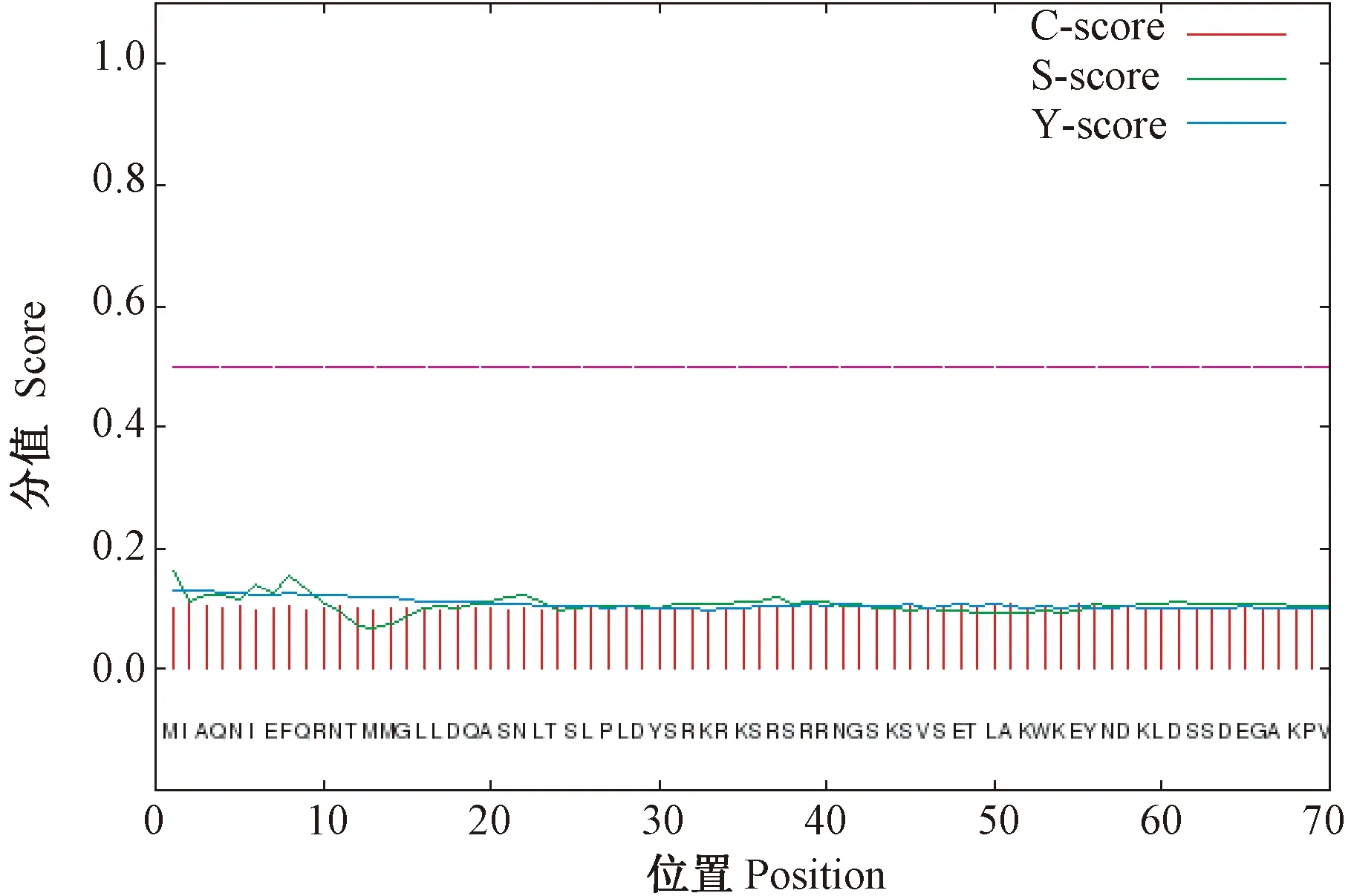
注:C-score:原始切割位点分值;S-score:信号肽分值;Y-score:综合切割位点分值。Note:C-score:Raw cleavage site score. S-score:signal peptide score.Y-score:Combined cleavage site score.图6 茶树CsDREB-A2转录因子信号肽预测Fig.6 Signaling peptide prediction of CsDREB-A2 transcription factor in C. sinensis
2.8 茶树CsDREB-A2蛋白推导的二级和三级结构预测与分析
由图7可知,该转录因子的组成为30.77% α-螺旋、3.99% β-折叠、8.83%延伸主链及56.42%随机卷曲。因此,CsDREB-A2主要由α-螺旋和随机卷曲组成,β-折叠散布于蛋白序列中。
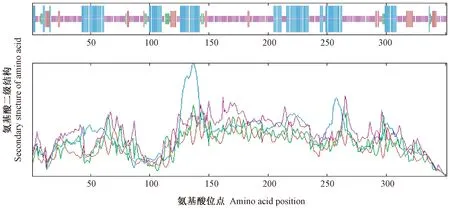
注:蓝色:α-螺旋;红色:β-折叠;绿色:β-转角;粉色:随机卷曲。Note:Blue:Alpha helix. Red:Extended strand. Green:Beta turn. Pink:Random coil.图7 茶树CsDREB-A2转录因子二级结构预测Fig.7 Prediction of secondary structure of CsDREB-A2 transcription factor in C. sinensis
采用Swiss-Model对CsDREB-A2 转录因子进行三级结构建模分析,结果表明,其AP2结构域含有1个α-螺旋和3个β-折叠,且该结构域第14位的缬氨酸和第19位的谷氨酸位于第2个β-折叠中,WLG基序存在于第3个β-折叠(图8)。该转录因子三级结构以随机卷曲和α-螺旋为主,推测结果与二级结构相吻合。
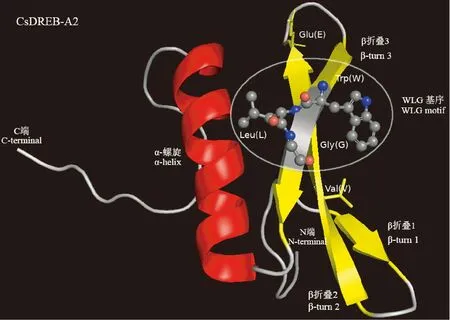
图8 茶树CsDREB-A2的三级结构预测Fig.8 The three-dimension structures of CsDREB-A2 in C. sinensis
2.9 茶树CsDREB-A2基因在非生物胁迫下的表达情况
茶树CsDREB-A2基因在4种胁迫下均能诱导表达,但是不同胁迫及不同处理时间下CsDREB-A2基因表达存在差异。在低温胁迫下,CsDREB-A2基因的相对表达量呈先降低后上升随后又降低的趋势,在处理8 h时其相对表达量达到最大值,为CK的5.61倍,处理4、24 h时CsDREB-A2基因的相对表达量也明显高于CK,分别为CK的1.74和4.39倍(图9-A)。高温和干旱胁迫下,CsDREB-A2基因相对表达量较CK表现出明显的上调,分别在处理4 h和2 h时达到最大值,为CK的20.70倍和42.90倍(图9-B、C),其中高温处理2、8、24 h时CsDREB-A2基因的相对表达量分别为CK的18.23、12.65、13.12倍;干旱处理8、24 h时CsDREB-A2基因的相对表达量显著高于CK,分别为CK的24.05、39.98倍。高盐胁迫下茶树CsDREB-A2基因的相对表达量在处理2、4、8 h表现出下调趋势,处理2 h时其相对表达量最低,在处理24 h时其相对表达量显著高于CK,为CK的2.05倍(图9-D)。上述结果表明,茶树CsDREB-A2基因参与高温、低温、高盐、干旱等非生物胁迫应答过程,对不同处理的响应模式存在差异。
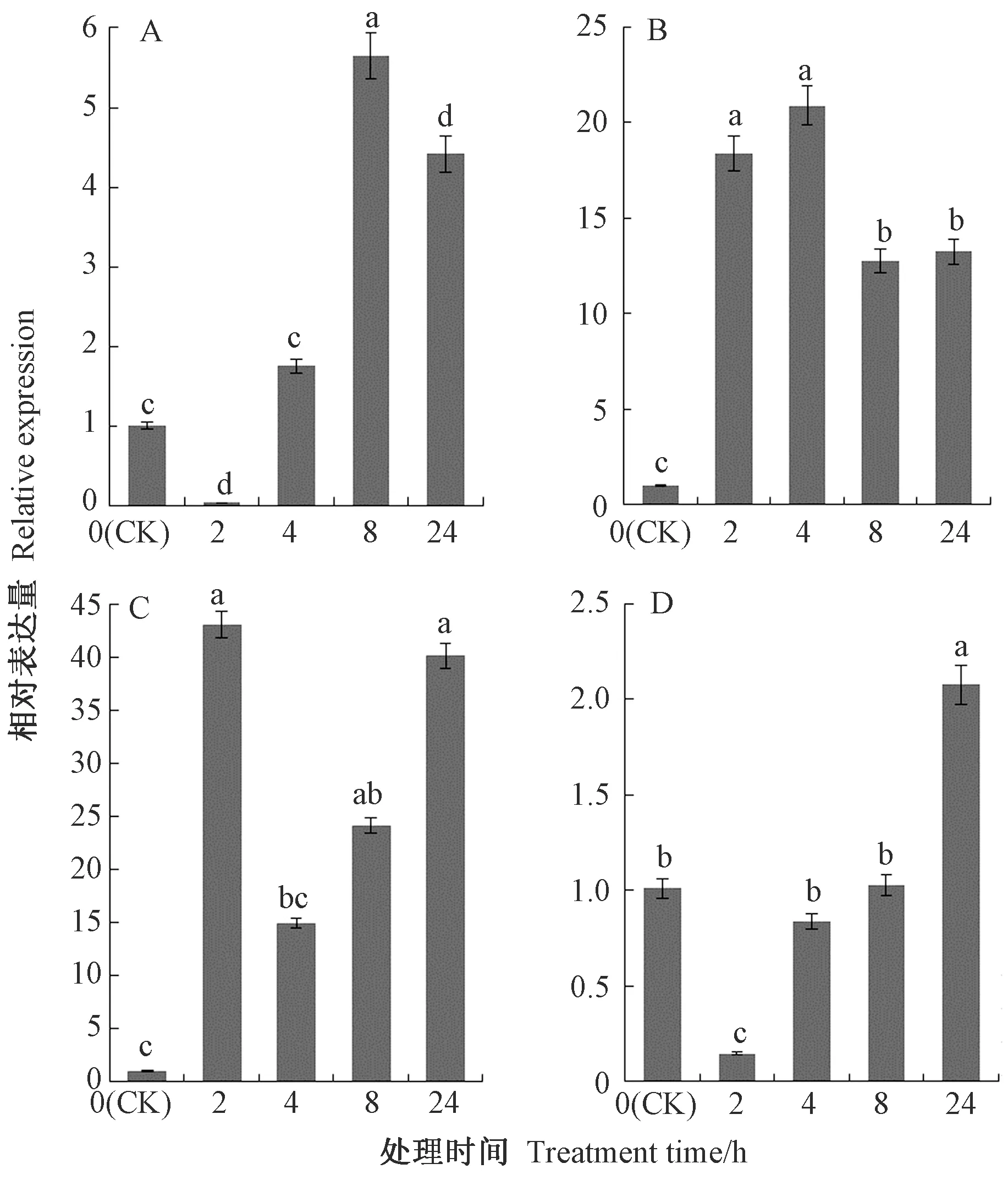
注:A:低温;B:高温;C:干旱; D:高盐。不同小写字母表示在0.05水平上差异显著。Note:A:Low temperature. B:High temperature. C:Drought. D:High salinity.Different lowercase letters indicate significate differences at 0.05 level.图9 不同胁迫下茶树CsDREB-A2基因在叶片中的相对表达量Fig.9 Relative expression of CsDREB-A2 gene in leaves of C. sinensis under different stress treatments
3 讨论
本研究对比了茶树CsDREB-A2基因在低温(4℃)、高温(38℃)、干旱(200 g·L-1PEG)和高盐(200 mmol·L-1NaCl)胁迫下的表达特性,结果显示,高温和干旱胁迫均能快速诱导CsDREB-A2基因表达。推测该转录因子参与茶树在高温、干旱胁迫下的应答过程。已有研究发现,拟南芥叶片AtDREB2A不响应低温胁迫,但受高温胁迫诱导表达[24]。大豆GmDREB2A基因在高温、干旱胁迫下显著上调[25]。在热激反应中,热激引发拟南芥[26]和水稻[27]热激转录因子(heat shock transcription factor A1,HsfA1)激活,诱导DREB2A和HsfA2基因的转录;从而使得DREB2A与其靶基因HsfA3的启动子结合,激活HsfA3基因,进一步诱导下游热激蛋白编码基因的表达[28]。以上结果进一步推测,CsDREB-A2可能参与高温胁迫下茶树转录水平的热激级联反应,进而调控茶树应答高温和干旱胁迫。
拟南芥DREB2A蛋白中心区域包含一个负调控结构域(NRD),影响DREB2A转录因子的结合和激活功能[29]。拟南芥AtDREB2A、大豆GsDREB2和向日葵HaDREB2A基因中的NRD结构域都含有一段调控蛋白质降解的PEST四肽序列(脯氨酸-谷氨酸-丝氨酸-苏氨酸)[30]。才华等[29]研究表明,野生大豆GsDREB2基因的负调控结构域抑制GsDREB2的转录激活功能,导致GsDREB2不能与DRE元件特异性结合。人工突变野生大豆GsDREB2基因的负调控结构域可获得GsDREB2-mNRD基因,超量表达该基因的拟南芥显著提高对盐胁迫和渗透胁迫的耐受性[29]。本研究茶树CsDREB-A2转录因子AP2结构域和转录激活区存在丝氨酸(Ser)富集区域,推测CsDREB-A2基因可能存在NRD结构域,降低该基因对盐胁迫的调节功能,使得CsDREB-A2基因在高盐胁迫下表现出下调趋势。ABA激活许多干旱胁迫基因的表达,这些基因启动子区包含保守的ABA顺式反应元件ABRE[31]。植物中,DREB类转录因子基因启动子区域通常含有ABRE元件[30-31]。但茶树CsDREB-A2转录因子对非生物胁迫响应过程中ABA的作用机制尚需要进一步深入研究。
本研究中,茶树CsDREB-A2氨基酸序列折叠无序化分析显示,该转录因子无序化比例为73.50%,N-末端和C-末端固有无序化程度较高,这与Kragelund等[32]的研究一致。固有无序蛋白(intrinsic disordered proteins,IDPs)在天然状态下不存在稳定的三维结构,但在行使生物学功能上具有重要作用。正常生长条件下,DREB2A基因表达不会激活下游基因,DREB2A需要翻译后修饰才能被激活,但是其激活机制尚不明确。无序结构使IDPs比较灵活,含有丰富的结合位点,可对翻译后修饰,如甲基化、磷酸化、乙酰化等进行调控,同时在细胞生物信号多样性功能方面起作用[33]。DREB2A转录因子中的LM区域可能介导该转录因子与自由基诱导细胞死亡蛋白1(radical induced cell death protein 1,RCD1)之间的相互作用[33]。N-末端部分无序区域与DREB2A相互作用蛋白1(DREB2A-interacting protein1,DRIP1)和DRIP2在细胞核发生互作,负调节干旱胁迫应答反应[32]。因此,这些固有无序蛋白主要参与分子识别、调控以及信号转导等功能。但由于无序结构在茶树中的互作方式较为复杂,其具体反应过程有待进一步研究。
4 结论
本研究克隆得到的茶树CsDREB基因属于AP2/ERF家族转录因子中DREB亚族的A2组,与川桑、木豆、马铃薯等物种的DREB基因具有较高的同源性。CsDREB蛋白含有一个由60个氨基酸残基组成的高度保守的结构域AP2,YRG元件和WLG基序存在于该结构域中,具有AP2/ERF家族转录因子的典型特征。该结构域第14和第19位氨基酸分别为缬氨酸和谷氨酸,起到与DRE/CRT作用元件结合的重要作用。本研究证实高温和干旱胁迫可诱导茶树CsDREB-A2基因表达,表明DREB类转录因子在茶树非生物胁迫过程中具有重要的调节作用。本试验结果为DREB类转录因子在茶树抗逆胁迫的分子调控机制研究奠定了一定的理论基础。
