光和温度对采后油茶果油脂转化的影响
2020-12-01吴建文黄湘颖黎贵卿关继华李秋庭陆顺忠
吴建文,黄湘颖,黎贵卿,关继华,李秋庭,陆顺忠*
1. 广西壮族自治区林业科学研究院(南宁 530002);2. 广西大学轻工与食品工程学院(南宁 530004)
油茶(Camellia oleiferaAbel.)属山茶科山茶属常绿小乔木或灌木,是我国特有的木本油料树种,主要分布在中国长江流域及以南地区,此外,在东南亚及日本等部分国家和地区也有少量分布。油茶在中国的种植历史悠久,具有不与粮食争地等优势,大力发展油茶产业是提高中国食用植物油自给率的重要举措。良种的选育是油茶产业发展的重要引擎,诸多学者对油茶果生长发育过程中油脂的积累变化规律进行研究,以期实现油茶良种的科学选育、栽培的科学管理及不同油茶品种最佳时间的科学采摘[1-2]。
在油茶果油的制取工艺[3-4]、深加工利用[5-6](如化妆品、医用品、医药外用品等)等方面已开展大量研究,但不同因素对采后油茶果油脂转化的影响的相关研究甚少,油茶果精深加工的前处理研究是完善整个油茶产业非常重要的一环。果实在成熟过程中,绿色器官产生的同化物质和果皮中的贮藏物质都能够向种子转移[7]。采后的油茶果仍然具有生命活力,绿色果皮在光照条件下还能进行短期的光合作用。脂类的合成和积累需要光合作用合成的糖类通过不同途径提供碳架和能量,同时这个复杂的生理变化过程还需多种酶的参与,如乙酰辅酶A羧化酶、磷脂酸磷酸酯酶等,各种酶的活性还与油茶果所处环境的温度密切相关。
因此,从应用研究的角度就光照和温度2个因素对采后油茶果可溶性糖、蛋白质及油脂变化进行探讨,在油茶产业链中提升油茶果含油率的最后一个环节,跑好“最后一公里”,做好油茶种植与加工的无缝连接,以期进一步提升油茶产业的经济价值。
1 材料与方法
1.1 材料与试剂
普通油茶果(广西凤山春天有机农业有限公司、环江伍香源食品有限公司);标准葡萄糖溶液(10 mg/mL)、蒽酮、石油醚、硫酸铜、硫酸钾、硫酸、硼酸、甲基红、溴甲酚绿(均为分析纯,南宁蓝天实验设备有限公司)。
1.2 仪器与设备
美国NUAIR-DS54SDE光照培养箱(上海旦鼎国际贸易有限公司);UV-2700可见分光光度计(岛津公司);KjeDigester K-449凯式消解仪(BÜCHI Labortechnik AG);KjelMaster K-375全自动凯氏定氮仪(BÜCHI Labortechnik AG)。
1.3 方法
1.3.1 单因素试验样品处理
供试材料为广西凤山县普通油茶品种,选取长势较为接近阳坡地块,于2018年11月1日从东南西北中5个方位随机采摘180 kg,随机分成6等分,每份油茶果30 kg。将其中的4份油茶果分别放置在25,30,35和40 ℃培养箱中进行无光处理,另外在同等条件下增设1份30 ℃光照(可见光)试验,均放置7 d,每天取样测粗脂肪、可溶性糖及蛋白质的含量,测样前均在80℃烘箱中烘至水分约10%。最后1份用于烘干温度单因素试验,温度梯度分别为50,60,70和80 ℃,烘至水分约10%后测其粗脂肪含量。
1.3.2 正交试验样品处理
由于单因素样品供应地原料被采收完毕,所以正交试验及与之对比的自然晾晒和阴干试验所需样品另择他地。供试材料为环江伍香源食品有限公司普通油茶品种,选取长势较为接近阳坡地块,于2018年11月20日从东南西北中5个方位随机采摘120 kg,随机分成4等分,每份油茶果30 kg。采后立即取2份分别用于自然晒干和阴干的对照试验,阴干处理方式为室内平铺堆放至水分约10%,晒干处理为平铺于室外自然晒干至水分约10%。最后2份分别用于光照和无光照处理的三因素三水平正交试验。
1.3.3 粗脂肪的测定
用粉碎机将油茶果快速地磨碎成均匀的细颗粒,弃去最先粉碎的约1/20的样品后,用6 mm条形筛处理,混匀后在30 min内测定。称取10 g粉碎后的试样,精确至0.001 g。采用索式抽提法测定油脂含量,试剂为石油醚,每个样品均重复测定3次。
1.3.4 可溶性糖的测定
称取0.15 g样本,精确至0.01 g,加入1 mL蒸馏水研磨成匀浆,倒入有盖离心管中,沸水浴10 min,冷却后,以8 000×g常温离心10 min,取上清液于10 mL试管中,用蒸馏水定容至10 mL。取200 μL样品加入100 μ L蒽酮试剂、200 μ L蒸馏水及1 000 μL浓硫酸,沸水浴10 min,冷却至室温后,于620 nm处测定OD值,根据葡萄糖标准曲线计算可溶性糖含量,标准曲线的浓度梯度为0.500 0,0.400 0,0.300 0,0.200 0,0.100 0,0.050 0,0.025 0和0.012 5 mg/mL。每个样品均重复测定3次。
1.3.5 蛋白质的测定
称取1.5 g充分混匀的油茶果样品,精确至0.001 g,移入干燥的100 mL定氮瓶中,加入0.4 g硫酸铜、6 g硫酸钾及20 mL硫酸(消解仪)进行消化,待内容物消化至澄清透明并呈蓝绿色后,继续消化1 h。用全自动凯氏定氮仪测定。将计算得到的全氮含量乘以蛋白质转换系数6.25,即得到蛋白质含量。每个样品均重复测定3次。
1.4 数据处理
采用IBM SPSS Statistics 19.0进行方差分析,Origin Pro 8.0进行图表的制作。
2 结果与分析
2.1 单因素试验
2.1.1 前处理温度和时间对油茶果可溶性糖、蛋白质和粗脂肪含量的影响
采后油茶果仍然是一个生命活体,呼吸作用是维持其正常生命代谢的基本生理过程,其呼吸强度受到如采收前的栽培措施、采收时机械伤害的程度及采收后贮藏的环境条件等诸多因素的影响[8]。温度是直接影响采后油茶果呼吸代谢作用的重要因素之一,表1是采后油茶果分别在25,30,35和40 ℃条件下贮藏7 d期间,其可溶性糖、蛋白质和粗脂肪的含量变化。在4种贮藏温度下,采后油茶果中可溶性糖和粗脂肪含量均呈现先上升后降低趋势,蛋白质含量的变化却与之相反,但40 ℃条件下,蛋白质含量呈现不断升高趋势。在40 ℃条件下,发现可溶性糖和蛋白质含量与其他温度相比呈现成倍增长,这可能与油茶果发生渗透调节密切相关。40 ℃属高温环境,容易引起高温胁迫诱发细胞脱水,为减轻脱水伤害,可溶性糖作为维持水分平衡的重要调节物质,会出现含量急剧上升的现象,这是高温环境使得植物内淀粉水解反应增大的缘故;此外,氨基酸也是参与渗透调节的重要物质之一,很多学者研究发现,在高温胁迫下,脯氨酸合成酶类对脯氨酸反馈抑制的敏感性降低,导致游离脯氨酸大幅增加而利于水分的保持及提升原生胶体稳定性,缓解高温引起的蒸腾作用的伤害[9-13]。因此,在温度过高的环境下,油茶果出于应激反应表现更多的是渗透调节,并不利于合成油脂方向发展。
由表2可知,虽然采后油茶果在25和40 ℃处理过程中可溶性糖和粗脂肪含量变化趋势一致,但可溶性糖与粗脂肪均呈低度负相关,原因在于两者可溶性糖含量均在处理第5天达到峰值,第6天开始下降,而粗脂肪含量均在第4天已经达到峰值,第5天开始下降。在30和35 ℃处理条件下,可溶性糖含量与粗脂肪含量均呈正相关,且在30 ℃下相关系数为0.802,相关性显著(p<0.05),而在35 ℃下相关性不显著。在30和35 ℃条件下,油茶果中粗脂肪各自的最高含量均高于25和40 ℃,说明粗脂肪的积累与可溶性糖的代谢密不可分。Shi等[14]发现降低拟南芥中黏性多糖的合成能够使碳源流向油脂的合成方向,从而提高含油率。在25,30和35 ℃处理条件下,蛋白质含量均与粗脂肪含量呈负相关,35 ℃条件下蛋白质含量与粗脂肪含量变化显著相关(Pearson相关系数为-0.764),其余相关性均不显著。Mao等[15]研究发现大豆中蛋白质含量与油脂含量呈显著负相关,降低蛋白质含量是提高大豆含油率的一种有效方法。同样,Lin等[16]发现通过降低拟南芥蛋白质含量对其含油率的提升帮助有限,但Kanai等[17]发现过表达WRI1和降低蛋白含量共同作用能够起到显著增加拟南芥含油率的效果。油茶果在35℃条件处理下,蛋白质含量的变化与粗脂肪含量的变化呈显著的负相关,而粗脂肪在处理第2天达到最高(37.19%),可能是因为贮存蛋白质含量的降低使碳源流向油脂合成方向,也许能成为提高油茶果含油率的有效途径之一[18]。综上所述,35 ℃为处理温度单因素试验的优水平,作为下一步正交试验的因素之一,其3个水平分别设置为32,35和38 ℃。
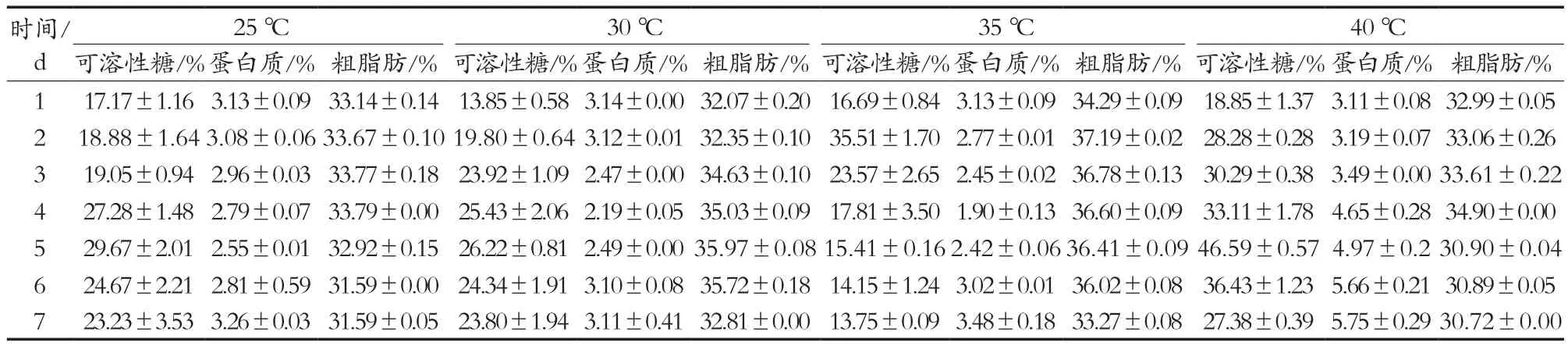
表1 油茶果在不同温度下可溶性糖、蛋白质及粗脂肪随着时间的变化

表2 可溶性糖含量、蛋白质含量及粗脂肪含量在不同温度下的相关性
2.1.2 前处理时间和温度对粗脂肪含量变化的差异分析
以粗脂肪含量为指标对处理温度和时间进行主体效应检验,从表3可知,时间和温度在不同的显著水平上存在差异,温度p=0.000<0.01,时间p=0.045<0.05。表4为不同温度对粗脂肪含量差异的两两比较结果,25与30 ℃差异不显著,跟35 ℃存在显著差异,而35与40 ℃也存在显著差异,综合可溶性糖、蛋白质的代谢情况,最终可以确认35 ℃为油茶果单因素处理的优水平。将处理时间对粗脂肪含量差异的两两比较结果进行筛选,并将差异显著的数据进行汇总,结果见表5。处理第3和第4天均与第7天在0.01显著水平上存在差异,但第3和第4天差异不显著(p=0.659),第2天p=0.033<0.05,且油茶果在35 ℃下处理第2天粗脂肪含量达到最高。将处理时间2,3和4 d作为下一步正交试验的3个水平。
2.1.3 光照处理对可溶性糖、蛋白质及粗脂肪含量的影响
为了探讨光照对油茶果前处理是否有影响,选择30 ℃处理条件作为对照,同样处理条件下放置7 d,两者可溶性糖、蛋白质及粗脂肪含量变化情况见图1。从图1可知,光照处理的可溶性糖、粗脂肪含量均高于无光处理组,且随着时间增加,差距在逐步缩小。除了第5和第7天外,无光处理的蛋白质含量均高于有光处理,这与2.1的讨论结果一致,可能贮存蛋白质的降低是提高粗脂肪含量的有效途径之一。从图1中可以发现,光照处理第4天可溶性糖含量明显高于无光处理组,这个现象与Ma等[19]、Zhan等[20]和Noichinda等[21]研究结果相似,发现采用50 μmol/(m2·s)光照处理采后的西兰花,维生素C合成基因(BO-VTC2,BO-GLDH)和再生基因(BO-MDAR1,BO-MDAR2)的表达在第1和第2天得到显著上调,可溶性糖是维生素C合成的前体物质。
采收后的油茶果呼吸作用旺盛,物质会进行大量消耗,Lewington等[22]发现采用适当的光照射植物体,能够起到推迟老化现象的作用。Hosoda等[23]采用白色荧光灯处理小松菜,小松菜所处的温度环境为28 ℃,光照处理3 d后,叶绿素的保存率可达90%,与此同时,与采收时相比维生素C增加10%~30%。在低温条件下,酶促反应速度的下降会显著降低植物呼吸作用,即便有弱光照射,植物的光合作用也会降低,所以采用相对较高的温度,可以提高植物光合作用,从而可以抵消掉呼吸作用的物质损耗[24]。综上所述,光照可能是影响采后油茶果粗脂肪含量的重要因素之一,所以在后续正交试验中进一步探讨光照因素的影响。

表3 处理时间和温度主体间效应的检验

表4 不同温度对粗脂肪含量影响的差异比较
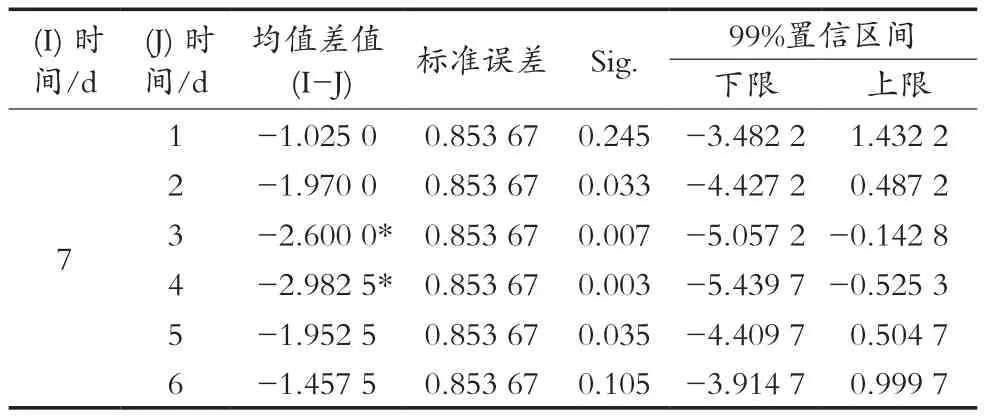
表5 不同时间对粗脂肪含量影响的差异 ℃

图1 油茶果的有无光照处理对可溶性糖、蛋白质及粗脂肪含量的影响
2.1.4 采后油茶果烘干温度对粗脂肪含量的影响
从图2可知,采后油茶果在50,60,70和80 ℃直接进行烘干后粗脂肪含量呈倒U字形,经60 ℃烘干的油茶果粗脂肪含量最高,达35.48%±0.56%,为烘干温度单因素试验优水平,下一步正交试验烘干温度的水平设置分别为55,60和65 ℃。
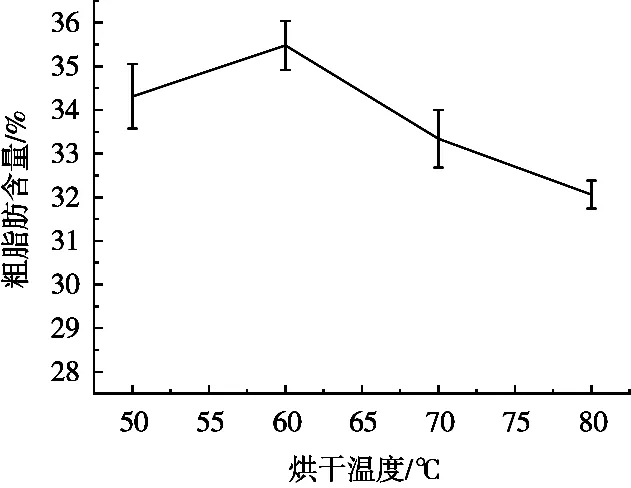
图2 不同烘干温度对采后油茶果粗脂肪含量的影响
2.2 正交试验
根据单因素的试验结果,设计三因素三水平的正交试验,因素水平表见表6。

表6 因素水平设计
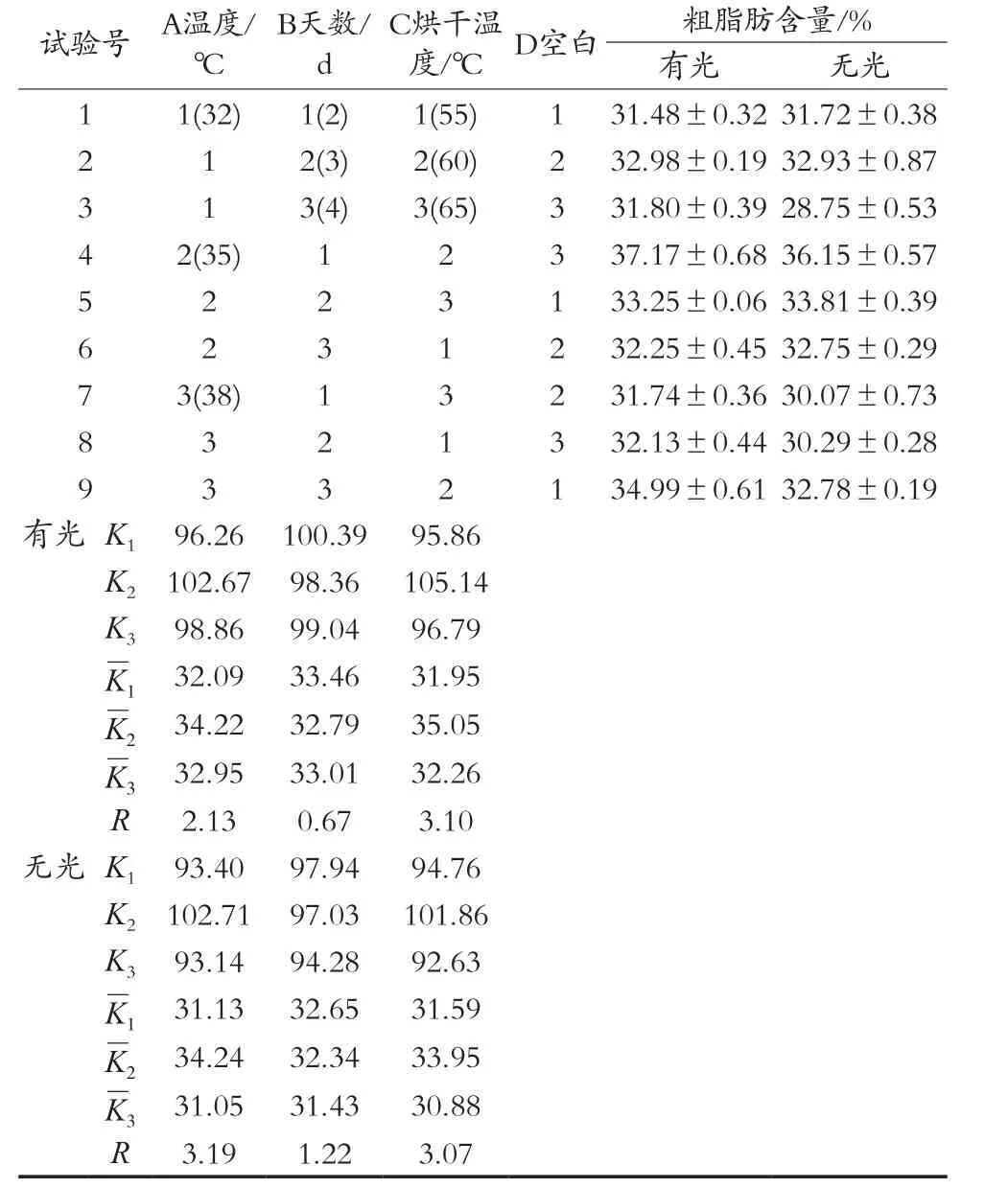
表7 正交试验
从表7极差分析结果可知,有光和无光处理的优水平均为A2B1C2,即35 ℃下处理2 d后在60 ℃下烘干,得到的粗脂肪含量分别为37.17%±0.68%和36.15%±0.57%。采后油茶果直接自然晒干和阴干的粗脂肪含量分别为33.15%±1.23%和34.29%±0.86%,晒干和阴干差异不显著(p=0.280>0.05),优化后的最佳正交组合结果与晒干、阴干相比均差异显著,p值分别为0.019和0.045。何超银等[25]研究发现采后自然晾晒能促进近成熟期果实(9月26日采收)对油脂和可溶性淀粉的积累,但对成熟果实(10月24日采收)却没有促进作用。此次试验所使用的油茶果为11月20日采收,经优化处理粗脂肪含油率显著高于自然晒干的油茶果。
3 结论
采后油茶果在25,30,35和40 ℃条件下处理7 d,40 ℃开始出现高温胁迫现象,可溶性糖和蛋白质的代谢更倾向于表现为渗透调节作用,并没有更好地朝着粗脂肪合成方向发展;在35 ℃条件下,可溶性糖与粗脂肪含量呈正相关,蛋白质含量与粗脂肪含量呈显著负相关,并且在处理第2天粗脂肪含量达到最大值(37.19%)。
将30 ℃环境下处理7 d设为对照组,探讨光照对粗脂肪含量的影响,可溶性糖和粗脂肪含量均高于对照组,除了第5和第7天无光处理的蛋白质含量略低于有光处理,其余均高于有光处理。
采后油茶果在50,60,70和80 ℃直接进行烘干后粗脂肪含量呈倒U字形,经60 ℃烘干的油茶果粗脂肪含量最高,达35.48%±0.56%。
处理温度、时间和烘干温度分别在有光和无光条件下经正交优化,最优组合均为35 ℃下处理2 d后在60 ℃下烘干,粗脂肪含量分别为37.17%±0.68%和36.15%±0.57%。光照优化组与自然晒干、阴干差异均显著,阴干和晒干差异不显著。
