菌核侧耳高产菌丝多糖的固态培养基优化
2020-12-01李赟王超
李赟,王超
1. 浙江农林大学农业与食品科学学院(杭州 311300);2. 浙江省农产品品质改良技术研究重点实验室(杭州 311300)
菌核侧耳(Pleurotus tuber-regium(Fr.)Sing)是一类珍稀的食药两用真菌。菌核侧耳的菌丝、子实体和菌核中均含有丰富的蛋白质、矿质元素、多种维生素、真菌多糖、甾体、膳食纤维等活性成分[1-2]。现代医药学研究发现,多糖为菌核侧耳的重要活性物质之一,具有降血脂、降血压、提高人体免疫力、止咳化痰和抗肿瘤等功效[3-5]。
自然界野生菌核侧耳的子实体与菌产量较小,远远低于人们的需求。固态培养更接近于菌核侧耳在自然界野生状态下的生理习性,有利于菌丝的生长及活性物质的表达[6]。此次试验以农林废弃物竹粉和桑叶作为固体培养基主料,探索菌核侧耳在此培养基上生长及高产菌丝多糖的适宜条件,并对菌丝多糖的性质进行初步分析,为菌核侧耳人工培育及其精深加工,为竹产业的循环发展,提供重要的基础数据和参考依据。
1 材料与方法
1.1 材料与试剂
菌核侧耳,购自中国普通微生物菌种保藏中心,4 ℃保存于PDA斜面培养基上;竹粉,取自浙江临安板桥竹材加工厂,分摊晒干后,除去竹蔑等杂物,包装备用;桑叶,采摘自浙江农林大学东湖校区林场,去除病残叶片,清洗,在50 ℃烘箱中烘干2 h,剪碎备用。
果糖、甘露糖、葡萄糖、木糖、半乳糖等试剂均为分析纯。
斜面培养基:土豆200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH自然。
液态种子培养基:葡萄糖20 g/L,酵母膏5 g/L,KH2PO41 g/L,VB10.01 g/L,硫酸镁0.5 g/L,pH自然。
固态基础培养基:竹粉60 g,按KH2PO41 g/L、VB10.01 g/L的浓度溶解于水中,固态基质的初始含水率60%,pH自然。
1.2 仪器与设备
立式压力蒸汽灭菌器(江阴滨江医疗设备有限公司);旋转蒸发仪RE-52AA(上海亚荣生化仪器厂);HH-4型数显恒温水浴锅(国华电器有限公司);恒温培养箱(上海金平);低温冷冻离心机(艾本德中国有限公司);UV-5500紫外可见分光光度计(上海元析仪器有限公司)。傅里叶变换红外光谱仪(赛默飞世尔科技有限公司);高效液相色谱仪(安捷伦科技有限公司);氮吹仪(天津奥特赛恩斯仪器有限公司);高效液相凝胶色谱仪(美国怀雅特技术公司)。
1.3 试验方法
1.3.1 液态种子培养
挑选长势良好的斜面菌种转接到杀菌冷却后装有150 mL液体种子培养基的三角瓶中,在25 ℃,120 r/min条件下恒温培养4 d,用无菌纱布过滤后得菌悬液,备用。
1.3.2 单因素研究
1.3.2.1 固态培养基质配比的研究
固态培养基质选择竹粉和桑叶,以菌丝生长态势和菌丝多糖含量为指标,考察竹粉和桑叶最适宜的质量比。试验共分5组,每组中竹粉和桑叶的总质量均为60 g。Ⅰ组,竹粉60 g、桑叶0 g;Ⅱ组,竹粉40 g、桑叶20 g;Ⅲ组,竹粉30 g、桑叶30 g;Ⅳ组,竹粉20 g、桑叶40 g;Ⅴ组,竹粉0 g、桑叶60 g。
在500 mL三角瓶中分别装入固态培养基质(按上述比例,共60 g),不另外添加碳源、氮源、无机盐,主要考察固态培养基质直接培养菌核侧耳菌株的效果。用牛皮纸裹四层纱布封口,于121 ℃灭菌40 min,冷却至室温后,每瓶基质中接入10 mL活化后的菌悬液,培养基初始含水率60%,于28 ℃恒温培养20 d,取出带有菌丝的固态基质,进行分析测定[7-8]。
1.3.2.2 外加碳源的研究
根据1.3.2.1的研究结果,改变培养基中的碳源,研究碳源对菌丝多糖含量的影响[8]。分别按照基质干质量(60 g)的2%,即1.2 g果糖、甘露糖、葡萄糖、木糖、半乳糖溶解到90 g纯净水中,以菌丝多糖含量为指标,考察最适宜的外加碳源种类。
1.3.2.3 外加氮源的研究
根据1.3.2.1的研究结果,改变培养基中的氮源[9],研究氮源对菌丝多糖含量的影响。将牛肉膏、蛋白胨、酵母粉、玉米粉、黄豆粉单一氮源,分别按照基质干质量的0.5%,即0.3 g添加到60 g固态基质中,调整培养基初始含水率为60%,以菌丝多糖含量为指标,考察最适宜的外加氮源种类。
1.3.2.4 外加无机盐的研究
根据1.3.2.1的研究结果,改变培养基中的无机盐[10],将KCl、MgSO4、ZnSO4、FeCl2和CaCl2分别按照基质干质量的0.05%,即0.03 g分别溶解到90 g纯净水中,以菌丝多糖含量为指标,考察最适宜的外加无机盐种类。
1.3.3 正交试验研究
以菌核侧耳菌丝多糖含量为指标,采用正交试验,考察固态培养基质(竹粉和桑叶的配比)、外加碳源、外加氮源和外加无机盐4个因素的交互作用,因素水平设计见表1。

表1 正交试验的因素水平设计(L9(34))
1.3.4 菌丝生物量的测定
将发酵20 d后的固体菌丝从固体培养基中分离,过筛除去基质粉末,于60 ℃恒温干燥72 h,用粉碎机粉碎后称重[11]。
1.3.5 菌丝多糖的提取
取10 g干燥的菌丝体,按照每克菌丝体加20 mL纯净水的比例,加入200 mL的纯净水,在90 ℃下水浴提取2 h,将浸提液以8 000 r/min离心20 min,保存上清液。取离心后的残渣,按照每克残渣加20 mL纯净水的比例加入纯净水,在90 ℃下水浴提取2 h,浸提液以8 000 r/min离心20 min,取上清液。将2次上清液合并,置于旋转蒸发仪中减压浓缩至50.0 mL左右,再将浓缩液和95%的乙醇按1∶4(V/V)的比例混合,醇沉过夜,以4 000 r/min离心20 min,将沉淀物依次用无水乙醇、丙酮润洗3~4次,干燥,获取菌核侧耳菌丝多糖[12-13]。
1.3.6 菌丝多糖含量的测定
先按苯酚硫酸法绘制标准曲线[14];再称取1菌丝多糖,用50 mL蒸馏水溶解,吸取2 mL,加入1 mL体积分数为5%的苯酚溶液,再加入5 mL浓硫酸,迅速振荡均匀。室温下静置10 min,在490 nm处测定吸光度,计算菌丝多糖含量。
1.3.7 傅里叶红外检测菌丝多糖
将菌丝多糖置于40 ℃烘箱中干燥,称取2 mg加入200 mg的溴化钾进行压片,然后进行红外光谱测定,扫描范围为4 000~400 cm-1。
1.3.8 GPC测菌丝多糖的相对分子质量
称取20 mg菌核侧耳菌丝多糖,溶于超纯水中,上机检测。色谱条件:色谱柱,Shodex OHpak系列SB-806串803;流速,1 mL/min;流动相,水和0.02%叠氮化钠;柱温,40 ℃;进样量,500 μL。
1.4 数据处理
试验重复3次,数据利用SPSS 19.0分析,采用Origin 2017软件绘图。
2 结果与分析
2.1 单因素研究结果
2.1.1 固态培养基质配比对菌核侧耳生长的影响
从表2可以看出,当竹粉与桑叶质量比为2∶1时,菌丝生长状态最好:菌丝洁白致密,缠绕盘结于料层内部,有利于后期形成菌核;而单一使用竹粉和桑叶时,菌丝发满培养料层的时间偏长,菌丝略黄,菌丝不够致密,这可能是单一的基质不能供给足够的营养物质,当竹粉与桑叶质量比为2∶1时,其内部的碳、氮等物质有利于菌丝的生长。
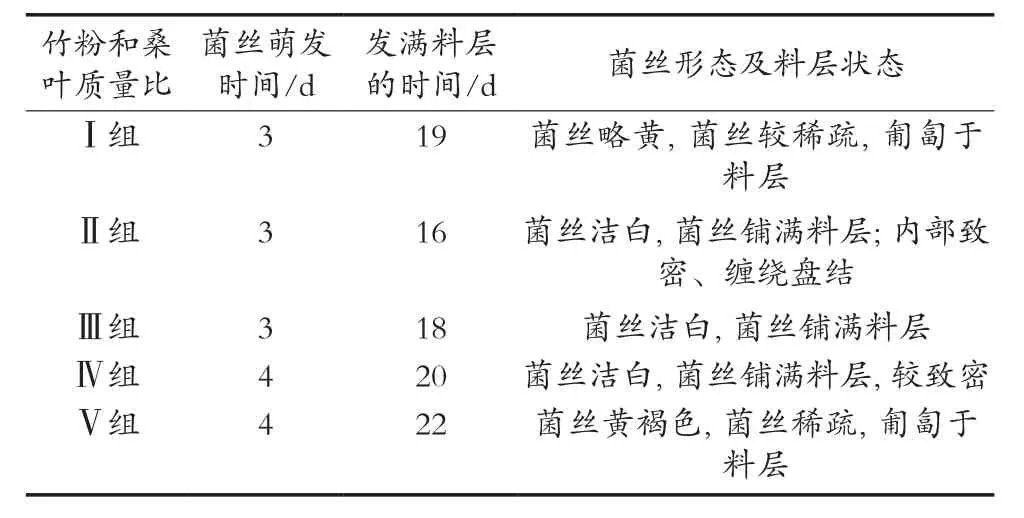
表2 基质种类对菌核侧耳菌丝萌发及生长的影响
从图1可以看出,当竹粉与桑叶质量比为2∶1配比时,菌丝多糖含量最高,这表明良好的菌丝生长为多糖等活性物质的分泌表达奠定了良好的生物学基础。因此,在后续单因素试验中,固态培养基质中竹粉与桑叶的质量比为2∶1。

图1 固态培养基质对菌核侧耳产菌丝多糖的影响
2.1.2 外加碳源对菌核侧耳产菌丝多糖的影响
从图2可以看出,碳源对菌核侧耳产菌丝多糖有不同的影响,果糖和葡萄糖均有较好的促进作用,甘露糖次之,半乳糖最差。从经济角度考虑,选定葡萄糖为最优碳源。

图2 外加碳源对菌核侧耳产菌丝多糖的影响
2.1.3 外加氮源对菌核侧耳产菌丝多糖的影响
从图3可以看出,外加无机氮源和有机氮源对菌核侧耳产菌丝多糖均有一定的促进作用。其中,酵母粉促进效果最好,菌丝多糖含量为7.6 mg/g,蛋白胨和牛肉膏促进效果相似,菌质多糖含量均为7.1 mg/g,使用黄豆粉和玉米粉后的结果分别为6.8和6.7 mg/g。分析其原因:固态培养过程中,菌丝匍匐伸展,因此基质的疏松状态对菌丝生长至关重要。添加酵母粉的发酵基质相对疏松,黏结程度不高,有利于菌丝获取营养成分和生长。
2.1.4 添加无机盐对菌核侧耳产菌质多糖的影响
从图4可以看出,金属离子对菌核侧耳产菌丝多糖有一定的促进或抑制作用。K+、Mg2+、Zn2+有促进作用,其中Zn2+最好,因此选择Zn2+作为外加金属离子。

图3 外加氮源对菌核侧耳产菌丝多糖的影响

图4 添加无机盐对菌核侧耳产菌丝多糖的影响
2.2 正交试验研究结果
根据单因素试验结果,对竹粉和桑叶质量比、外加碳源、外加氮源、无机盐进行四因素三水平(L9(34))正交试验,结果见表3。
极差分析表明,影响菌核侧耳产菌丝多糖的主次因素为D>A>C>B,最优组合为A3B1C1D2,即竹粉与桑叶质量比2∶1、葡萄糖用量1%、酵母粉用量0.25%、Zn2+用量0.05%。

表3 正交试验结果
2.3 菌核侧耳产菌丝多糖的验证试验结果
因最优组合A3B1C1D2并不在正交试验表中,按照A3B1C1D2,在菌悬液接种量10%,培养基初始含水率60%条件下28 ℃恒温培养20 d,结果如图5所示。
从图5可以看出,菌核侧耳在优化后的培养基中,培养前10 d生长缓慢,在菌丝发满料层的底层后,生长迅速,在第16天发满整个培养料层;菌丝多糖的含量也随着菌丝的粗壮、缠绕盘结而增多,在第18和第19天时达到最高,每瓶培养料中菌丝生物量(干质量)可达155 mg,菌丝多糖含量达13.8 mg/g。

图5 菌核侧耳产菌丝多糖验证试验结果
2.4 菌核侧耳菌丝多糖的红外光谱分析
从图6可以看出,波数3 424.73 cm-1处的吸收峰强而且宽,是O—H的伸缩振动[15];波数2 928.13 cm-1为CH2或CH上的C—H的伸缩振动;波数1 653.07 cm-1处为糖醛酸中羰基C=O键非对称的伸缩振动峰[16];波数1 401.63 cm-1为C—H弯曲振动吸收峰;波数1 200~1 000 cm-1吸收峰是由糖环上或糖苷键上C—O—C伸缩振动所引起的[17];波数973.22 cm-1为吡喃环的吸收峰[18]。

图6 菌丝多糖红外光谱
2.5 菌核侧耳多糖的分子摩尔质量
从图7可以看出,光散射和示差检测器所产生的峰的大小和形状几乎重合,这表明2种检测器间的延迟已被准确地确定。菌核侧耳菌丝多糖的出峰时间为12.13~35.83 min,菌核侧耳菌丝多糖的重均分子摩尔质量MW为4.751×104g/mol,数均分子摩尔质量Mn为2.880×104g/mol,最高峰分子摩尔质量(峰尖分子摩尔质量)Mp为3.488×104g/mol,Z均分子摩尔质量MZ为1.126×106g/mol,MW/Mn的值为1.649,表明菌核侧耳的菌丝多糖是一类中等分布聚合物。

图7 菌丝多糖分子摩尔质量谱图
如图8所示,在重均分子摩尔质量分析的基础上,采用ASTRA软件对4个分子摩尔质量划分区间的菌核侧耳菌丝多糖的分子摩尔质量进行统计分析,4个分子摩尔质量划分的区间分别为:200~2.6×104,2.6×104~7.5×104,7.5×104~2.6×105和2.6×105~9.6×105g/mol。菌核侧耳菌丝多糖分子摩尔质量分布情况如表4所示,菌丝多糖大部分分布在2.6×104~7.5×104g/mol之间,占其总分子数量的84.8%。

图8 菌丝多糖分子摩尔质量分布图

表4 菌丝多糖分子摩尔质量分布表
3 结论
1) 对菌核侧耳固态培养的条件进行了分析和优化,获得了最佳培养条件,即竹粉与桑叶质量比2∶1、葡萄糖用量1%、酵母粉用量0.25%、Zn2+用量0.05%,菌悬液接种量10%,培养基初始含水率60%,28 ℃恒温培养20 d,每瓶培养料中菌丝生物量(干质量)可达155 mg,菌丝多糖含量达13.8 mg/g,这为人工培育菌核侧耳产菌丝多糖提供了重要的参考依据。
2) 对菌核侧耳菌丝多糖进行了初步分析,结果表明,该多糖属于一种吡喃糖,重均分子摩尔质量MW为4.751×104g/mol,是一种中等分布聚合物,大部分分布在2.6×104~7.5×104g/mol之间,占其总分子摩尔质量的84.8%。这为后续深入研究菌核侧耳菌丝多糖的结构、功能及生物活性奠定了一定的工作基础。
