复合益生菌在乳酸菌饮料中的发酵特性和功能性质研究
2020-12-01韩之皓王月娇王记成张和平
韩之皓 郭 帅 黄 天 郑 岩 王月娇 白 梅 王记成 张和平
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室内蒙古呼和浩特010018)
益生菌是一类通过改善宿主肠道菌群的平衡而发挥作用的活性微生物, 是人体肠道重要的生理菌, 具有抑制病原菌的生长繁殖,抗氧化,降血脂,提高机体免疫力等多种功能特性,被广泛应用于食品、医药等相关领域[1-3]。益生菌发酵乳制品是将菌株的保健作用与乳制品的健康功效完美结合,受到广大消费者的普遍欢迎。单菌的发酵过程及产品安全性可控,是近代微生物学的巨大进步,然而单菌株的功能特性,因菌株代谢产物不同而造成明显差异,具体应用受到限制[4]。近年来,随着基因组学、代谢组学及肠道微生物理论的发展,筛选具有特定功能特性的益生菌,将其复配用于功能食品的开发具有重要的意义。目前对于多菌株发酵的具体应用,以及提高不同发酵制品的功能特性,仍需深入研究[5]。
本研究利用8 株分离源明确、有良好益生特性和保健功能的益生菌制备乳酸菌饮料,探究复合益生菌的发酵特性及其对不同发酵基料乳酸菌饮料功能特性的影响,以期为功能性乳制品的开发提供新的方法。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株 本试验所用益生菌(见表1)直投式发酵剂由内蒙古农业大学“乳品生物技术与工程”教育部重点实验室生产。
本试验所用指示菌菌株大肠杆菌O157:H7(Escherchia coli O157:H7)、金黄色葡萄球菌(Staphylococcus aureus)、弗氏志贺氏菌(Shigella flexneri)、鼠伤寒沙门氏菌(Salmonella typhimurium)由内蒙古农业大学“乳品生物技术与工程”教育部重点实验室提供。
1.1.2 主要试剂及培养基 脱脂乳粉 (蛋白质含量33%),新西兰NZMP;浓缩乳清蛋白粉(蛋白质含量80%),美国HILMAR 公司;大豆分离蛋白粉(蛋白质含量95%,富吉普乐200),吉林不二蛋白有限公司;血管紧张素转换酶(ACE)、马尿酰组氨酰亮氨酸(HHL)、马尿酸(HA)、DPPH,美国sigma公司;甲醇、乙腈、三氟乙酸等色谱纯试剂,美国Fisher Chemicals 公司;MRS 固体培养基、LB 液体培养基、NB 液体培养基、TSB 培养基等,广州环凯微生物科技有限公司。

表1 菌株信息Table 1 Information of strains
1.1.3 主要试剂盒 超氧阴离子(O2-·)清除能力检测试剂盒(BC1415)、羟自由基(·OH)清除能力检测试剂盒(BC1325)、总抗氧化能力(T-AOC)检测试剂盒,北京索莱宝科技有限公司。
1.1.4 主要设备和仪器 超净工作台 (SJ-CJ-2FDQ),苏州苏洁净化设备有限公司;高压均质机(SRH60-70),上海申鹿均质机有限公司;高速台式离心机(Eppendorf 5810R),德国Eppendorf 公司;电热恒温水浴锅,上海一恒科技有限公司;多功能微孔板检测仪 (Synergy-H1),BioTek Instruments Inc;pH 计(雷磁pHSJ-3F),上海精密科学仪器有限公司;游标卡尺(BM770150),Digital Caliper;Agilent1100 液相色谱系统,美国Agilent公司。
1.2 试验方法
1.2.1 菌株的活化 将4 株致病菌接种于各自培养基(5 mL 液体培养基,121 ℃灭菌15 min)中,置37 ℃培养24 h,按2%的接种量接入各自培养基中活化至3 代,在37 ℃培养至指数生长期,采用平板计数法确定活菌数,用0.85%的生理盐水重悬3 次,得到浓度为1×106CFU/mL 的菌悬液。
1.2.2 乳酸菌饮料的制备 分别将脱脂乳粉、乳清蛋白粉、大豆分离蛋白粉溶解于预热至55 ℃的水中,水合30 min,于85 ℃杀菌15 min,冷却。将复合菌株按总接种量5×106CFU/g 接入不同样品(3 种样品总接种量一致,且蛋白质含量均为4%)中,置于37 ℃恒温培养箱中发酵,培养24 h 得发酵基料。将发酵基料与稳定剂、甜味剂混合并溶于水中(60 ℃),调酸、20 MPa 均质,所得样品(蛋白质含量均为1%)即为基料不同的3 种乳酸菌饮料(具体接种量见表2)。

表2 样品中菌株添加量Table 2 The addition of strain in samples
1.2.3 pH 值测定 将乳酸菌饮料发酵基料放至室温后,用精密pH 计测量。
1.2.4 复合益生菌活菌数的测定 对活性乳酸菌饮料发酵基料进行梯度稀释,采用平板计数法检测菌落总数,单位为CFU/mL,每隔2 h 做1 次活菌计数。
1.2.5 Gompertz 模型拟合复合益生菌的生长曲线及产酸曲线 用修正后的Gompertz 模型对复合益生菌在脱脂乳粉、大豆分离蛋白粉、乳清蛋白粉3 种基料的生长曲线及产酸曲线进行拟合。修正后的Gompertz[6-7]模型为:
Y(t)=N0+C exp{-exp[-B(t-M)]}
式中,N0——初始值;B 为最大生长速率,B 越大,复合益生菌在相应的基料中生长速率或产酸速率越快;C——稳定期与初始值之间的差距;M值——达到最大生长速率或产酸速率所需时间,M 值越小,复合益生菌在相应基料中的适应能力越强。
1.2.6 抗氧化能力的测定 DPPH 自由基清除能力的测定参考文献[8],[9]的测定方法并略作调整。分别取2 mL 样品溶液与2 mL 2×10-4mol/L DPPH 溶液充分混合,室温放置,暗反应30 min,稳定后用酶标仪测定其在517 nm 处的吸光值Ai,同时测定2 mL 样液与2 mL 无水乙醇混合溶液吸光值Aj,采用无水乙醇代替样液与DPPH 溶液混合测定其吸光值A0,DPPH 自由基清除率计算公式:

O2-·清除能力、·OH 清除能力以及总抗氧化能力(T-AOC)的测定依照相应检测试剂盒说明书操作,使用酶标仪对每个样品重复检测3 次,每次设计3 个平行。
1.2.7 抑制致病菌能力的测定 采用琼脂孔扩散法(Well-diffusion Agar Assay)测定不同基料乳酸菌饮料代谢产物的抑菌效果。吸取200 μL 肠道致病菌液(106CFU/mL)与灭菌并冷却后的营养肉汤琼脂培养基(20 mL)一起倒入平板充分混合。待加有肠道致病菌的营养肉汤琼脂培养基冷却凝固结实后,用直径8 mm 打孔器在琼脂平板上打孔,将乳酸菌饮料样品离心 (4 500 g,10 min),用0.22 μm 微孔滤膜过滤,滤液为复合益生菌代谢上清液。每孔加入滤液100 μL,在4 ℃冰箱中扩散12 h后于37 ℃恒温培养48 h,使用游标卡尺测量抑菌圈直径(保留两位有效数字)。
1.2.8 ACE 抑制率的测定
1)样品前处理 将乳饮料样品离心 (4 500 g,10 min),上清液用10 mol/L NaOH 溶液调节pH 值至8.3,离心(12 000 g,10 min)。
2)样品处理 将HHL 和ACE 分别溶解于0.3 mol/L NaCl 和0.1 mol/L 硼酸钠缓冲溶液(pH 8.3)中。在2 mL 离心管中加100 μL HHL(0.010 mol/L)和100 μL 待测样品后充分震荡混匀,37 ℃孵育2 min 后加100 μL ACE(0.010 U/mL)溶液,充分震荡混匀,于37 ℃反应40 min 后85 ℃水浴加热10 min 使酶失活,终止反应后加入400 μL 0.1 mol/L EDTA 溶液。将处理好的样品过0.22 μm滤膜,置进样瓶中,于-20 ℃保存,备用。
3)马尿酸含量的测定 使用 RP-HPLC 法测定酶解反应中反应产物马尿酸含量。色谱柱:ZORBAX C18(4.6 mm×250 mm,5 μm,美国Agilent 公司);流动相:体积比为22%乙腈(含0.1%TFA)和78%去离子水(含0.1% TFA)溶液;流速1.0 mL/min;检测波长228 nm;柱温30 ℃;进样量20 μL。
ACE 抑制率的计算公式:

式中,[HA]c——对照样品中马尿酸质量浓度(加缓冲液),mg/mL;[HA]s——待测样品中马尿酸质量浓度,mg/mL;[HA]h——HHL 标品中马尿酸质量浓度,mg/mL。
1.3 数据处理
2 结果与分析
2.1 复合益生菌生长曲线及产酸曲线
由图1可知,复合益生菌在3 种基料中经历了延滞期、对数期和稳定期。在脱脂乳中,其4 h后进入指数生长期,4~23 h 呈指数生长特性,于23 h 时复合益生菌生长量达到最高值2.82×109CFU/g,其中双歧杆菌的活菌数为2.86×108CFU/g,23h 后进入稳定期。在大豆分离蛋白中,其5 h 后进入指数生长期,5~24 h 呈指数生长特性,于24 h时复合益生菌生长量达到最高值为1.57×109CFU/g,其中双歧杆菌的活菌数为1.31×108CFU/g,24 h后进入稳定期。在乳清蛋白中,其8 h 后进入指数生长期,8~26 h 呈指数生长特性,于26 h 时复合益生菌生长量达到最高值为1.34×109CFU/g,其中双歧杆菌的活菌数为1.78×108CFU/g,26 h 后进入稳定期。为了更好地研究复合益生菌在3 种基料中的生长情况,应用修正后的Gompertz 模型对试验数据进行拟合,其模型具体参数见表3所示。3种基料中的N0值相近,表明3 种基料中复合益生菌的接种量相同,均为5×106CFU/g。B 为最大生长速率,3 种基料中B 分别为0.23,0.19,0.13,表明复合益生菌在脱脂乳中生长速率最快,在较短的时间内获得高密度、高活力细胞,在大豆分离蛋白中次之,在乳清蛋白中略慢。M 值为达到最大生长速率所需时间,3 种基料中M 分别为8.16,10.94,16.24,表明复合益生菌在脱脂乳中早期适应能力较强。表3所示,3 种基料中Gompertz 模型的残差平方和(SSE)均小于回归平方和(SSR),R2均为0.99,表明Gompertz 模型可较好地表示3 种基料中复合益生菌活菌数与时间的关系。相关研究显示,乳酸菌通过蛋白酶水解蛋白质形成多肽生长,多肽被吸收后水解成氨基酸供细菌生长需要,生长依赖寡肽作为氮源占98%,其寡肽转运系统在利用肽方面至关重要,因此,复合益生菌水解蛋白质获得生长与其氮源转运系统密切相关[10-11]。上述试验结果表明,在3 种蛋白质基料中,复合益生菌水解脱脂乳中的乳蛋白作为氮源能够更好地促进其细胞增殖。
由图2可知,复合益生菌在3 种基料中生长,基料pH 值呈下降趋势,其产酸曲线与生长曲线相同,经历了延滞期、对数期和稳定期,且产酸速率与生长速率大体相同。应用修正后的Gompertz模型拟合复合益生菌在不同基料中酸度的变化情况,其模型具体参数见表3。从残差平方和(SSE)、回归平方和(SSR)及R2可知,Gompertz 模型与实际产酸情况匹配较好。上述结果表明,复合益生菌在脱脂乳中产酸速率最快,其酸度变化情况与生长曲线相近。

表3 复合益生菌生长及产酸模型参数Table 3 Model parameters of compound probiotics during growth and acid-production

图1 复合益生菌的生长曲线Fig.1 The growth curve of compound probiotics
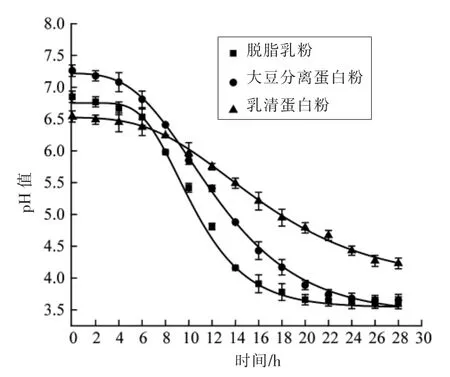
图2 复合益生菌的产酸曲线Fig.2 Acid production rates of compound probiotics
2.2 复合益生菌对乳酸菌饮料抗氧化能力的影响
比较不同基料乳酸菌饮料的抗氧化活性,结果见图3。综合3 类样品的抗氧化能力指标,以脱脂乳粉为基料的乳酸菌饮料,其DPPH 自由基清除能力、O2-·清除能力以及总的抗氧化能力(图中单位定义:样品的抗氧化能力以达到同样吸光度变化值所需的标准液离子浓度表示)最强,·OH 的清除能力略弱;以乳清蛋白粉为基料的乳酸菌饮料,其·OH 的清除能力最强,其它两种自由基清除能力及总的抗氧化能力较强;以大豆分离蛋白粉为基料的乳酸菌饮料,其·OH 的清除能力较强,剩余3 种抗氧化指标较低。相关研究表明,部分乳酸菌菌体及其代谢产物具有抗氧化活性,可通过水解蛋白质产生抗氧化肽,同时在发酵过程中产生超氧化物歧化酶 (SOD)、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶类物质,可消除自由基链反应引发阶段的自由基及其它引发剂(SOD 具有清除O2-·的能力,GSH-Px 具有清除过氧化物和·OH的能力)[12-13]。上述结果表明,复合益生菌在乳清蛋白中可能具有较高的GSH-Px 活性,在脱脂乳中可能具有较高的SOD 活性,同时其产生非酶类抗氧化物质,包括抗氧化肽、抗氧化维生素等的能力较强。
2.3 复合益生菌对乳酸菌饮料抑制致病菌能力的影响

图3 不同基料乳酸菌饮料的抗氧化活性Fig.3 The antioxidant activities of lactic acid bacteria beverages with different materials
由表4可见,3 种基料的乳酸菌饮料对以下4种致病菌均有一定的抑制作用,而抑制能力不同。以脱脂乳粉为基料的乳酸菌饮料,其抑制大肠杆菌、金黄色葡萄球菌、弗氏志贺氏菌的能力最强;以大豆分离蛋白粉为基料的乳酸菌饮料,其抑制鼠伤寒沙门氏菌的能力最强;以乳清蛋白粉为基料的乳酸菌饮料,其对4 种致病菌的抑制能力相对较弱。同一基料对不同致病菌的抑制能力亦不同,3 种基料均对大肠杆菌有较强的抑制能力,对鼠伤寒沙门氏菌和金黄色葡萄球菌抑制能力较弱。相关研究显示,乳酸菌在代谢过程中会产生有机酸、细菌素、过氧化氢等多种天然抑菌活性物质,其中乳酸和乙酸等有机酸能显著降低环境pH值,使多数不耐酸细菌的生长受到限制;细菌素是一类具有生物活性的蛋白质、多肽或前体多肽,当其达到一定数量时能够破坏细胞结构,有效抑制病原微生物的生长[14-16]。由2.1 节确定的复合益生菌产酸曲线可知,复合益生菌在脱脂乳和大豆分离蛋白中产酸能力较强,可能是两种乳酸菌饮料抑制致病菌能力强的主要原因之一。

表4 不同基料乳酸菌饮料抑制致病菌能力Table 4 The bacteriostatic ability of lactic acid bacteria beverages with different materials
2.4 复合益生菌对乳酸菌饮料降血压能力的影响
相关研究表明,血管紧张素转换酶(ACE)是普遍存在于哺乳动物组织中的一种膜结合的二肽羧基酶,其在人体肾素-血管紧张素系统和激肽-激肽生成酶系统中对血压调节起着重要的作用,目前,ACE 已成为现代医学治疗高血压最有效的靶点之一[17-18]。乳酸菌通过发酵可以获得ACE 抑制肽,其能够抑制ACE 活性,起到降血压的作用[19]。由表5可知,3 种基料的乳酸菌饮料,其ACE 抑制活性比较结果为:脱脂乳粉>乳清蛋白粉>大豆分离蛋白粉。目前,被公认的抗高血压三肽VPP 和IPP 来源于乳蛋白中的酪蛋白[20],这可能是以脱脂乳粉为基料的乳酸菌饮料ACE 抑制活性强的主要原因之一。

表5 不同基料乳酸菌饮料ACE 抑制活性Table 5 ACE inhibitory activity of lactic acid bacteria beverages with different materials
2.5 复合益生菌对贮藏期(4℃)不同基料的乳酸菌饮料功能特性的影响
表6所示不同基料乳酸菌饮料贮藏期内功能特性的变化。利用主成分分析法对表示其功能特性的9 项指标进行数据转换和降维,确定主成分个数并对其综合评分。依照主成分分析法中特征值大于或等于1 的原则提取到3 个主成分。由表7可知,第1 主成分的特征值为4.110,贡献率为45.669%;第2 主成分的特征值为3.480,贡献率为38.668%;第3 主成分的特征值为1.013,贡献率为11.252%,3 个主成分的累计贡献率为95.589%,说明上述3 个主成分能够代替所有指标评价不同基料对于乳酸菌饮料功能特性的影响。由表8中的旋转成分载荷矩阵可知,O2-·清除率、DPPH 清除率、总抗氧化能力、ACE 抑制率等变量与第1 主成分相关性较高,金黄色葡萄球菌、鼠伤寒沙门氏菌、弗氏志贺氏菌和大肠杆菌抑制能力与第2 主成分相关性较高,·OH 清除率与第3 主成分相关性较高。综上,第1、第3 主成分主要反映乳酸菌饮料抗氧化及降血压能力,第3 主成分反映其抑制致病菌能力。由图3可知,贮藏期内的乳酸菌饮料从左到右可分为3 个集合,其中B 和C 部分相交且与A 完全区分,表明发酵基料及贮藏时间均对其功能特性产生影响,且发酵基料对其功能特性影响较为明显。通过公式(综合因子得分=各成分得分×对应权重之和)得到综合得分排名。由表9可知,不同基料乳酸菌饮料贮藏期内功能特性的综合得分结果为:脱脂乳粉>大豆分离蛋白粉>乳清蛋白粉,且在同一基料中随贮藏时间的推移,乳酸菌饮料功能特性增强,于14 d 时综合得分达到最高值,之后略有下降,然而始终高于贮藏初期。这是由于在贮藏初期,乳酸菌持续水解蛋白质生成部分功能性小分子肽 (抗氧化肽、抗菌肽、ACE 抑制肽),并随贮藏时间的增加,形成功能性氨基酸,使样品功能特性增强;14 d 后,乳酸菌水解蛋白质速度减慢,且部分功能性肽发生降解,使样品整体功能特性开始降低。

图4 乳酸菌饮料的功能特性主成分得分图Fig.4 Score scatter plot of functional properties of lactic acid bacteria beverages

化氧抗总-1·mL/U力能2.25±0.03 1.36±0.02 1.52±0.03 2.31±0.04 1.77±0.01 1.87±0.03 2.54±0.01 1.92±0.02 1.89±0.03 2.52±0.01 1.87±0.01 1.78±0.01 2.13±0.03 1.73±0.02 1.59±0.02化变的性特能功内期藏贮料饮菌酸乳料基同不6表Changes of functional properties of lactic acid bacteria beverages with different materials during storage Table 6 力能化氧抗力能压血降/mm径直圈菌抑清的/%·OH率除/%率除-·清O2基由/%自率DPPH除清率/制抑%ACE沙寒菌伤氏鼠门贺志菌氏氏弗萄葡色菌黄球金菌杆:H7肠大O 157 36.88±1.54 41.97±1.12 88.33±1.02 68.52±1.36 18.74±0.35 22.12±0.24 19.46±0.33 23.76±0.28 37.22±1.61 35.31±1.34 79.62±1.34 61.79±1.04 19.59±0.26 20.26±0.32 19.36±0.62 21.35±0.44 40.48±1.27 38.42±1.54 82.49±1.27 64.32±1.51 18.45±0.42 17.92±0.26 18.88±0.25 19.92±0.35 37.32±1.36 42.28±1.63 93.52±1.42 66.46±1.58 19.62±0.37 22.01±0.43 19.89±0.66 24.02±0.75 39.28±1.71 38.52±1.18 80.31±1.16 60.58±1.25 20.86±0.21 22.42±0.16 20.96±0.43 22.82±0.58 42.64±1.48 40.84±1.47 83.52±1.58 62.58±1.41 19.23±0.18 18.47±0.76 19.45±0.24 20.15±0.27 39.45±1.49 44.33±1.29 94.56±1.72 66.23±1.74 21.34±0.22 23.02±0.56 20.87±0.77 25.08±0.24 40.86±1.22 38.68±1.46 81.02±1.42 60.02±1.53 21.32±0.34 23.26±0.72 21.38±0.53 23.52±0.52 43.39±1.39 42.21±1.39 85.74±1.52 62.01±1.37 19.78±0.43 18.95±0.38 19.57±0.46 20.36±0.79 37.88±1.72 41.22±1.13 87.32±1.62 65.49±1.03 21.68±0.76 23.99±0.83 21.94±0.28 26.03±0.80 38.42±1.61 36.21±1.74 81.62±1.34 59.82±1.63 21.87±0.54 24.08±0.47 22.02±0.65 23.96±0.24 41.74±1.37 39.28±1.28 83.24±1.63 61.32±1.23 21.74±0.38 19.19±0.60 20.02±0.32 20.99±0.29 36.31±1.25 40.28±1.44 86.24±1.57 63.01±1.58 22.09±0.79 24.01±0.73 22.02±0.29 26.15±0.37 36.74±1.22 35.51±1.29 79.42±1.27 59.48±1.71 22.89±0.24 24.26±0.14 20.77±0.28 24.36±0.65 39.42±1.45 37.67±1.17 82.83±1.32 60.05±1.25 21.95±0.51 19.69±0.57 20.36±0.46 21.23±0.74类种品样粉乳粉白蛋离分粉白蛋粉乳粉白蛋离分粉白蛋粉乳粉白蛋离分粉白蛋粉乳粉白蛋离分粉白蛋粉乳粉白蛋离分粉白蛋脂脱豆大清乳脂脱豆大清乳脂脱豆大清乳脂脱豆大清乳脂脱豆大清乳/d间时0 7 1 4 21 28

表7 特征值和累计贡献率Table 7 Eigenvalues and cumulative contribution ratios

表8 主成分载荷矩阵Table 8 Principal component loading matrix

表9 综合因子得分Table 9 Comprehensive factor score
3 结论
1)应用修正后的Gompertz 模型对复合益生菌在脱脂乳粉、大豆分离蛋白粉、乳清蛋白粉3 种基料中的生长曲线及产酸曲线进行拟合,研究其发酵特性,结果表明:复合益生菌在脱脂乳中生长速率最快,到达稳定期时活菌数最多,在大豆分离蛋白中次之,其酸度变化情况与生长曲线基本保持一致。
2)就单一功能特性而言,在乳酸菌饮料抗氧化能力方面,以脱脂乳粉为基料的乳酸菌饮料整体抗氧化能力较强;以乳清蛋白粉为基料的乳酸菌饮料,·OH 的清除能力最强;以大豆分离蛋白粉为基料的乳酸菌饮料,整体抗氧化能力较弱。在抑制致病菌方面,以脱脂乳粉、大豆分离蛋白粉为基料的乳酸菌饮料整体抑菌能力较强。就抑制致病菌的种类而言,3 种基料均对大肠杆菌有较强的抑制能力。在降血压能力方面,乳酸菌饮料ACE抑制活性结果为:脱脂乳粉>乳清蛋白粉>大豆分离蛋白粉。
3)对贮藏期内3 种基料乳酸菌饮料的9 项功能特性指标进行主成分分析,提取到3 个主成分反映原变量的信息,通过对其综合得分评价可得:以脱脂乳粉为基料的乳酸菌饮料整体功能特性最强,以大豆分离蛋白粉为基料的乳酸菌饮料整体功能特性较强,以乳清蛋白粉为基料的乳酸菌饮料整体功能特性相对较弱。同时,贮藏时间的变化影响3 种基料乳酸菌饮料的功能特性。
