叶绿素对大鼠肠道菌群的影响
2020-12-01欧雅文李媛媛胡小松廖小军
王 潇 欧雅文 李媛媛 胡小松 廖小军 张 燕
(中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心 北京100083)
近年来,随着社会经济的发展和膳食结构的改变,过多的能量摄入使机体能量平衡遭到破坏,引发肥胖、胰岛素抵抗等问题[1]。为了优化膳食结构,避免高热量饮食带来的负面效应,国内外的膳食指南中都建议饮食多元化,将“深色蔬菜摄入”提到重要的位置,增加果蔬的多样性[2-3]。叶绿素作为自然界中最重要的光合色素,广泛存在于各种绿色蔬菜中,在减轻炎症,调节肠道功能方面具有保护作用[3-4]。在研究花色苷、多酚等物质的生物活性时,发现其能通过调节肠道菌群的组成显著缓解高脂饮食下的体重增加,并且随着肠道菌群研究的兴起,非营养物质成分的生物活性也逐渐被重视起来[5]。叶绿素作为绿色蔬菜中最普遍存在的非营养物质,其生物活性仍停留于早期探索,对其理解十分有限[6]。
成人每天蔬菜的摄入量应达到300~500 g,其中1/3 或1/2 应为绿色或深绿色蔬菜。伴随着绿色蔬菜的摄入,其进入人体的量是可观的。究竟叶绿素进入人体以后会被人体怎样代谢,不得而知。Roca 等[7]培养小肠Caco-2 细胞,证明亲脂性叶绿素铜钠盐 (SCC) 衍生物能被小肠细胞吸收5%~10%,产生的细胞内吸收水平与类胡萝卜素相当,水溶性SCC 衍生物能被吸收45%~60%。虽然吸收量较高,但是在小肠Caco-2 细胞中保留时间较短。Fernández 等[8]将菠菜添加到商业级狗粮中喂养10 d,通过检测小狗外周血液中叶绿素衍生物水平,证明叶绿素衍生物被吸收的显著范围是2.5%~4.0%,平均3.4%,且试验发现叶绿素衍生物在动物体内具有低吸收,快速代谢等特点。目前有关叶绿素在体内代谢位点的研究较少。
基于此,本试验从叶绿素进入动物体内的代谢入手,采用高效液相色谱法(HPLC)测定叶绿素及其衍生物在大鼠各消化器官的代谢情况,对大鼠血液、尿液及粪便中的叶绿素及其衍生物进行定量分析,同时采用16S rDNA 技术分析大鼠肠道微生物组成以及菌群多样性,并对菌群代谢的短链脂肪酸进行定量分析,探讨叶绿素在大鼠体内的生物活性作用。
1 材料与方法
1.1 材料
菠菜(Spinach),购于中国农业大学东校区家属院果蔬市场。
SPF 级SD 大鼠,8 周龄,雌、雄各半,由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2012-0001。动物经3 d 适应性饲养,自由饮水饮食,室温(22±1)℃,湿度(40±10)%,光照周期12 h/12 h。
1.2 主要试剂
甲醇、三氯甲烷、正己烷、乙腈,均为色谱级,美国Thermo Fisher 公司;叶绿素a、b、甲酸、乙酸、丙酸、丁酸、正戊酸、异戊酸、草酸、乳酸、苹果酸、柠檬酸等标品,美国Sigma 公司;95%乙醇、浓硫酸等为分析纯级,北京化学试剂公司。
1.3 仪器与设备
紫外-可见光分光光度计(UV-1800),日本岛津公司;电子分析天平(BT 124S),SARTORIUS 科学仪器有限公司;液相色谱仪(UPLC,Acquity UPLC),美国Agilent 公司;高速冷冻离心机(CR21GIII),日本HITACHI 公司;旋转蒸发仪(T6新世纪),北京普析通用仪器有限责任公司。
1.4 试验方法
1.4.1 叶绿素的制备 叶绿素提取以及浓度测定参考李媛媛[4]、Rivera-Chávez 等[9]方法。本试验所得目标样品质量浓度为7 mg/mL。
1.4.2 叶绿素体内代谢实验 大鼠被灌胃浓缩叶绿素液以1 mL/100 g 计(雌鼠约250 g/只,雄鼠约300 g/只),以灌胃后时间点为0 点,24 h 内在不同时间点(0,0.75,1,2,5,6,8,10,12,16,20,24 h)处死大鼠,每个时间点选取3 只大鼠进行取样(包括胃肠道内容物、血液、尿液及粪便)。以不灌胃叶绿素的3 只大鼠作为空白对照。共选用20 只雌鼠,19 只雄鼠。
胃肠道内容物用甲醇按1 g/3 mL 比例震荡润洗2 min,取润洗液,直接冷冻保存。
取0.25 mL 血液,加0.75 mL 甲醇震荡,以6 000 r/min,4 ℃条件下离心4 min,将离心后的上清液冷冻保存。
取尿液样本1 mL 加入甲醇3 mL,震荡混匀后作为检测样本待测。
粪便样本(检测叶绿素)处理:取1 g 大鼠粪便研磨成粉状,倒入10 mL 离心管中,加入3 mL 甲醇,于振荡器上震荡混匀后静置,待分层后取上清液作为检测样本。
粪便样本(检测SCFA)处理:取1 g 大鼠粪便研磨成粉状,倒入10 mL 离心管中,加入10 mL 流动相(稀硫酸),于振荡器上震荡混匀,以15 000 r/min,4 ℃条件下离心10 min,取离心后的上清液作为检测样本。
1.4.3 叶绿素及其衍生物的测定 参考Teng 等[10]的方法,利用高效液相色谱法(HPLC)测定叶绿素及其衍生物的变化趋势。具体方法如下:分别配制叶绿素a、b 标准品系列浓度梯度,用0.22 μm 水相滤膜过滤,滤液用HPLC 测定。定量分析后绘制标准曲线,用于后续叶绿素及其衍生物含量的计算。HPLC 条件为:低压梯度HPLC 泵,用体积分数75%的乙腈作为流动相A,体积分数12.5%的甲醇作为流动相B,体积分数6% 的三氯甲烷作为流动相C,体积分数6.5%的正己烷作为流动相D。柱温30 ℃,流速1 mL/min。通过与已有叶绿素a、b标品的出峰时间进行比较确定衍生物。波长范围430~660 nm。
1.4.4 短链脂肪酸的测定 采用HPLC 测定有机酸、短链脂肪酸等乳酸菌代谢产物的变化趋势[11]。具体操作参考李媛媛等[4]方法。
1.4.5 肠道菌群丰度及多样性的测定 大鼠被灌胃叶绿素后24 h 内,分别取10,16 h 和24 h 3 个时间点收集粪便,以不灌胃叶绿素的大鼠作为空白对照,每个时间点选用3 只大鼠,共18 只大鼠。
用DNA 提取试剂盒(美国MoBio 公司)提取样本DNA,Onedrop 和琼脂糖凝胶电泳检测DNA纯度和浓度。取适量的样品于离心管中,使用无菌水稀释样品至0.5 ng/μL。以稀释后的基因组DNA 为模板,选用DNA 聚合酶(美国Promega 公司)扩增16S V3-V4 高变区,设计引物515 F:5′-GTGCCAGCMGCCGCGGTAA-3′ 和 806R:5′-GGACTACHVGGGTWTCTAAT-3′[4]。产物c 纯化回收后使用Pico Green 荧光定量以及Agilent 2200 TapeStation 电泳工作平台检测,纯化后的扩增片段在Illumina MiSeqTM 平台上机测序并构建文库,电泳检测文库片段大小为454 bp。利用RDP classifier 对每条序列进行物种分类注释,比对Silva 数据库(比对阈值为70%)。应用Mothur 进行Operational Taxonomic Units(OTUs)划分,以序列相似性97%为依据。
1.5 数据统计及分析
用SPSS Statistics 17.0 软件对试验数据进行统计分析并计算标准偏差,应用方差分析Oneway ANOVA(One-way Analysis of Varance)对数据进行差异显著性分析,显著水平P<0.05 时,差异显著;P>0.05 时,差异不显著。采用Origin 8.0进行数据统计分析并绘图。
2 结果与讨论
2.1 叶绿素及其衍生物在大鼠消化器官的代谢
表1列出叶绿素在大鼠不同器官的代谢情况。给大鼠灌胃叶绿素后,记录时间为0 h。叶绿素在胃部停留约1 h 后进入小肠,约6 h 后由小肠进入大肠,在大肠停留约10 h 后开始从粪便排出。给大鼠灌胃叶绿素后,在胃部酸性条件下,叶绿素a 部分脱镁形成脱镁叶绿素a,且脱植基叶绿素伴随形成,而叶绿素b 相对稳定。由胃进入小肠以及小肠进入大肠过程中,在内容物中检测到叶绿素a、脱镁叶绿素a、叶绿素b,而脱植基叶绿素消失。在粪便中也检测到被排出的叶绿素衍生物,在血液、尿液中没有检测到叶绿素衍生物。在大鼠消化吸收过程中,叶绿素均无新物质产生,而以叶绿素衍生物形式存在。
采用HPLC 定量分析各消化部位内容物中的叶绿素及其衍生物,叶绿素在胃部几乎不吸收,84%进入大肠,其中叶绿素在粪便中的排出量约43%。由此可见,约41%的叶绿素在大肠被代谢。进入大肠的叶绿素是否影响大肠肠道菌群变化,下面对大鼠肠道菌群进行分析。

表1 叶绿素及其衍生物在不同消化部位的检测量(μg/g)Table 1 Detection of chlorophyll and its derivatives in different digestion sites (μg/g)
2.2 叶绿素对大鼠肠道菌群的影响
2.2.1 大鼠粪便样本菌群构成及其丰度 采用16S rDNA 分析大鼠肠道菌群,由于V4 可变区较具代表性,因此分析该区菌群。由表1可知,各样本测序深度指数(覆盖率)达99.3%~99.5%,表明测序结果代表样本的真实情况。ACE 和Chao 1 为样本丰富度指数,反映预估计的OUTs 数;Shannon wiener 和Simpson 为样本多样性指数,反映菌群的复杂程度。根据Mann-Whitney U 检验,Shannon wiener 反映灌胃叶绿素的大鼠菌群多样性显著降低(P<0.05)。叶绿素影响肠道菌群多样性降低,其后果好坏目前尚不知晓,需进一步研究。
2.2.2 群落组成 如图1所示,对测序样品的序列进行比对分析,结果表明:大鼠肠道微生物在门分类水平上主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)组成。
在属水平上,大鼠肠道中丰度较高的菌属主要为变形菌门中的埃希氏-志贺菌属(Escherichia_shigella)、普雷沃菌属 (Prevotella)、小类杆菌(Dialister)、肠球菌属(Enterococcus)、肠杆菌属(unclassified_Enterobacteriaceae),拟杆菌门中的拟杆菌属(Bacteroides)、放线菌门中的双歧杆菌属(Bifidobacterium)、柯林斯菌(Collinsella)。
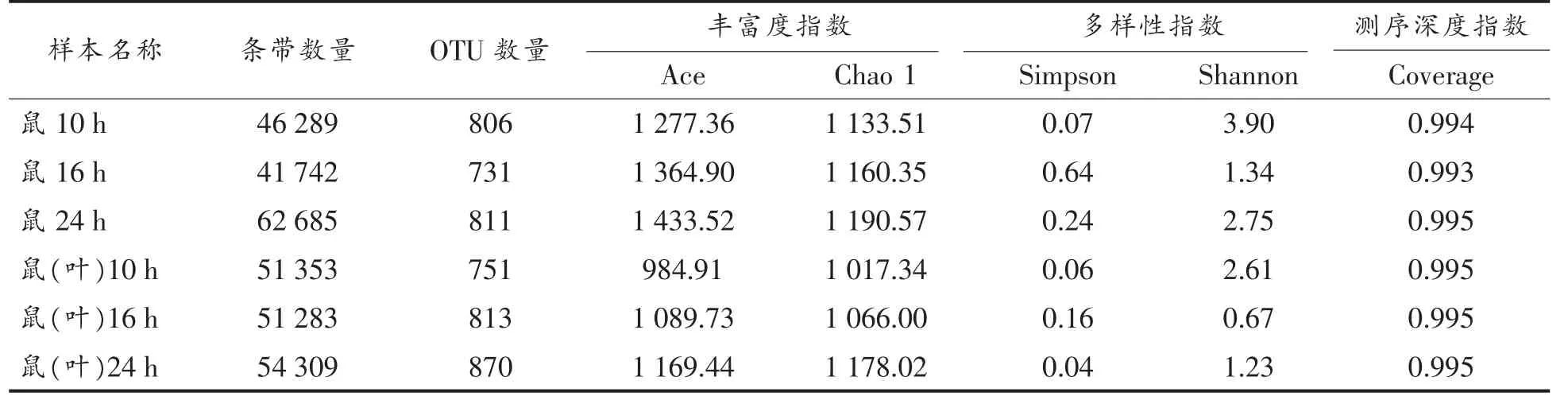
表2 菌群测序深度及多样性Table 2 Sequencing depth and diversity of gut microbiota
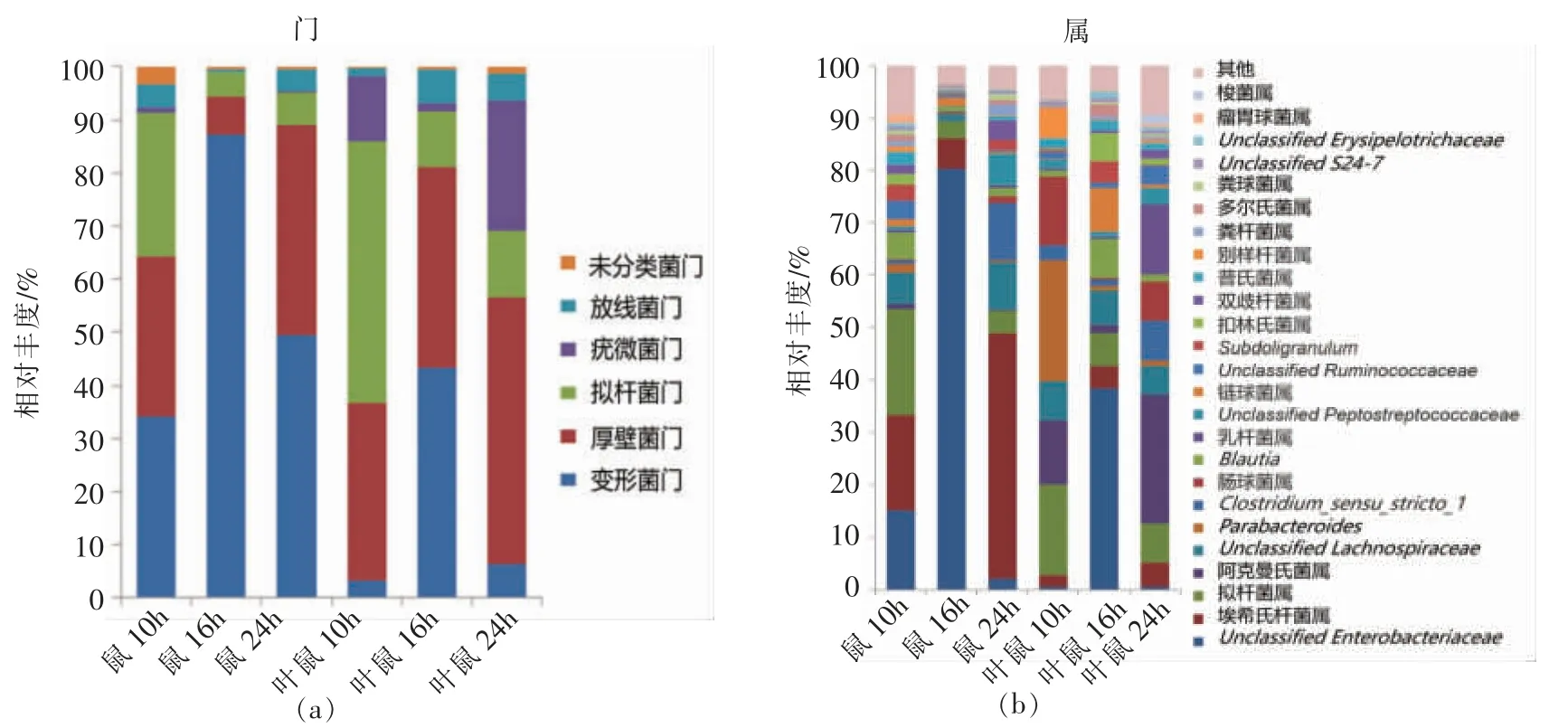
图1 大鼠肠道菌群在门和属水平上的丰度Fig.1 Percent of community abundance on phylum and genus level of gut microbiota in rats
2.2.3 叶绿素对大鼠肠道变形菌门水平的影响据相关研究报道,变形菌门为革兰氏阴性菌门,其中80%以上都是致病菌,会产生较多内毒素,内毒素水平升高造成小肠黏膜上皮细胞壁通透性增强,促进内毒素进入血液,引起内毒素血症及炎症[12],进一步促进肥胖的发生。如图2所示,给大鼠灌胃叶绿素24 h 后,大鼠肠道菌群中变形菌门相对丰度显著下降(P<0.05),由58%降至17%。推测叶绿素通过降低变形菌门相对丰度来降低内毒素水平,这需要进一步研究证明。另外,叶绿素显著降低变形菌门相对丰度的机制尚不清楚。

图2 大鼠肠道中变形菌门相对丰度Fig.2 The relative abundance of Proteobacteria in the rat’s gut
2.2.4 叶绿素对大鼠肠道菌群属水平的影响 图3a 为灌胃叶绿素24 h 后大鼠肠道菌群中阿克曼氏菌属(Akkermansia,简称Akk 菌)丰度的变化。疣微菌门中的Akk 菌属是一类寄居在小肠黏液层具有黏蛋白降解功能的革兰氏阴性菌。在人体肠道中数量虽很少,但与人体的健康密切相关。根据相关文献报道,Akk 菌属水平在肥胖和2 型糖尿病人中比健康人要低,且Akk 菌属直接影响肥胖的发生,将从正常鼠肠道中分离到的Akk 菌属移植到肥胖小鼠肠道中,降低了肥胖小鼠的体重[13]。研究人员还观察到,给肥胖小鼠服用益生元(oligofructose prebiotics),能提高Akk 菌属的相对丰度,促进消化道屏障以及肥胖相关代谢疾病的改善,这些有益作用包括减少脂肪质量增加、脂肪组织炎症以及改善胰岛素耐受[14]。相比于对照组,叶绿素显著提高了疣微菌门中Akk 菌属的丰度(P<0.05),由少于2%提高到13%。有研究用多酚复合物喂食高脂饮食诱导的肥胖小鼠,发现多酚复合物显著提高肥胖小鼠肠道菌属中Akk 菌属的丰度[15],与本试验结果相似。这表明叶绿素可以提高Akk 菌属的水平,从而与炎症、肥胖发生、发展相关,其相互的作用还需进一步验证。
乳酸菌属(Lactobaillus)是生物体肠道中的一类“有益菌”,通过产生乳酸维持肠道较低的pH值,杀死不耐酸的有害菌;同时乳酸的升高,还能降解生物体内的草酸水平,并能促进三羧酸循环,促进糖酵解过程,影响能量代谢[16]。一般乳酸菌属很难在宿主体内定植,因此水平较低。日常生活中通过摄入体外乳酸菌制品来提高体内乳酸菌属的数量,促进人体健康。如图3b 所示,给大鼠灌胃叶绿素24 h 后,其肠道中乳酸菌属丰度显著上升(P<0.05),由1.2%升至4%,表明叶绿素显著影响乳酸菌属丰度,这可能是叶绿素对宿主产生健康作用的一种方式,间接促进宿主的健康发展。
双歧杆菌属(Bifidobacterium)具有多种益生功能,可缓解乳糖不耐症状,改善因免疫系统紊乱而导致的肠炎,通过菌膜屏障分泌抗菌肽抑制病原菌入侵肠道等[17]。本试验结果如图3c 所示,大鼠在灌胃叶绿素24 h 后,双歧菌属丰度显著下降,由3.7%降至1.8%,说明叶绿素促进双歧菌属丰度的下降,具体原因尚不清楚。
2.3 叶绿素对大鼠肠道菌群代谢物的影响
灌胃叶绿素24 h 后,大鼠粪便中乙酸、丙酸水平的变化如图4所示。由图4a 可知,灌胃叶绿素24 h 后的大鼠菌群产生乙酸水平显著升高(P<0.05),在24 h 达到最大值0.25 μg/mL。图4b 所示,丙酸水平在5~10 h 内缓慢下降,15 h 后保持上升的趋势,并在24 h 时达到最大值1.8 μg/mL。SCFA 为肠道菌群的代谢产物,不同的SCFA 具有不同的生理活性作用,如乙酸、丁酸的抗菌、抗癌作用,丙酸为糖异生的底物,且能为肠上皮细胞提供能量[18]。大鼠摄入叶绿素后,粪便中乙酸、丙酸含量升高,可能是由产这两种短链脂肪酸的肠道微生物引起的[4],如乳酸菌属。本试验中对大鼠菌群测序,乳酸菌属丰度有所上升。从侧面说明叶绿素可能通过影响菌群或其代谢产物来促进宿主的健康发展。

图3 大鼠肠道中Akk 菌属、乳酸菌属、双歧杆菌属相对丰度Fig.3 The relative abundance of Akkermansia,Lactobaillus and Bifidobacterium in the rat’s gut
三羧酸循环(TCA)作为生物体内非常重要的代谢途径之一,是三大营养素(糖类、脂肪和氨基酸) 的最终分解代谢通路。柠檬酸作为有机酸之一,在人体中主要参与TCA 循环,研究发现在酵母培养中添加柠檬酸,对琥珀酸、苹果酸和酒石酸的代谢均能产生一定的影响[19]。图4c 所示为大鼠粪便24 h 时柠檬酸水平的变化,可以看出叶绿素能显著提高大鼠粪便中柠檬酸水平 (P<0.05),且在15 h 后表现出显著性差异。柠檬酸水平升高,可能是叶绿素进入大鼠体内后,提高了糖、脂肪或氨基酸的代谢,促进TCA 循环,使得作为TCA 循环的中间产物——柠檬酸水平提高,同时说明叶绿素能有效提高生物体的代谢。
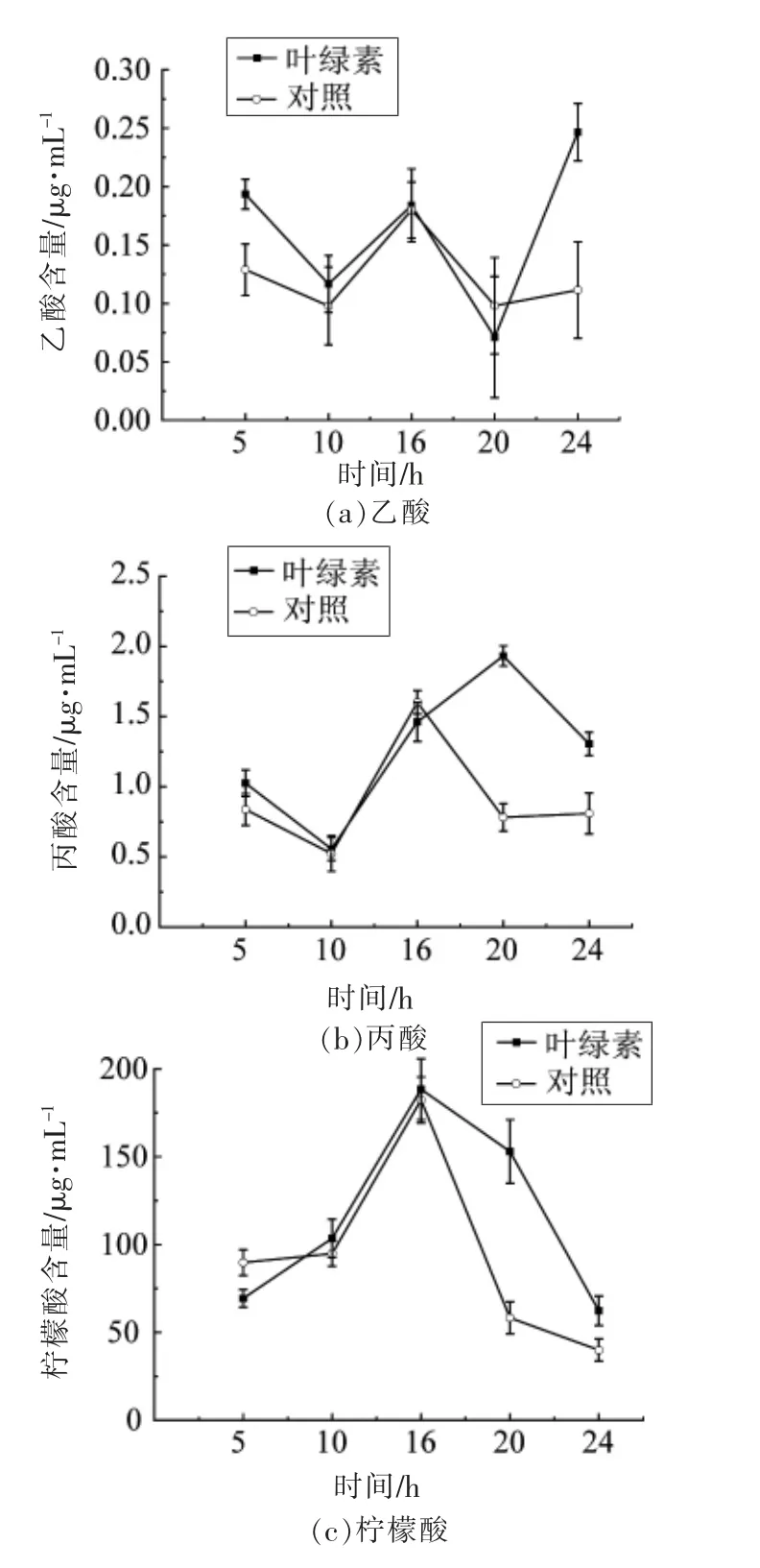
图4 乙酸、丙酸、柠檬酸水平变化(大鼠)Fig.4 Changes of acetic acid,propionic acid and citric acid in rats
3 结论
通过给大鼠灌胃叶绿素,探究叶绿素在大鼠体内的生物代谢及对肠道菌群的影响,以此来阐明叶绿素实现生物活性的可能机制。叶绿素进入胃后,在酸性条件下,部分叶绿素a 会立刻降解为脱镁叶绿素a,叶绿素b 则较稳定,并有少量脱植基叶绿素生成。叶绿素在大鼠胃部几乎没有吸收,进入大肠的量约84%,其中从粪便中排出量约为43%,而在血液、尿液中检测不到叶绿素含量。叶绿素在门水平上显著降低变形菌门相对丰度(P<0.05),在属水平上促进阿克曼氏菌属、乳酸菌属丰度上升(P<0.05),双歧菌属丰度下降(P<0.05)。检测菌群代谢物中,叶绿素能够提高肠道菌群代谢物乙酸、丙酸及柠檬酸水平。
