一种新型离子液体对L-缬氨酸发酵的影响
2020-12-01刘景阳刘云鹏徐庆阳
刘景阳,刘云鹏,徐庆阳,陈 宁
(天津科技大学 生物工程学院,天津 300457)
L-缬氨酸与L-亮氨酸、L-异亮氨酸合称为支链氨基酸,是人体和动物体必需氨基酸,是蛋白质合成原料,同时还具有特殊的生理和生物学功能,也可以用作生物体能源[1]。目前,L-缬氨酸主要应用于医药、饲料、洗涤剂和除草剂等领域[2-4],由于应用领域范围广,其需求量日益增长。L-缬氨酸获取的途径主要有蛋白质水解提取法、酶催化法、微生物发酵法以及化学合成法[5]。由于微生物发酵法有原料便宜、反应条件温和及环境友好等优点,已成为L-缬氨酸大规模生产的主要方法。离子液体在许多领域都有应用,如生物催化[6]、润滑[7]、电化学[8]、生物柴油的生产和纯化[9]、脂肪族和芳香族的分离[10]等。
低熔点共熔溶剂(DESs)是一种新型的离子液体,成本低廉,对环境友好,可生物降解,其组成成分广泛存在于自然界中,便于制备[11]。因此,研究人员对于DESs在生物催化中的应用产生了极大的兴趣[12]。同时,在生物催化中,低熔点共熔溶剂可在酶不失活的情况下,能够增加底物的溶解性,促进生物代谢途径中关键酶催化反应,提升生产目标产物的产量[13]。DESs可通过将两个价格低廉、易于获取和可生物降解的组分,经简单的混合,形成低熔点共熔溶剂[14]。最普遍用于形成低熔点共熔溶剂的季铵盐如氯化胆碱(ChCl)[15-16],与其结合的氢供体如尿素(U)、可再生的羧酸(草酸、柠檬酸、琥珀酸或者氨基酸)和可再生的多元醇(甘油、糖类)[17-18]。目前关于离子液体对L-缬氨酸生产菌的研究较少,笔者为此优化了离子液体的添加体积分数及添加时机,同时研究了离子液体的添加对L-缬氨酸生产菌的生长、耗糖及产酸影响,为提高L-缬氨酸产量提供了新思路。
1 材料与方法
1.1 材 料
1.1.1 菌 种
BrevibacteriumflavumXV0505(Leu-+Ile-+2-TAr+α-ABr+SGr),天津科技大学代谢工程研究室保藏菌种。
1.1.2 主要试剂
氯化胆碱、尿素、L-亮氨酸和L-异亮氨酸均购自上海生物工程股份有限公司,蛋白胨、酵母粉和牛肉膏均购自北京奥博星生物技术股份有限公司,其他分析纯化学试剂购自国药集团化学试剂有限公司。
1.1.3 溶液配制
培养基配制详见文献[19]。
离子液体的配制:准确称取一定量的氯化胆碱和尿素,使m(氯化胆碱)∶m(尿素)=1∶2,置于圆底烧瓶混合均匀,100 ℃油浴中搅拌加热3 h,形成透明、均一的液体后,室温冷却备用。
1.2 主要仪器及设备
5 L和30 L全自动发酵罐,上海保兴生物设备工程公司;SBA-40C生物传感仪,山东科学院生物研究所;pH电极、溶氧电极,METTLER TOLEDO;LC20AT高效液相色谱仪,日本Shimadzu公司;TU 1810紫外可见分光光度计,北京普析通用仪器;FA2204B电子天平,上海精密科学仪器有限公司。
1.3 方 法
1.3.1 培养方法
菌种活化:将斜面保藏菌种采用划线的方法接种于活化斜面上,于32 ℃恒温静置培养24 h。
种子培养:将活化斜面上生长状况良好的菌种取一环接种至30 mL种子培养基中,200 r/min,32 ℃振荡培养15~18 h。
摇瓶培养:将生长好的种子液按体积分数10%的接种量接入发酵培养基中,200 r/min,32 ℃恒温振荡培养72 h,pH控制在7.0±0.05。
发酵罐培养:将生长好的种子液按体积分数10%的接种量接入30 L发酵罐中,通风量1 m3/h,搅拌转速300~600 r/min,培养温度32 ℃,pH控制在7.0±0.05。
1.3.2 分析方法
菌体量测定:每隔4 h取适量发酵液,用灭菌生理盐水稀释至适当倍数,通过分光光度计测定600 nm波长下吸光度。
溶氧及pH测定:在线电极测定。
葡萄糖质量浓度测定:取适量发酵液,12 000 r/min离心5 min,取上清液稀释至适当倍数,用生物传感仪测定。
L-缬氨酸质量浓度测定:用高效液相色谱法分析测定,详见文献[20]。
1.3.3 数据分析
所有试验数据取3次实验的平均值。单因素方差分析之后Dunnett检验来确定数据差异的显著性,P<0.05表示显著。
2 结果与讨论
2.1 L-缬氨酸生产菌XV0505的生长曲线的测定
采用摇瓶发酵方式,将生长好的种子液按体积分数10%的接种量接入发酵培养基中,200 r/min,32 ℃恒温振荡培养72 h,pH控制在7.0±0.05,每隔4 h测定菌体量OD600,绘制XV0505的生长曲线,结果如图1所示。
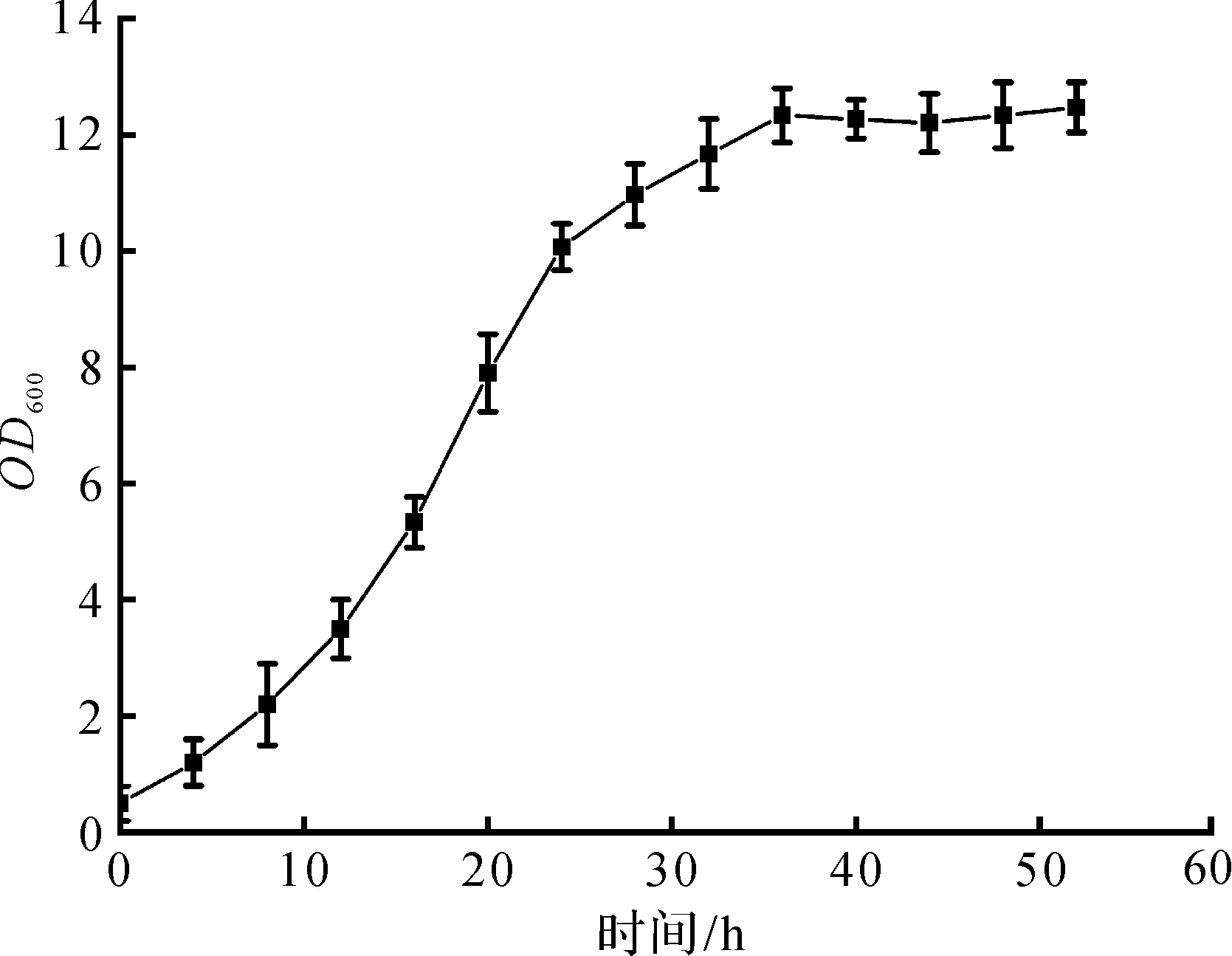
图1 黄色短杆菌XV505菌体生长曲线Fig.1 Growth curve of B. flavum XV505 in shake flask
从图1中可以看出:L-缬氨酸生产菌XV0505在0~8 h,生长较为缓慢,为菌体生长延滞期;12~24 h,生长迅速,为菌体生长对数期;32 h后,OD600没有显著提升,进入生长稳定期;发酵52 h,菌体量OD600达到了12.5,L-缬氨酸产量为24.3 g/L。
2.2 离子液体添加时机及体积分数对摇瓶分批发酵XV0505产L-缬氨酸的影响
根据摇瓶发酵XV0505的生长曲线,选取3个不同生长期即延滞期4 h、对数期16 h和稳定期32 h,添加不同体积分数离子液体0.05%,0.1%,0.15%,0.2%进行分批发酵。空白对照组为不添加离子液体,添加0.05%,0.1%,0.15%,0.2%的无菌生理盐水。XV0505发酵培养52 h,测定发酵液中L-缬氨酸的产量,结果如图2所示。在菌体生长延滞期,添加不同体积分数的离子液体,对菌体产L-缬氨酸的能力有一定的抑制作用,表现为L-缬氨酸的产量较空白对照均降低,且添加离子液体的体积分数越高,L-缬氨酸产量越低。添加离子液体的体积分数为0.05%时,L-缬氨酸的产量为对照组的86.4%;添加离子液体的体积分数为0.2%时,L-缬氨酸的产量仅为对照组的65.4%。在菌体生长对数期,添加不同体积分数的离子液体,能够促进菌体生产L-缬氨酸。离子液体添加体积分数为0.1%时,XV0505积累L-缬氨酸产量最高为28.8 g/L,较对照组提高了18.5%。在菌体生长稳定期,离子液体的添加对XV0505生产L-缬氨酸的影响不显著。
2.3 添加离子液体对分批补料发酵菌体生长的影响
选取摇瓶发酵最佳的离子液体添加体积分数及时机,即发酵16 h,添加离子液体体积分数为0.1%。将生长好的种子液按10%的接种量接入30 L发酵罐中,通风量控制在1 m3/h,搅拌转速控制在300~600 r/min,培养温度32 ℃,pH控制在7.0±0.05,在此水平下研究离子液体添加对L-缬氨酸生产菌生长的影响,结果如图3所示,其中对照组添加体积分数0.1%的等体积无菌生理盐水。在菌体生长对数期,添加离子液体,可以使菌体快速的生长,进入稳定期的时间大约提前了4 h,最终菌体量较对照组提高了3.8%。
2.4 添加离子液体对分批补料发酵XV0505糖消耗速率的影响
在分批补料发酵过程中,底糖质量浓度为80 g/L,当发酵液中糖质量浓度低于10 g/L时,开始脉冲流加补糖,维持发酵液动态糖质量浓度为10 g/L[21]。离子液体的添加对XV0505发酵糖消耗速率的影响如图4所示。在16 h添加0.1%离子液体后,XV0505生长旺盛,耗糖速率加快,在发酵20~44 h阶段,耗糖速率均高于对照组。XV0505发酵24 h耗糖速率达到峰值为9.8 g/(L·h),较对照组提高了7.7%。
2.5 添加离子液体对分批补料发酵XV0505产L-缬氨酸的影响
在分批补料发酵过程中,每间隔4 h测定一次发酵液中L-缬氨酸产量,结果如图5所示。从图5中可以看出:在发酵前期,菌体生产L-缬氨酸速率较低;发酵中期,L-缬氨酸产率快速升高,发酵后期,L-缬氨酸产率逐渐降低。在发酵16 h时,添加离子液体能显著增加L-缬氨酸的产量。在发酵终点,对照组能积累L-缬氨酸产量66.1 g/L,添加离子液体的实验组则能积累L-缬氨酸产量73.0 g/L,提高了10.4%。从文献报道来看[19],利用黄色短杆菌XV0505进行L-缬氨酸发酵,产量能达到59.12 g/L,与其相比,L-缬氨酸积累能力提高了23.4%。可进一步计算得对照组的糖酸转化率为25.3%,而添加离子液体的糖酸转化率为26.7%,提高了5.5%。
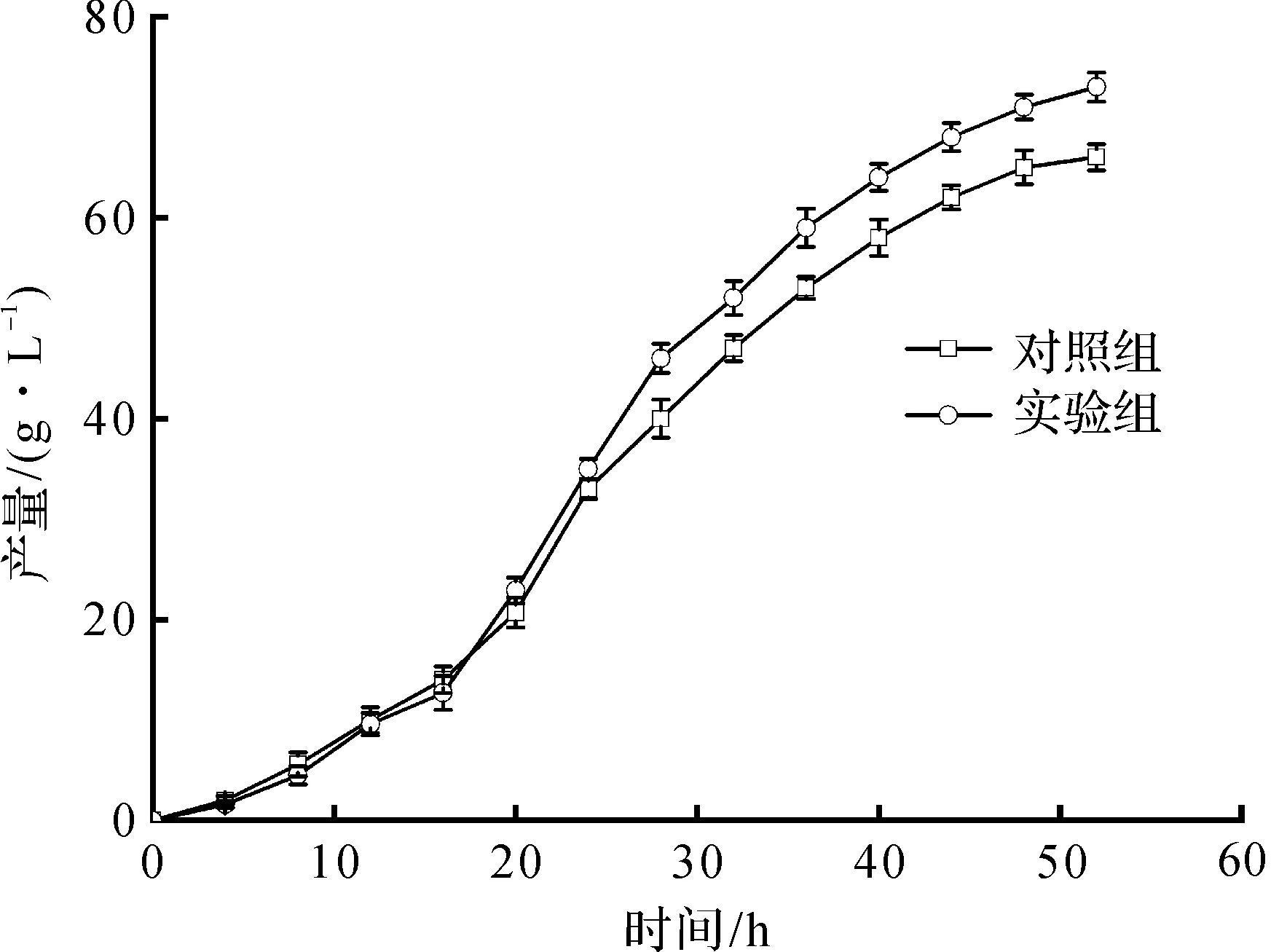
图5 添加对XV0505产L-缬氨酸产量的影响Fig.5 Effect of addition on L-valine yield by XV0505 in fed-batch fermentation
L-缬氨酸产量增加的主要原因有:1) 离子液体加快了菌体的生长,使得菌体的生物量更早达到峰值,在单位菌体L-缬氨酸产量不变的前提下,菌体量得到提高,则L-缬氨酸单位时间内产酸量必然增加;2) 添加离子液体能够使菌体内各种酶以及生物大分子的活性增强,从而使得耗糖速率增加,在发酵后期菌体总量一致的前提下,单位菌体单位时间耗糖速率增大,势必导致L-缬氨酸产量的增加。
3 结 论
低熔点共熔溶剂作为一种新型离子液体,在生物催化领域具有广泛应用,具有改变简单节杆菌细胞膜通透性,调节胞内代谢水平等功能。笔者以L-缬氨酸生产菌XV0505为研究对象,研究了按比例配置的氯化胆碱与尿素离子液体的添加对XV0505生长、耗糖和产酸的影响。通过摇瓶发酵,优化了离子液体的添加时机和添加的体积分数,在菌体生长发酵16 h时,添加0.1%的离子液体,XV0505积累L-缬氨酸量最高,较对照组提高18.5%。在分批补料发酵中,发酵16 h,加入0.1%的离子液体,能显著促进菌体生长,提高糖的消耗速率,最终L-缬氨酸的产量提高了10.4%,糖酸转化率提高了5.5%。
