重组葡激酶对小型猪冠脉血栓的溶栓作用研究*
2020-11-30方晓兰李克强周松辉胡道奇吴刚强王太林李卫平
李 光,方晓兰,任 仲,李克强,周松辉,胡道奇,吴刚强,王太林,李卫平△
(1.岳阳职业技术学院,岳阳 414000; 2.湖南康润药业股份有限公司,岳阳 414000)
心、脑血管病的血栓形成及合并症是引起老年人死亡和致残的一个主要原因,溶栓治疗对诸如急性心肌梗塞、脑栓塞及静脉栓塞等严重威胁生命的疾病会产生有益的影响。目前临床使用的溶栓药如重组链激酶(recombinant streptokinase, r-SK)、重组组织型纤溶酶原激活剂(recombinant ateplase,rt-Pa)均为纤溶酶原激活剂,它们能转化血液纤溶系统中无活性纤溶酶原为纤溶酶,纤溶酶溶解血栓中的纤维蛋白,产生溶栓作用。但纤维蛋白非特异性溶栓药溶解纤维蛋白同时,也可以激活凝血系统中正常成分如纤维蛋白原、凝血因子V及凝血因子VII等其它血浆蛋白,引起出血倾向,因此具有强效及纤维蛋白特异性的纤溶酶原激活剂是较理想的溶栓药。葡激酶具有此特点,它以间接作用方式激活纤溶酶原,比常用的溶栓剂链激酶溶栓速度快、效力强,出血副反应较少[1]。但是葡激酶为异源蛋白,故其免疫原性比rt-Pa强。本研究基于自主研发的重组葡激酶,考察重组葡激酶对于小型猪冠脉血栓形成模型的溶栓效果,为重组葡激酶应用于心肌梗死的临床治疗提供依据。
1 材料与方法
1.1 试剂、样品与仪器
受试药:注射用重组葡激酶(recombinant staphylokinase,r-SAK),湖南康润药业股份有限公司实验室制备。白色絮状固体,纯度 98.36%,规格为每瓶 5、10、30 mg(106IU),比活性为4.6×104AU·mg-1。临用前用无菌注射用水溶解,并用生理盐水稀释至所需浓度。阳性对照药:重组链激酶(recombinant streptokinase,r-SK),上海实业医大生物技术有限公司生产。无菌、白色冻干粉末,每瓶5 mg(5×105IU)。临用前用无菌注射用水溶解,并用生理盐水稀释至所需浓度。溶剂对照:本研究室提供,白色絮状固体。不含重组葡激酶,其组分(甘露醇1.2%,0.1 mol·L-1NaCl,0.02 moL·L-1PB,pH=7.6)与制剂相同。临用前用无菌注射用水溶解,并用生理盐水稀释至所需浓度。金黄色葡萄球菌,湖南康润药业股份有限公司质量部保存。实验前用新鲜培养基培养,70℃灭活,稀释成每毫升约含 50 亿个细菌的菌液,4℃冷藏保存备用。血浆纤维蛋白原定量试剂盒,上海美旋生物科技有限公司。其它试剂均为市售。RM-6300多导生理记录仪,日本光电公司产品,RTA-1100M四导热阵记录仪,日本光电公司产品,MFV-3200电磁血液流量计,日本光电公司产品,SC-3电动呼吸机,上海医疗器械厂生产,722-2光栅分光光度计,上海第三分析仪器厂生产,DDB-300多通道电子蠕动泵,浙江象山石浦海天电子仪器厂。
1.2 手术过程及模型制备
实验前动物禁食12 h,自由饮水,实验当天静脉注射3%戊巴比妥钠(20 mg·kg-1)和肌注氯氨酮(10 mg·kg-1)混和麻醉,并静注戊巴比妥钠维持麻醉。动物仰卧位固定于手术台上,气管插管,连接SC-3型电动呼吸机,行人工正压呼吸;分离右颈总动脉,插入充满 0.5% 肝素的塑料管,连于TP-400T压力换能器上,经AP-641G血压放大器,测量收缩压(stolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)及平均动脉压(mean arterial blood pressure,MABP);分离左股静脉,插管作给药、补液及取血用。
于第4肋间开胸,暴露心脏,剪开心包,做心包床;分离左冠状动脉前降支下1/3部位一段血管,约 1 cm,将弯曲成 90° 的4#皮下注射针头刺入上述冠脉,进入血管腔约4 mm,并保持与血管内膜接触,固定,经连线接9 V干电池的正极,负极置于动物皮下,以便形成环路,为了最大限度地减少漏电,除与冠脉接触部位的电极外,电极其他部分及连线均进行绝缘处理;左心室拟缺血区心外膜表面放置20个标测点心外膜电极,经AB-621G生物电放大器标测心外膜心电图;四肢插入针状电极,经AC-601G心电放大器,测量Ⅱ导联心电图(ECGⅡ)。
上述诸指标同步记录于RM-6300多导生理记录仪上。手术完毕待各项指标稳定后,记录一次,作为血栓形成前的正常值。而后开始接通直流电,电流强度为150 μA,一般于通电后约40 min,心外膜电图ST段开始抬高,再刺激5 min,若心外膜电图ST段不降低,即切断电源,认为冠脉血栓已形成。
为了防止血栓形成或再通后的室颤,整个实验过程中输注0.02%盐酸利多卡因生理盐水溶液。
1.3 实验分组及给药方案
30只小型猪分成5组(溶剂对照组、阳性药物对照组(r-SK,4 mg·kg-1)、受试药物高剂量组(r-SAK,4 mg·kg-1)、受试药物中剂量组(r-SAK,2 mg·kg-1)、受试药物低剂量组(r-SAK,1 mg·kg-1)),每组6只,在冠脉血栓形成30 min后开始静脉给药,采用先推注,随后用蠕动泵恒速输注的方式给予不同的药物。溶剂对照组静脉溶剂对照液,阳性药对照组静脉给予重组链激酶,受试物各组分别静脉给予不同剂量的重组葡激酶。静脉推注体积为5 ml,1 min内注毕,输注速度为0.5 ml·min-1,60 min内输毕。120 min后放血处死动物。于给药前及给药后30、60、120 min取静脉血,实验结束后取血栓形成部位的冠脉血管段,分别检测优球蛋白溶解时间、血纤维蛋白原含量、纤维蛋白(原)降解产物和伤口出血量,检测冠脉血栓溶解率、心肌缺血程度及缺血范围。
1.4 冠脉血栓溶解测定
实验结束后,取血栓形成部位的冠脉血管段,10%福尔马林液固定后,石蜡包埋,以电极刺入点为起点,间隔 1 mm,横向连续切成5片,HE染色,显微镜下采用落点求积法计算血栓占管腔百分数。
1.5 心肌缺血程度及缺血范围的测定
记录冠脉血栓形成前,给药前及给药后15、30、45、60、90、120 min时20个标测点的心外膜电图。计算20个点的ST段抬高之和(ΣST),作为心肌缺血程度;以ST段升高2 mV以上作为缺血标准,计算缺血点数(NST),作为心肌缺血范围。
实验结束后,取出心脏,用生理盐水洗去血液。主动脉及血栓形成处以下左前支冠脉插管,主动脉用伊文斯蓝(1 mg·ml-1)进行逆行冠脉灌注,LDA 冠脉用磷酸盐缓冲液同时进行灌注,上述双向灌注的压力均为 80 mmHg,5 min后,停止灌注,将血栓形成部位以下的左室,垂直于前降支均匀切成 5 片,将染色心肌投射描记在透明胶片上,以确定心肌的危险区;然后,常温下1%TTC 染色15 min,投射描记在透明胶片上,以确定梗死区;计算梗死区占心肌百分数及梗死区占危险区百分数。
1.6 优球蛋白溶解时间的测定
用3.8% 柠檬酸钠按1∶9抗凝,3 000 r/min冷冻离心10 min,分离血浆。取0.5 ml血浆加入9 ml冰冻蒸馏水中,用1%醋酸调 pH 值至4.5,3 000 r/min冷冻离心5 min,弃去上清液,沉淀用0.5 ml硼砂缓冲液(pH 8.0)溶解后,37℃温育 2 min 后,再加入 1/40 mol·L-1CaCl20.5 ml,凝固后,置37℃水浴中观察并记录优球蛋白溶解时间。
1.7 纤维蛋白原含量测定
于给药前及给药后30、60、120 min(实验结束时)取 0.1 ml按1.6中描述的方法制备的血浆,加入4 ml的血浆纤维蛋白原测定试剂,混匀后置室温15 min,按单一试剂比浊法,于370 nm处测定其光密度,以纤维蛋白原标准管制作标准曲线,计算血浆纤维蛋白原含量。
1.8 纤维蛋白(原)降解产物测定
同时于上述各时间点取血1 ml,37℃下温育2 h,4 000 r/min离心分离血清,取血清0.1 ml用生理盐水等倍连续稀释4~5管,然后各管中加入金黄色葡萄球菌液0.05 ml,振荡器上振荡(180~200 次·min-1)2 min,每管再加入0.5 ml生理盐水,室温静置30 min 后,手术灯下观察,找出产生猬集现象的最高稀释管,根据纤维蛋白原标准管的滴度绘制标准曲线,计算纤维蛋白(原)降解产物含量。
1.9 伤口出血量的测定
分别于给药前及开始给药后30、60、120 min,于腹前外侧部沿肌肉方向切开腹外斜肌,长4 cm,用预先称重的纱布吸取自伤口流出的血液,5 min后称重,计算出血量。
1.10 统计学处理
2 结果
2.1 对电刺激引起的冠脉血栓的溶解作用
给药后,溶剂对照组残存血栓基本堵塞整个血管。与溶剂对照组相比,r-SK组残存血栓平均减少34.5%;r-SAK高、中、低3个剂量组分别减少 71.9%、56.6%、34.0%(P<0.05)。与r-SK组相比,r-SAK高、中2个剂量组,最大血栓面积分别减少 34.3%、15.4%(P<0.05)。SAK高剂量组比中剂量组残存血栓平均减少37.1%,SAK中剂量组又比低剂量组减少32.5%(P<0.05)。上述结果表明r-SAK对电刺激引起的冠脉血栓较r-SK具有更强的溶栓作用(表1)。
溶剂对照组6只动物中,残存血栓最大面积占血管腔面积的比值小于70%的动物数为 0/6,r-SK 组为4/6,r-SAK高、中、低3个剂量组分别为6/6、5/6、3/6,结果未列表。
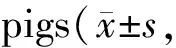
Tab. 1 Effects of recombinant staphylokinase on electrical stimulation induced coronary thrombosis in miniature n=6)
2.2 对心肌梗塞程度及范围的影响
溶剂对照组6只动物在整个实验过程中心肌缺血程度(∑ST)及缺血范围(NST)有逐步减轻的趋势,但与给药前比较无明显差异。r-SK组在给药后30~60 min间有3/6只动物抬高的心外膜电图ST段突然迅速增加,可能是由于血栓溶解后,心肌缺血/再灌注所致心肌再损伤引起的,而后∑ST及NST的降低较溶剂对照组更明显,与给药前比较有明显差异。r-SAK高、中及低剂量组分别有5/6、4/6和2/6只动物于给药后20~60 min出现上述现象。之后∑ST及NST较给药前明显降低,表明r-SAK能减轻心肌缺血程度,缩小缺血范围,结果未列表。
心脏TTC染色结果表明,溶剂对照组其梗死区占左室的11.4%。r-SK组及r-SAK高、中、低3个剂量组梗死范围均明显减轻(P<0.01~0.001),分别较对照组降低66.7%、70.2%、59.0%、31.6%(P<0.05)。SAK高剂量组比中剂量组梗死范围平均减少30.6%,SAK中剂量组又比低剂量组减少 37.2%(P<0.05)r-SAK与等剂量的r-SK作用相似(表2)。
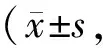
Tab. 2 Effects of recombinant staphylokinase on the extent of myocardial infarction induced by electrical stimulation in miniature pigs n=6)
2.3 对小型猪生化参数的影响
2.3.1 对优球蛋白溶解时间(ELT)的影响 溶剂对照组给药后 ELT波动不大。r-SK 组给药后 ELT 明显缩短,给药后30、60、120 min分别缩短26.1%(P<0.01)、29.3%(P<0.05)、38.8%(P<0.05)。r-SAK高、中、低3个剂量组给药后ELT均明显缩短,高、中、低3个剂量组给药后 30 min分别缩短 66.7%(P<0.01)、51.0%(P<0.01)、27.8%(P< 0.05),60 min分别缩短76.9%(P<0.01)、56.3%(P<0.01)、24.7%(P>0.05),120 min分别缩短 62.0%(P<0.01)、52.2%(P<0.01)、21.1%(P> 0.05)。与等剂量的r-SK相比,r-SAK组 ELT 缩短更明显(表3)。
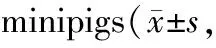
Tab. 3 Effects of recombinant staphylokinase on the dissolution time of euglobulin in n=6)
2.3.2 对纤维蛋白原(Fbg)及纤维蛋白(原)降解产物(FDP)的影响 溶剂对照组整个实验过程中Fbg波动不大。r-SK组给药后4/6只动物Fbg降解超过20%。r-SAK高、中、低3个剂量组给药后6只动物中分别有1/6、2/6、0/6只Fbg降解超过20%,其它动物未见明显下降,表明r-SAK较r-SK具有更高的纤维蛋白专一性(表4)。
溶剂对照组在整个实验过程中,其 FDP 无明显变化。与溶剂对照组相比,r-SK组及r-SAK 高、中、低3个剂量组给药后 FDP 均明显升高;而r-SK组比r-SAK高剂量(4 mg·kg-1)组 FDP 增加更明显,可能因血浆纤维蛋白原降解而引起(表5)。
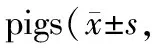
Tab. 4 Effects of recombinant staphylokinase on plasma fibrinogen content in miniature n=6)
Tab. 5 Effects of recombinant staphylokinase on degradation products of fibrin(proto)in miniature n=6)
2.4 对伤口失血量的影响
溶剂对照组整个实验过程中出血量无明显改变。r-SK组6只动物给药后出血量均有不同程度增加,其中有4只动物出血量增加超过给药前1倍以上;而r-SAK高、中、低剂量组给药后6只动物中分别有1/6、2/6、1/6只伤口出血量增加超过给药前1倍以上;表明r-SAK较r-SK引起的出血副反应少(表6)。

Tab. 6 Effects of recombinant staphylokinase on the amount of wound bleeding in miniature n=6)
2.5 对小型猪血压及心率的影响
静脉给予上述剂量的r-SAk及重组链激酶对小型猪血压及心率无明显影响。结果未附表。
3 讨论
目前公认的血栓形成有三个条件: 即血管内皮细胞损伤、血流状态的改变以及血液凝固性的增加。可以用注射角叉菜胶诱发血栓形成或者手术结扎等方式形成血栓[2-3],正常循环血液中的血小板表面带净负电荷,而完整血管内皮细胞层亦带负电荷,因此血小板被内皮层排斥,在血管内壁没有血小板附着。本试验应用阳性电流作用于血管,在直流电作用下引起血管内皮损伤,使血管内皮层下胶原及其它致血栓原成分(如组织因子)暴露,引起血小板大量激活及粘附,释放凝血酶等物质,使纤维蛋白原转变成纤维蛋白,形成网状结构,导致红细胞沉积,形成与临床上急性心肌梗塞患者血栓组成相似的冠脉血栓。试验动物于给药后20~60 min出现心外膜电图ST段在给药后某一时间段进一步升高,可能是由于栓塞的冠脉血管恢复再灌注后,大量氧自由基释放,导致心肌出现短暂进一步再损伤所致,这和临床上AMI经溶栓后出现的暂时心律失常和ECG改变一致,说明猪冠脉实验结果较为可靠,一定程度上能反映溶栓药的临床疗效。
本研究利用上述原理形成冠脉血栓模型,溶剂对照组6只动物经组织学观察证明经热损伤的冠脉均充满血栓,静脉给予重组葡激酶后血栓明显缩小,数据表明r-SAK对电刺激引起的冠脉血栓较r-SK具有更强的溶栓作用。r-SAK高、中及低剂量组分别有5/6、4/6和2/6只动物心肌缺血程度(ST)及缺血范围(NST)较给药前明显降低,表明r-SAK能减轻心肌缺血程度,缩小缺血范围。优球蛋白部分含有纤维蛋白原,血浆素原及活化素,优球蛋白溶解时间缩短表示活化素增高,纤溶活性增强,数据表明r-SAK的优球蛋白溶解时间比r-SK更短。r-SAK高、中、低3个剂量组给药后6只动物中分别有1/6、2/6、0/6只动物的纤维蛋白原降解超过20%,其它动物未见明显下降,而r-SK有4/6只超过而r-SK组比r-SAK高剂量(4 mg·kg-1)组 纤维蛋白原降解产物增加更明显,可能因血浆纤维蛋白原降解而引起,表明r-SAK比r-SK具有更高的纤维蛋白专一性,动物给药后出血量的比较也证明了这一点。
葡激酶(staphylokinase,SAK)是溶原性金黄色葡萄球菌分泌的一种蛋白,具有较强的纤溶酶原激活作用。与链激酶结合纤溶酶原不同,当葡激酶被加至含有血纤维蛋白凝块的人血浆中时,同血浆中血纤溶酶原反应很弱,只同血块表面痕量存在的血纤溶酶发生高亲和力反应,变成血纤溶酶·葡激酶复合物,有效地在血块表面激活血纤溶酶原成血纤溶酶,因而不受α2-抗血纤溶酶的抑制。然而,血纤溶酶·葡激酶复合物或血纤溶酶,从血块释放出来或在血浆中产生时,则被α2-抗纤溶酶迅速抑制。因而,限制了纤溶酶原对血栓的激活过程,防止血浆中血纤溶酶过量产生以及α2-抗血纤溶酶的耗竭乃至纤维蛋白原的降解[4]。国外的临床研究表明与溶栓药物t-PA相比,葡激酶疗效相当,对纤维蛋白的选择性高于t-PA,出血倾向更低[5-6]。另外SAK对溶解富含血小板的血栓同样有效,这也是优于t-PA和SK的方面。而且SAK的溶栓作用并不影响循环中纤维蛋白原和纤溶酶原及α2抗纤溶酶的水平。葡激酶、纤溶酶原、纤溶酶、α2-抗纤溶酶以及纤维蛋白之间的这些分子的相互作用,赋予葡激酶分子在血浆环境中一种独特的纤维蛋白选择性机制即纤维蛋白特异性。因此SAK是一个血纤维蛋白专一性的纤溶酶原激活剂,应用于临床减少了系统激活和出血副作用,是一个比较理想的纤溶酶原激活剂。文献报道r-SAK与t-PA联合使用溶栓效果优于两者单独使用[7-8],r-SAK与中药益活凊胰汤联用具有协同效应[7]。通过基因工程手段改造[9-11],降低r-SAK的免疫原性,或者改造其制剂[12],可以进一步提升其溶栓效率和安全性,未来重组葡激酶可能在急性心肌梗死,肺栓塞,深部静脉血栓等疾病的临床治疗中发挥重要作用。
