硫氧还蛋白还原酶1(TrxR1)在胃癌中的表达及对胃癌细胞生长的影响*
2020-11-30范有寿邱志胜赵亚萍
范有寿,邱志胜,赵亚萍
(1.金昌市第一人民医院外一科,甘肃 金昌 737100;2.甘肃省人民医院肿瘤外科,兰州 730000;3.金昌市第一人民医院妇产科,甘肃 金昌 737100)
胃癌是消化系统常见的恶性肿瘤之一,据统计胃癌已成为严重威胁人类健康的第二大常见癌症,其发病率和死亡率均较高[1]。虽然胃癌的诊断和治疗已经取得了巨大的进展,但由于胃癌的复发和转移且治疗效果不尽如人意,其5年总生存率仍较低[2, 3]。因此,进一步探究胃癌的发病机制,开发新的治疗方法对提高患者的治疗水平和改善预后具有重要意义。
硫氧还蛋白还原酶1(thioredoxin reductase 1,TrxR1)是一种硒蛋白,能通过NADPH依赖的方式促进硫氧还蛋白1(thioredoxin 1,Trx1)的还原。TrxR1具有调节细胞生长发育和抗氧化应激的作用,参与肿瘤的生长和耐药。有研究发现TrxR1在口腔鳞癌、脑膜瘤和非小细胞肺癌等多种肿瘤中高表达,且与肿瘤分期和预后有关[4-6]。研究发现,过表达TrxR1能降低胶质瘤细胞的放疗敏感性[7]。沉默TRXR1能抑制肝癌细胞增值和迁移,并促进细胞凋亡[8]。上述研究表明TRXR1是恶性肿瘤诊疗的潜在靶点,但其在胃癌中的作用研究较少。因此,本文探究TRXR1在胃癌中的表达及与临床病理特征的关系,并通过细胞实验探究其对胃癌细胞生物学行为的影响,为临床治疗胃癌提供新靶点。
1 材料与方法
1.1 材料
组织标本:76例胃癌及对应的癌旁组织均来源于2013年1月至2014年4月期间在金昌市第一人民医院接收手术治疗的患者。其中,男性56名,女性20名,年龄20~56岁。所有患者术前未接受放疗和化疗。所有患者的胃癌及癌旁组织部分保存于10%多聚甲醛溶液中固定至少24 h后行石蜡包埋,部分组织置于液氮速冻后转入-80℃冰箱保存用备用。所有病例依据国际癌症控制联盟(Union for International Cancer Control,UICC)第七版胃癌TNM分级标准分期[9]。术后对生存患者进行随访,随访截止于2019年7月。本研究经我院伦理委员会审查批准。
主要材料与试剂:胃癌细胞株AGS、MKN-45、HGC-2及永生化人胃粘膜上皮细胞GES-1均购自武汉普诺赛生命科技有限公司;胃癌细胞株MGC-803购于美国典型培养物保藏中心(American Type Culture Collection,ATCC;TRIzol、LipofectAMINE2000和RPMI 1640液体培养基购自美国Invitrogen公司;SYBR Premix ExTaq Ⅱ试剂盒和实时荧光定量PCR SYBR Green试剂盒均购自日本TaKaRa公司;PierceTMBCA Protein Assay试剂盒、ECL染色试剂均购自北京索莱宝科技有限公司;PVDF膜购自美国Millipore公司;兔抗人TRXR1多克隆抗体(bs-8299R)、兔抗人cyclinD1多克隆抗体(bs-0623R)、兔抗人C-Myc多克隆抗体(bs-4963R)均购自北京博奥森生物技术有限公司;TRXR1 siRNA干扰序列及阴性对照(NC-siRNA)购自生工生物工程(上海)股份有限公司。
1.2 细胞培养
AGS细胞株培养于Ham's F-12细胞培养液,MKN-45、MGC-803、HGC-2、GES-1细胞株培养于RPMI-1640培养液(均含10%的胎牛血清、100 U/ml的青霉素和100 μg/ml的链霉素),置于37℃、CO2体积分数为5%的培养箱中培养,取对数生长期的细胞进行传代或进行后续实验。
1.3 细胞分组与转染
取对数生长期的AGS细胞,用胰酶消化制成单细胞悬液,以4×105cells/well接种于6孔板,继续培养至对数期,更换培养液。根据处理方法不同将AGS细胞分为3组:阴性对照组、TRXR1 siRNA干扰1组(TRXR1 siRNA1组)和TRXR1 siRNA干扰2组(TRXR1 siRNA2组)。根据siRNA设计原则,针对TRXR1基因序列设计两条siRNA序列(TRXR1-siRNA1和TRXR1-siRNA2)并送至上海吉玛生物科技有限公司合成。根据Lipofectamine RNAiMAX转染试剂盒操作说明将TRXR1 siRNA干扰序列1(TRXR1-siRNA1)、TRXR1 iRNA干扰序列2(TRXR1-siRNA2)及阴性对照序列(NC-siRNA)分别转染至AGS细胞,转染至48 h后,收集细胞,提取总RNA和总蛋白,用qRT-PCR和Western blot法检测各组细胞中TRXR1 mRNA和蛋白表达量。
1.4 Real-time PCR检测TrxR1 mRNA表达水平
用RNA提取试剂盒提取胃癌组织及细胞中总RNA,用PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒进行RNA反转录,将提取的RNA反转录为cDNA,以此cDNA作为模板,行实时荧光定量PCR,以β-actin为内参。TrxR1上游引物5’-AGC TCA GTC CAC CAA TAG TGA-3’,下游引物5’-GGT ATT TTT CCA GTC TTT TCA T-3′。β-actin上游引物:5’-CAC CCG CGA GTA CAA CCT TC-3’,下游引物:5’-CCC ATA CCC ACC ATC ACA CC-3’。反应条件: 95℃预变性30 s,95℃变性5 s,60℃退火延伸40 s,共40个循环。以2-ΔΔCt值表示TRXR1 mRNA的相对表达水平。
1.5 免疫组织化学染色
组织标本常规包埋,5 μm连续切片,二甲苯脱蜡,梯度酒精脱水,PBS冲洗,柠檬酸盐抗原热处理20 min,添加兔抗人TrxR1抗体(1∶500),37℃湿盒中孵育过夜,PBS冲洗,添加FITC标记的山羊抗兔IgG(1∶5 000),37℃孵育30 min,PBS冲洗,DAB显色,PBS冲洗,复染,中性树脂封片。以PBS代替一抗作为阴性对照。
1.6 蛋白印迹法检测TRXR1、c-Myc和cyclinD1蛋白表达水平
用TRIzol提取胃癌组织及癌旁组织中总蛋白,用BCA法检测蛋白浓度,按每孔50 μg蛋白质行10% SDS-PAGE分离蛋白,电泳结束后,将分离到的蛋白转移至PVDF膜上。将PVDF膜置于含5%脱脂奶粉的TBST中室温下封闭30 min,分别加入兔抗人TrxR1多克隆抗体(1∶1 000)、兔抗人cyclinD1多克隆抗体(1∶1 000)、兔抗人C-Myc多克隆抗体(1∶500)及兔抗人β-actin多克隆抗体(1∶2 000),4℃反应过夜,用PBST洗膜3次,每次10 min,然后加入辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶5 000),室温孵育1 h,TBST洗膜,采用电化学发光试剂显影,用Image J软件分析蛋白条带灰度值,以TRXR1蛋白条带灰度值与内参β-actin蛋白条带灰度值的比值表示TRXR1蛋白的相对表达水平。
1.7 克隆集落形成实验
取对数生长期的阴性对照组、TrxR1基因沉默1组和TrxR1基因沉默2组AGS细胞,用胰酶消化成单细胞悬液,按1×105cells/well接种于6孔板,培养1周后,甲醛溶液固定细胞,倒置显微镜观察克隆数。实验重复3次。
1.8 MTT法检测TRXR1沉默对细胞增殖能力的影响
取对数生长期的阴性对照组、TrxR1基因沉默1组和TrxR1基因沉默2组AGS细胞,用胰酶消化成单细胞悬液,按8 000 cells/well接种于96孔板中,继续培养24、48、72、96 h后,加入20 μl终浓度为5 mg/ml的MTT,继续孵育4 h后,离心除去上清液,加入150 μl DMSO,置摇床上低速震荡混匀,用酶联免疫检测仪在490 nm处检测各孔吸光度值(OD)。每组设6个复孔,实验重复3次。
1.9 统计学处理
2 结果
2.1 TRXR1在胃癌组织中的表达
免疫组化结果显示,TrxR1蛋白主要定位在细胞质,在细胞核中也有少量表达,TrxR1蛋白在胃癌组织中表达量显著高于癌旁组织(图1A),Western blot实验结果显示,3例胃癌组织中TrxR1蛋白表达量显著高于对应的癌旁组织表达量(图1B);此外,用qRT-PCR检测收集的76例胃癌组织及癌旁组织中TrxR1 mRNA的表达量,结果显示,胃癌组织中TrxR1 mRNA表达(3.45±1.01)显著高于癌旁组织(0.83±0.30,P<0.01)。
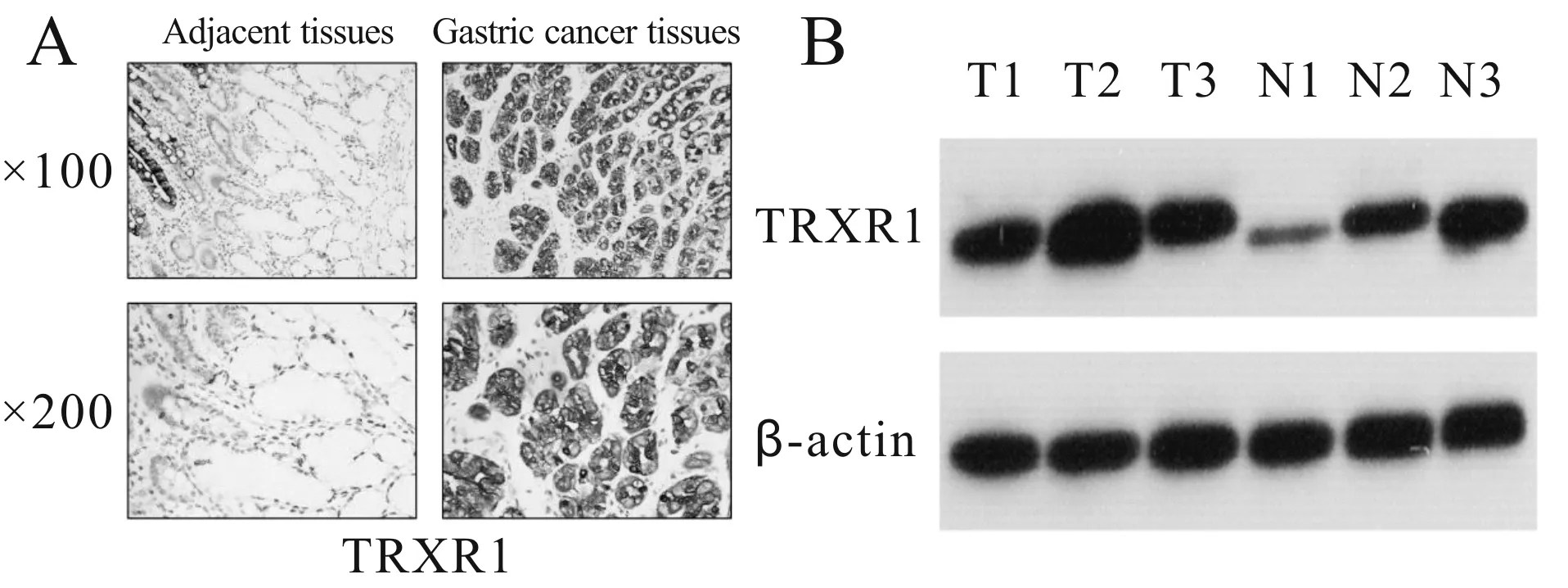
Fig. 1 Relative expression levels of TRXR1 in gastric cancer and adjacent tissues(n=3)
2.2 TRXR1 mRNA表达与胃癌临床病理特征和预后的关系
以76例胃癌组织TrxR1 mRNA表达量的平均值3.45为界,将患者分为高表达组和低表达组,其中,TrxR1 mRNA表达量≥3.45为高表达组(n=37),TrxR1 mRNA表达量<3.45为低表达组(n=39),比较两组患者年龄、性别、肿瘤位置、TNM分期、淋巴结转移和分化程度的差异,并对生存时间进行分析。结果显示,TNM分期越高以及有淋巴结转移患者TrxR1 mRNA表达越高,差异有统计学意义(P<0.05,表1);Kaplan-Meier分析显示,TrxR1低表达组患者中位生存期为45(34~54)个月,TrxR1高表达组患者中位生存期为35(21~45)个月,与TrxR1低表达组相比,TrxR1高表达组患者中位生存期较短(P<0.01)。

Tab. 1 Relationship between TrxR1 mRNA expression and clinicopathological features
2.3 TRXR1在胃癌细胞系中的表达
为了验证胃癌组织中的检测结果,进一步检测了4株胃癌细胞系MGC-803、AGS、MKN-45、HGC-2及1株永生化人胃粘膜上皮细胞系GES-1中TRXR1的表达量,结果如表2所示,胃癌细胞中TrxR1 mRNA表达量均显著高于其在永生化人胃粘膜上皮细胞系中的表达量(P<0.01),其中AGS细胞系中TRXR1表达量最高,因此,后续实验用AGS细胞系研究TrxR1对胃癌细胞增殖的影响。
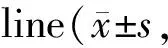
Tab. 2 Expression of TrxR1 in gastric cancer cell n=3)
2.4 TrxR1沉默细胞的建立
将构建的TrxR1 siRNA1、TrxR1 siRNA2和NC-siRNA转染胃癌细胞AGS,转染48 h后收集RNA和总蛋白,检测TRXR1 mRNA和蛋白表达。结果显示,与NC-siRNA组相比,TRXR1 siRNA1和TRXR1 siRNA2组细胞中TRXR1 mRNA和蛋白表达量均显著降低(P<0.01,表3)。
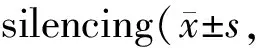
Tab. 3 Expressions of TrxR1 mRNA and protein in AGS cells after TrxR1 n=3)
2.5 TrxR1沉默对AGS细胞增殖能力的影响
将处于生长对数期的由TrxR1 siRNA1和TrxR1 siRNA2构建的TRXR1沉默胃癌细胞AGS以1×105cells/well接种于6孔板,培养1周后在倒置显微镜下摄片,进行单克隆计数。结果发现,TrxR1 siRNA1组和TrxR1 siRNA2组AGS细胞的细胞数目少于NC-siRNA组的细胞数目,差异有统计学意义(P< 0.01)。
将处于生长对数期的TRXR1沉默及阴性对照组的胃癌细胞AGS以8 000 cells/well接种于96孔板,分别继续培养24、48、72、96 h后,MTT试验结果显示,基因沉默TrxR1后,细胞增殖能力被明显抑制,培养48~96 h时与NC-siRNA组相比,结果均有统计学差异(P<0.05,表4)。上述结果提示,TrxR1基因沉默能抑制AGS细胞的增殖。
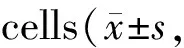
Tab. 4 The effect of TrxR1 silencing on the proliferation of AGS n=3)
2.6 TRXR1沉默对AGS细胞c-Myc和cyclinD1蛋白表达的影响
Western blot试验结果显示,与NC-siRNA组相比,TRXR1 siRNA1组和TRXR1 siRNA2组AGS细胞中c-Myc和cyclinD1蛋白表达量均显著降低(P<0.05,表5)。这一结果提示,TRXR1基因沉默能抑制AGS细胞中与细胞周期相关蛋白c-Myc和cyclinD1表达。
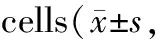
Tab. 5 Effects of TrxR1 silencing on the expressions of c-myc and cyclinD1 in AGS n=3)
3 讨论
硫氧还蛋白(thioredoxin,Trx)系统是人体主要的抗氧化系统之一,由Trx1、TrxR和NADPH组成。其主要作用是参与调节机体的氧化还原反应、转录因子调节和免疫应答[10]。TrxR是二聚体黄素酶,与细胞的增殖、凋亡以及肿瘤的发生、转移密切相关。在大多数哺乳动物细胞中,根据分布部位不同,将TrxR分为TrxR1和TrxR2两种,其中,TrxR1表达于细胞质和细胞核中,TrxR2主要表达于线粒体中[11]。研究发现,TrxR1在多种肿瘤组织中高表达,且TrxR1高表达与肿瘤分期、患者预后及耐药有关[11, 12]。然而,TrxR1与胃癌的关系尚没有被报道。
本研究中,我们首先通过免疫组化法检测3例胃癌组织及癌旁组织中TrxR1蛋白的表达及定位,发现TrxR1在胃癌组织中高表达,主要定位于细胞质,在细胞核中也有少量表达。同时,用Western blot法也检测3例胃癌组织及癌旁组织中TrxR1蛋白的表达,检测结果也表明TrxR1蛋白在胃癌组织中表达量显著性高于癌旁组织。此外,用RT-PCR法检测收集的76例胃癌组织及癌旁组织中TrxR1的表达,发现胃癌组织TrxR1 mRNA表达量明显升高。冉冬梅和高丰厚[13]研究发现TrxR1在非小细胞肺癌(non-small cell lung carcinoma,NSCLC)中高表达。另有研究发现,TrxR1在前列腺癌患者血清中明显升高,且其与患者的不良预后相关[4]。有学者认为TrxR1升高诱导的氧化应激是肝癌发生的主要决定因素之一[11]。有研究发现,TrxR1表达与胶质瘤患者病理分期相关,晚期胶质瘤组织TrxR1表达量明显高于早期胶质瘤组织[14]。本研究中,我们比较胃癌组织TrxR1表达水平与胃癌患者临床病理特征之间的关系,发现胃癌TNM分期越高以及有淋巴结转移患者组织TrxR1蛋白表达水平较高。Kaplan-Meier分析显示,TRXR1与胃癌患者预后负相关。为进一步明确TRXR1在胃癌中的表达情况,检测4株胃癌细胞系及1株永生化人胃粘膜上皮细胞系中TRXR1的表达情况,结果同样显示,TRXR1在胃癌细胞中的表达量也升高。以上研究结果表明,TRXR1在胃癌中高表达,TRXR1高表达也是胃癌患者预后不良的危险因素,其可能参与胃癌的发生发展。
TRXR1对肿瘤细胞增殖的影响越来越受到人们关注。Yin等[15]报道,过表达TRXR1能抑制化疗药物诱导的头颈部鳞状细胞癌凋亡。另有研究报道,过表达TrxR1能显著降低胶质瘤细胞的放射敏感性[7]。He等[16]研究发现,土木香内酯能通过抑制TRXR1活性,诱导胃癌细胞产生活性氧(reactive oxygen species,ROS),导致胃癌细胞凋亡。目前,开发新的TrxR1抑制剂作为潜在的抗癌药物已被人们的普遍认可。为了深入探究TRXR1对胃癌增殖的影响,我们首先构建两条TRXR1干扰序列,RT-PCR和Western blot实验显示,TRXR1 siRNA1和TRXR1 siRNA2均能显著性抑制胃癌细胞中TRXR1的表达,提示成功建立TRXR1沉默细胞模型。进一步研究TRXR1沉默对胃癌细胞克隆形成数目的影响,结果发现,与NC-siRNA组相比,TRXR1 siRNA1和TRXR1 siRNA2组的细胞克隆数显著性减少。进一步研究TRXR1沉默对胃癌细胞增殖能力的影响,结果发现,基因沉默TRXR1可明显降低胃癌细胞的增殖能力。以上结果表明,TRXR1能促进胃癌细胞的生长增殖。TRXR1基因沉默对胃癌细胞增殖活力的影响可能与胃癌细胞中氧化应激有关。正常生理条件下,细胞中ROS的产生和清除处于动态平衡,ROS生成过多或清除不足导致细胞氧化应激,引起DNA氧化损伤,促使细胞凋亡。研究表明,肿瘤细胞中ROS水平高于正常细胞,故癌细胞抵抗ROS的能力较弱,易受活性氧的影响。因此,提高ROS水平是一种非常重要的肿瘤治疗方法。一些临床抗癌药物,如索拉非尼、顺铂和三氧化二砷都可以诱导肿瘤细胞产生更多的ROS,导致癌细胞凋亡。越来越多的研究表明,抑制TrxR1活性能破坏ROS生成和清除的动态平衡,促进ROS生成增多,诱发机体发生氧化应激,引起DNA损伤,诱导细胞凋亡。
c-myc蛋白是一种真核转录调节因子,对细胞周期重要的调控因子能与Max结合成二聚体,c-Myc/Max二聚体复合物与DNA核心序列结合调控下游基因的转录,参与调节细胞的生物学特性,包括细胞周期、代谢、凋亡[17]。Cyclin D1是一种核蛋白,主要负责细胞G1期的调控。Cyclin D1通过结合并激活CDK4,促进视网膜母细胞瘤易感基因(retinoblastoma,Rb)的蛋白产物pRb磷酸化,进而释放转录因子E2F,使细胞由G1期向S期过渡,使细胞增殖能力增强[18]。本研究结果发现,TRXR1基因沉默的胃癌细胞中c-myc和cyclin D1蛋白水平显著性降低,提示基因沉默TRXR1能影响胃癌细胞中与周期相关的蛋白表达,从而抑制细胞增殖。
综上所述,胃癌组织中TrxR1高表达提示患者预后不良,基因沉默TRXR1能抑制胃癌细胞的增值,调控机制可能与抑制周期相关蛋白c-myc和cyclin D1表达有关,提示TRXR1可能是胃癌治疗的靶基因,为胃癌的的治疗提供实验依据及新的思路。但具体的分子机制还需要进一步研究。
