环状GMP-AMP合成酶高表达对乳腺癌细胞上皮间质转化的影响*
2020-11-30张晓金张文霞朱吉玲罗文盼
张晓金,张文霞,朱吉玲,罗文盼
(1.江苏医药职业学院,盐城 224004;2.甘肃省人民医院,兰州 730000;3.绍兴文理学院,浙江 绍兴 312000)
尽管人类在乳腺癌治疗方面已取得重大进展,但乳腺癌仍然是最常见的癌症之一,是全球妇女死亡的主要原因[1]。即使目前治疗方法不断进步,但是乳腺癌的发病率和死亡率仍然处于上升态势[2]。乳腺癌侵袭转移是乳腺癌患者死亡的关键所在。目前普遍认为,乳腺癌是一种多基因、多步骤参与的复杂疾病。上皮-间质转化(epithelial to mesenchymal transition,EMT)机制一直以来都是探讨恶性肿瘤转移的热点话题。EMT是指在特定的生理、病理状况下,上皮细胞会暂时失去极性,表现出间质细胞所具有的迁移特征,即上皮细胞出现细胞极性丧失、黏附能力下降及细胞拉长等间质表型特征。研究表明,EMT与乳腺癌的侵袭转移显著相关,乳腺癌细胞通过EMT获得转移迁移能力,侵袭周围或远处组织,成为转移性肿瘤[3]。在EMT过程中,肿瘤细胞频繁出现上皮标记蛋白(E-cadherin)表达水平降低,间质标记蛋白(N-cadherin)表达水平的上调[4],因此可以把这两种免疫标记物的表达情况作为细胞发生EMT的指标。E-cadherin具有细胞黏附及信号转导的双重作用,是维持上皮表型的重要黏附分子,该蛋白的缺失使细胞间的黏附下降,并促使β-连环蛋白发生易位,进一步激活相关信号通路,最终诱导N-cadherin的表达上调,E-cadherin的下调及N-cadherin的高表达与肿瘤低分化、高侵袭力密切相关[5]。近年研究发现,环状GMP-AMP合成酶(cyclic GMP-AMP synthase, cGAS)信号传导通路与多种肿瘤发生密切相关。例如,有研究表明cGAS可通过检测微核,从而在维持细胞稳态及监控癌症方面发挥重要作用[6]。本实验将构建高表达cGAS的慢病毒载体,转染乳腺癌细胞,探讨cGAS通路对乳腺癌细胞增殖、迁移能力及EMT过程的作用机制,旨在寻求调控乳腺癌发展的新靶点,为临床乳腺癌的诊断治疗提供理论依据。
1 材料与方法
1.1 细胞株
乳腺癌MCF7细胞株购于上海细胞库;
1.2 主要试剂
DMEM培养基(Hyclone)、胎牛血清(Gibco)、兔抗人cGAS单克隆抗体(Cell Signaling)、兔抗人STING单克隆抗体(Cell Signaling)、兔抗人单克隆抗体NF-κB(Cell Signaling)、兔抗人TANK单克隆抗体(Abcam)、兔抗人E-cadherin单克隆抗体(Abcam)、兔抗人N-cadherin单克隆抗体(Abcam)、辣根过氧化物酶标记的山羊抗兔 IgG的抗体(碧云天),MTT试剂购自美国Promega公司。cGAS载体构建及慢病毒包装由GenePharma公司完成。
1.3 建立稳定高表达cGAS的细胞株及分组设计
将MCF7细胞消化计数后均匀接种到12孔板中,设阴性对照组(NC组)和处理组(MCF7-cGAS),处理组加入含cGAS的慢病毒,NC组加入等量空载慢病毒。培养过夜,待细胞生长达到30%~40%时,弃掉旧培养液,更换配置好的转染混合液,继续培养过夜,更换正常培养液,培养48 h后加入嘌呤霉素,筛选出稳定高表达cGAS的细胞。
1.4 MTT检测细胞增殖
将NC组细胞和处理组细胞消化后,接种于96孔板中,2 000 cells/well,严格控制细胞数目,每个孔做4个重复,分别培养12 h,24 h,48 h,72 h,加入MTT(5.0 g/L)50 μl/well、置入培养箱孵育4 h,离心弃上清,加入二甲基亚砜200 μl,采用酶联免疫检测仪测定各孔吸光值,评价细胞存活率。酶标仪490 nm波长处测定吸光度(OD)值,绘制细胞生长曲线。
1.5 Transwell 检测细胞迁移能力
分别制备NC组和MCF7-cGAS组单细胞悬液(无血清培养液),以1×105cells/ml加至24孔Transwell小室上部孔中,下部腔室中加入50 μl含10%胎牛血清的培养液,在37℃、5%CO2培养箱中孵育24 h后,收集穿过下室并铺展在下膜表面上的细胞,结晶紫染色,计数每个膜的迁移细胞数目,计算迁移率,迁移率(%)=(迁移细胞数/总细胞数×100%)
1.6 Western blot检测蛋白表达水平
取NC组及MCF7-cGAS组细胞提取蛋白,采用BCA法测定蛋白浓度并将样本蛋白稀释至适宜浓度,SDS-PAGE电泳2 h,转膜1.5 h,转膜后用5%脱脂奶粉封闭1 h,加入一抗,4℃孵育过夜,TBST洗涤后加二抗孵育1 h,β-actin做内参。
1.7 统计学处理
2 结果
2.1 构建高表达cGAS 的乳腺癌细胞系的鉴定
将对照空载体病毒和高表达cGAS慢病毒分别感染MCF7细胞48 h后,在荧光显微镜下观察细胞荧光表达,并用嘌呤霉素筛选2周,在荧光显微镜下观察,可见各组细胞GFP阳性率均在90%以上。蛋白质印迹结果也表明MCF7细胞感染后cGAS蛋白表达增高,结果表明成功构建MCF7-cGAS细胞系(图1)。

Fig. 1 Effective lentiviral vector were transfected into breast cancer cells MCF7
2.2 cGAS高表达对MCF7细胞形态学的影响
将对照组和MCF7-cGAS组细胞分别培养24 h后,光学显微镜观察细胞,与对照组相比,MCF7-cGAS组细胞形态发生明显改变(图2)。细胞形态由鹅卵石样转变为梭形,该特征为癌细胞发生上皮-间质转化的表现之一。

Fig. 2 Effects of cGAS over expression on morphological characteristics of MCF7 cells(×200)
2.3 cGAS高表达对乳腺癌细胞增殖能力的影响
MTT检测结果显示,MCF7-cGAS组细胞在12 h、24 h、48 h、72 h的OD值(分别为0.379±0.012,0.516±0.019,0.854±0.032,1.154±0.027)均显著高于对照组细胞对应时间点的OD值(0.221± 0.009,0.383±0.017,0.648±0.024,0.904±0.019,P<0.05,图2)。

Fig. 3 Effects of cGAS overexpression on viability of MCF7 cells n=3)
2.4 cGAS高表达对乳腺癌细胞迁移能力的影响
MCF7-cGAS细胞组在48 h的迁移率为 61.58%,明显高于对照组的迁移率28.9%(P< 0.05,图4)。

Fig. 4 Effects ofcGAS overexpression on migration of MCF7 cells by transwell assay(×200)
2.5 cGAS高表达对乳腺癌细胞上皮间质转化相关蛋白表达的影响
Western blot结果显示,与NC组相比,MCF7-cGAS细胞组EMT标记蛋白E-cadherin的表达水平降低,N-cadherin表达水平增高(P<0.05,图5,表2)。

Fig. 5 Expressions of E-cadherin and N-cadherin detected by Western blot
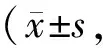
Tab. 1 Relative protein expressions of E-cadherin and N-cadherin in the MCF7 cells by Western blot n=3)
3 讨论
cGAS-STING信号通路最初是作为天然免疫系统的一个重要组成部分被发现,其功能是检测胞浆DNA的存在,并在反应中触发炎症基因的表达[7-9]。之前诸多研究主要探索cGAS在固有免疫细胞中的功能与调节机制,近年来的研究显示cGAS在肿瘤中也发挥重要调节作用。当肿瘤细胞胞质DNA泄露后,易被cGAS识别,激活下游IFN应答[10]。Ⅰ型IFN应答能够作为刺激肿瘤反应的关键诱导剂, 且其上游cGAS-STING信号通路也可以在特定阶段促进肿瘤的发生和发展。在非炎性路易斯肺癌(Lewis lung cancer,LLC)小鼠模型中cGAS-STING通路激活与肿瘤生长有关[11]。本研究结果显示,cGAS高表达后乳腺癌细胞发生上皮间质转化,提示其在乳腺癌中可能发挥调节作用。
新近研究发现染色体不稳定性通过维持肿瘤细胞对胞质 DNA 的自主反应来促进转移。染色体不稳定的癌细胞会产生大量DNA 碎片通过微核分泌到细胞质中,一旦细胞质内出现 DNA 碎片,就会激活 cGAS-STING 通路,但随后不会激活经典的 NF-κB 通路。相反,cGAS-STING 通路会激活非经典的 NF-κB 通路,促使 p52 基因的表达,使癌细胞的基因表达特征与骨髓先天性免疫细胞具有某些相似性,并且可逃避 T 细胞的追杀,抑制cGAS-STING 通路可显著抑制癌细胞转移[12]。cGAS-STING 信号的激活也会刺激 PD-L1 在癌细胞中表达,从而介导癌细胞的免疫逃逸[13]。Chen 等发现连接蛋白43和原钙黏蛋白7介导cGAMP 通过缝隙连接从肿瘤细胞转移到星形胶质细胞,随后诱导IFN和NF-κB的表达, 促进脑转移[14]。本研究中cGAS高表达后增强乳腺癌细胞的增殖和迁移能力。上皮间质转化(EMT)是肿瘤性上皮细胞向间质细胞转化的生物学过程,是恶性肿瘤侵袭和转移的重要步骤。例如,在关于胃癌和髓母细胞瘤的研究报道,减缓EMT进程,可抑制癌细胞侵袭[15,16]。本研究发现,cGAS高表达可增加N-cadherin表达,降低E-cadherin表达,促进EMT进程,这可能是cGAS促进乳腺癌细胞侵袭的机制之一,但具体作用机制还需进一步探究。
综上所述,本研究证实cGAS高表达可促进乳腺癌细胞EMT进程,进而促进乳腺癌MCF7的增殖和迁移能力,揭示cGAS与细胞增殖、迁移相关。在后续研究中,我们将深入探讨cGAS-STING通路对肿瘤发生发展的影响及机制,为临床乳腺癌靶向治疗提供理论依据。
