草酸青霉菌HB1溶磷能力及作用机制
2020-11-30耿丽平陆秀君刘文菊李博文
何 迪,耿丽平,郭 佳,陆秀君,刘文菊,李博文
草酸青霉菌HB1溶磷能力及作用机制
何 迪1,耿丽平1,郭 佳1,陆秀君2,刘文菊1※,李博文1
(1. 河北农业大学资源与环境科学学院,河北省农田生态环境重点实验室,河北省蔬菜产业协同创新中心,保定 071001;2. 河北农业大学植物保护学院,保定 071001)
一些功能微生物具有溶磷能力且同一菌株对不同难溶性磷酸盐的溶解能力存在差异。该研究以草酸青霉菌HB1为研究对象,通过固体平板培养试验、摇瓶培养试验和土壤培养试验系统研究了不同磷源(磷酸钙、磷矿粉、磷酸铁、磷酸铝)与氮源(铵态氮、硝态氮)供应下HB1溶磷能力及其作用机制,并验证了其在高、低不同磷水平土壤中的溶磷能力。结果表明,接种HB1的不同磷源培养基上均有溶磷圈出现,根据溶磷圈直径/菌落直径初步确定HB1溶解磷酸钙的能力较强;摇瓶培养试验表明供试磷源为磷酸钙、磷酸铁时HB1发酵液中有效磷含量为884、265 mg/L(铵态氮),或945、206 mg/L(硝态氮),其溶磷能力不受氮源形态影响;磷矿粉为磷源时,HB1发酵液中有效磷含量可达199 mg/L(供应铵态氮),为硝态氮供应的7.14倍;而磷酸铝为磷源时,HB1发酵液中有效磷含量为120 mg/L(供应硝态氮),为铵态氮供应的3.29倍;此外,供应铵态氮条件下,HB1对难溶性磷酸盐的溶解能力与介质中pH值呈显著的负相关关系。HB1接种于不同磷水平的土壤中培养21 d,在低磷和高磷土壤中HB1均能有效定殖且增加了土壤有效磷含量,比不接菌对照分别增加45.00%和14.17%。综上,草酸青霉菌HB1对磷酸钙和磷矿粉的溶磷效果较好,并通过分泌氢质子酸解含磷矿物实现溶磷作用,且HB1在低磷土壤中溶磷能力较强。
磷;土壤;菌;难溶性磷源;土壤定殖;革酸青霉菌HB1
0 引 言
磷作为植物生长发育所必需的营养元素之一[1],在土壤中储量丰富,但95%是难以被植物直接吸收利用的无效态[2-3]。上个世纪80年代,中国约74%的农田土壤存在磷贫瘠现象[4]。因此,化学磷肥成为当时促进农业生产的主要磷素来源。然而,化肥磷素进入土壤后会因土壤本身的理化特性和磷酸盐的化学行为而转化为难溶性磷酸盐,使磷肥的当季利用率降低,造成大量未被植物利用的磷素残留在土壤中。近年来,固定在表层土壤中的大量磷素也会径流进入地表水体而产生富营养的环境问题[4-6]。因此,探索土壤中难溶态磷活化的途径和方法至关重要[2]。土壤中存在大量的微生物具有将难溶态含磷化合物转化为有效态的能力,其数量约为土壤微生物总量的十分之一,且种类多样[7],这些微生物统称为溶磷微生物或溶磷菌。长期以来,研究者一直致力于挖掘自然环境介质中存在的具有溶磷作用的功能微生物或功能菌的研究,以促进作物生育期内土壤磷素的释放,提高土壤磷素利用率,从而减少大量施用含磷化肥造成的水体富营养化问题等[8]。
矿物态磷在中国土壤中的存在形式不一,在北方石灰性土壤中主要以磷酸钙盐的形式存在[9];在南方酸性土壤中,主要以粉红磷铁矿、蓝铁矿和闭蓄态磷酸铁、铝盐形式存在[7]。溶磷菌可活化难溶磷酸盐,但同一菌株对不同磷酸盐的溶解能力存在差异。另外,有研究表明,同一溶磷菌株在生长过程中供试氮源条件不同其溶磷效果也存在差异[10]。Whitelaw 等[11]研究证实青霉菌()对Ca-P、Al-P的溶解能力较高,而对Fe-P的溶解能力很差。Reddy 等[12 ]研究了曲霉菌对不同磷矿石的溶解作用,发现不同曲霉菌菌株选择不同的磷源作为其生长物质。赵小蓉等[13]研究表明,真菌的溶磷能力高于细菌,大多数真菌对Ca3(PO4)2的溶解能力较强,对Fe-P的溶解能力较低,并且有些菌株(如欧文氏菌4TCRi 22)完全不能溶解Fe-P和Al-P。基于此,本研究以研究小组自主筛选的草酸青霉菌HB1[14]为供试菌株,通过固体平板和液体摇瓶培养试验研究草酸青霉菌HB1溶解不同矿物态磷的能力及作用机制;通过土壤培养试验明确其活化土壤磷的能力,以期提供一株可用于微生物肥料开发利用的优良菌株。
1 材料与方法
1.1 供试材料
1)供试菌株:草酸青霉菌() HB1,本课题组自主筛选并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No. 4842。
2)供试磷源:磷酸钙、磷矿粉、磷酸铁、磷酸铝。
3)供试培养基:
① PDA固体培养基:马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水1 L,pH=7.0;
② PDA液体培养基:去除PDA固体培养基中的琼脂,其他成分不变;
③无机磷固体培养基:葡萄糖10 g,(NH4)2SO40.50 g,NaCl 0.30 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母粉0.40 g,磷源10 g,琼脂20 g,蒸馏水1 L,pH=7.0;
④无机磷液体培养基-铵态氮:葡萄糖10 g,(NH4)2SO40.50 g,NaCl 0.30 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母粉0.40 g,磷源10 g,蒸馏水1 L,pH=7.0;
⑤无机磷液体培养基-硝态氮:葡萄糖10 g,NaNO30.64 g,NaCl 0.30 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母粉0.40 g,磷源10 g,蒸馏水1 L,pH=7.0。
4)供试土壤:试验用土取自河北省永清县大青垡村(39°12′47″N,116°30′20″E),分别在黄瓜温室的棚内和棚外(2个温室间的空地)取有效磷含量差异较大的土壤,取土时棚内种植越冬一大茬黄瓜,棚外种植玉米。棚内和棚外土壤质地相同,其他基本理化性状见表1,土壤酸碱度(pH)、电导率(EC)、碱解氮、全磷、速效磷、速效钾、有机质含量采用常规方法测定[15]。

表1 供试土壤的基本化学性质
由表1可以看出,棚内土壤养分含量高,棚外土壤养分含量低,与其他指标相比,2种土壤有效磷含量差异最大,因此棚内高养分含量土壤简称高磷土,棚外低养分含量土壤简称低磷土。
1.2 试验方法
1.2.1 固体平板培养试验
1)草酸青霉菌HB1菌株的活化:从保存的HB1斜面菌种上挑取一环转接到PDA固体培养基上,于30 ℃培养48~72 h,待长满整个平板。再从培养好的平板上挑取菌种,转接到PDA固体培养基上,于30 ℃培养72 h,待长满整个平板,备用。
2)试验步骤:分别将20 mL含不同磷源的无机磷固体培养基倒入已灭菌的培养皿中,晾干备用。在PDA液体培养基中接入1环(直径1.50 mm)活化好的HB1菌,摇床培养18 h(200 r/min),然后吸取20L分别放在4种磷源的无机磷固体培养基培养皿的中心,水分吸收后倒置于30 ℃培养箱培养8 d[12]。每个处理6次重复。
1.2.2 液体摇瓶培养试验
1)草酸青霉HB1菌株活化:同1.2.1(1)。
2)草酸青霉HB1菌液的制备:将活化好的HB1菌株用无菌水制成孢子悬浮液,制成其孢子数量约为1×108cfu/mL。
3)试验步骤:将50 mL无机磷液体培养基分装于150 mL三角瓶中,再按固液比1∶100的比例称取不同矿物态磷源,调节pH值至7.0,121 ℃,灭菌20 min。冷却后,按1%的接种量接入HB1孢子菌悬液,30 ℃,200 r/min,培养7 d。同时以接入等量无菌水和等量灭活HB1菌液做对照。
共设置3个处理:CK(等量无菌水)、HB1(等量含HB1的孢子菌悬液)、灭活HB1(等量灭活HB1菌液)。每个处理设3次重复。
1.2.3 土壤培养试验
1)草酸青霉HB1菌株活化:同1.2.1(1)。
2)草酸青霉HB1菌液的制备:同1.2.2(2)。
3)试验步骤:分别称取两种磷水平风干土壤各30 g于离心管中,先加入6 mL的灭菌水润湿土壤,再加入4 mL的HB1孢子菌悬液,接种后的起始浓度为1.33×107cfu/g,同时以加入等量的灭菌水为对照,保持土壤湿度30%~50%,用封口膜将离心管封口,放入生化培养箱中,于30 ℃下培养40 d[16]。
设置4个处理:低磷土+HB1、低磷土+灭菌水、高磷土+HB1、高磷土+灭菌水,每个处理3次重复。
1.3 测定指标与方法
1.3.1 固体平板培养试验
从第3天开始,每天测定菌落直径、溶磷圈直径,并计算溶磷圈直径/菌落直径[10]。
1.3.2 液体摇瓶培养试验
1)上清液中有效磷、pH测定:选择HB1菌在两种氮源供应下取样,氮源为铵态氮的处理分别于该菌在供应铵态氮的生长对数期内的72、108和132 h取样;氮源为硝态氮的处理分别于该菌在供应硝态氮的生长对数期内的84、120和144 h取样。取样时将三角瓶内发酵液全部倒入离心管中,10 000 r/min,离心10 min,再将全部上清液保存至50 mL离心管中,备用。采用钼蓝比色法[15]测定上清液中磷的含量,同时测定上清液pH。
2)有机酸种类的测定:试验步骤同1.2.2 1)~3),氮源为硫酸铵,设置2个处理:CK(等量灭活HB1菌液)、HB1(等量含HB1的孢子菌液),每个处理设3次重复。在培养72 h后,将三角瓶中发酵液全部倒入离心管中,10 000 r/min,离心10 min。用10 mL的注射器取2 mL上清液,过0.22 μm滤膜后,通过HPLC-MS来测定上清液中有机酸的种类[17]。
1.3.3 土壤培养试验
分别在加入孢子菌悬液后第1、3、5、7、10、14、21、37天随机取3份土样,用打孔器取部分土壤用于测定菌株定殖情况,剩下的土壤风干过1 mm筛后用于测定土壤pH及有效磷含量。
菌株的定殖情况测定采用稀释平板法[18-20]:取1 g新鲜土壤溶于10 mL无菌水(含0.01%吐温80)中,振荡4 min后静置1 min,做105倍的浓度梯度稀释,取100L的1×105稀释梯度液涂布于PDA固体培养基(含100g/mL氯霉素,100g/mL卡那霉素,100g/mL链霉素),涂6个板。置于30 ℃培养箱中培养3 d,每天观察菌落形态并计数。
土壤pH值、有效磷含量采用常规方法测定[15]。
1.4 数据分析
采用Excel 2007和SPSS 17.0软件进行数据分析及单因素方差分析。
2 结果与分析
2.1 草酸青霉菌HB1溶磷能力的初步鉴定
试验结果显示,草酸青霉菌HB1在这4种难溶性磷源的固体培养基上均生长良好(图1),其溶磷圈和菌落直径测定结果如表2所示。
供试磷源为磷酸钙时,HB1菌培养8 d时其溶磷圈和菌落直径分别比第3天时极显著增加了199%和236%(<0.05),其溶磷圈直径/菌落直径为1.10~1.23;磷矿粉为磷源时,HB1菌培养8 d时其溶磷圈和菌落直径分别比第3 天时极显著增加了184%和234%(<0.05),其溶磷圈直径/菌落直径的范围为1.01~1.22;磷酸铁为磷源时,HB1菌培养8 d时其溶磷圈和菌落直径分别比第3天时极显著增加了114%和125%(<0.05),其溶磷圈直径/菌落直径为1.03~1.09;磷酸铝为磷源时,HB1菌培养8 d时其溶磷圈和菌落直径分别比第3天时极显著增加了85%和93%(<0.05),溶磷圈直径/菌落直径为1.03~1.07。同时,在3~8 d的培养时间内,HB1在含有磷酸钙的固体培养基上其菌落直径和溶磷圈直径/菌落直径均显著高于磷矿粉、磷酸铁、磷酸铝(<0.05)(表2)。综上,按其溶磷圈直径/菌落直径初步鉴定HB1溶解磷酸钙中磷的能力较大。

表2 草酸青霉菌HB1在固体培养基上的溶磷能力初步鉴定
注:表中不同的小写字母代表相同培养时间内不同磷源条件下其溶磷圈直径、菌落直径、溶磷圈直径:菌落直径差异显著性比较(<0.05)。
Note: Different lowercase letters indicate significant differences between phosphate solubilizing zone, bacterial colony, the ratio of phosphate solubilizing zone and bacterial colony at the same time (< 0.05) .

图1 草酸青霉菌HB1在4种难溶性磷源固体培养基上的生长情况
2.2 草酸青霉菌HB1对4种难溶性磷源的溶磷能力
2.2.1 草酸青霉菌HB1溶解磷酸钙的能力
1)溶磷能力
在液体培养条件下对HB1溶解磷酸钙的能力进行了分析,结果表明,与CK(无菌水)、灭活菌液相比,接种HB1孢子菌悬液其发酵液中有效磷含量均显著增加(图2)。
NH4+-N为氮源条件下(图2a),接种HB1菌的发酵液中有效磷含量在132 h达到最大值,为884 mg/L;相同培养时间内,HB1发酵液中有效磷含量均显著高于对照和HB1灭活菌液(<0.05),分别增高了19.29%和20.92%、68.39%和61.07%、69.47%和61.01%。
NO3--N为氮源时(图2b),接种HB1菌的发酵液有效磷含量在144 h达到最大值,为945 mg/L;相同培养时间内,HB1发酵液中有效磷含量均显著高于对照和灭活菌液(<0.05),分别增高68.15%和71.32%、76.96%和64.27%、85.91%和76.14%。
2种氮源对HB1溶解磷酸钙的能力影响不显著(图 2)。
2)HB1溶解磷酸钙的作用机制
分别以硫酸铵、硝酸钠为氮源,接种草酸青霉菌HB1,测定了各处理培养液pH值的变化(各处理培养前pH调到7.0)(表3)和分析了HB1发酵液中是否存在有机酸。结果发现,HB1在难溶性磷酸钙作为磷源的情况下,培养72 h后发酵液中没有检测到有机酸,以下其他难溶性磷源存在相同的情况。供应NH4+-N时,培养72 、108 和132 h后,HB1发酵液的pH值显著降低(<0.05),分别比对照和HB1灭活菌液降低了12.89%和7.27%、18.95%和14.19%、17.77%和11.65%,且培养液pH值与有效磷含量之间存在极显著负相关关系(=―0.89**,=27);供应NO3--N时,培养84 、120 和144 h,接种HB1菌后溶液的pH值分别比无菌水对照降低了2.97%、3.15%和3.18%,差异显著(<0.05),但与灭活菌液相比差异不显著(>0.05),且无菌水对照与HB1处理发酵液pH值和有效磷含量之间呈显著的负相关(=-0.83**,=18)。这说明无论是供应NH4+-N还是NO3--N,接种HB1菌后,其在生长和发育过程中分泌氢质子,从而使发酵液pH降低,低pH促进了培养液中磷酸钙的溶解与磷的释放,即溶磷能力增强。

注:不同小写字母表示同时间不同处理间的差异显著(P<0.05),下同。
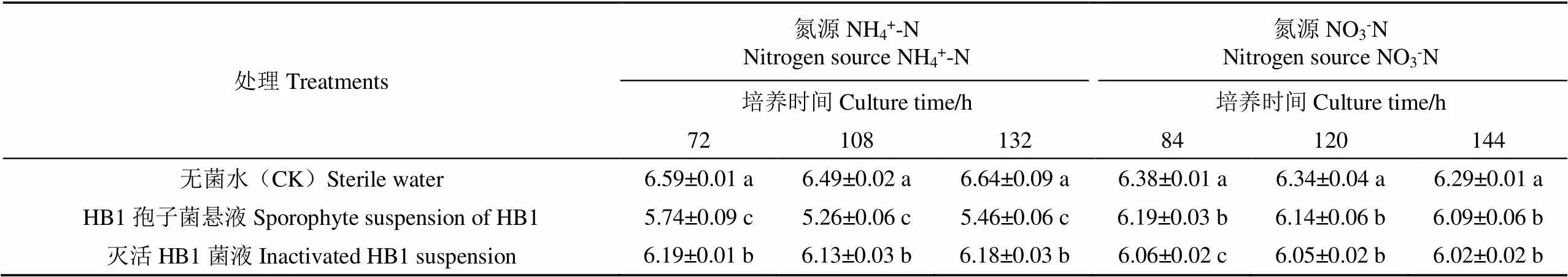
表3 磷酸钙为磷源时各处理培养液中pH值的变化
注:同列数据后不同小写字母表示不同处理间差异显著(<0.05),下同。
Note: Different lowercase letters in the same column showed significant differences among different treatments (< 0.05), the same below.
2.2.2 草酸青霉菌HB1溶解磷矿粉的能力
1)溶磷能力
供试菌株草酸青霉HB1在以磷矿粉为唯一磷源的液体培养基中生长,能够有效溶解、转化磷矿粉中的难溶态磷为自身所用(图3)。
供试氮源为NH4+-N时(图3a),接种HB1菌的发酵液中有效磷含量在132 h达到最大值199 mg/L。相同培养时间内,接种HB1菌的发酵液有效磷含量均显著高于对照和灭活菌液(<0.05),分别增加了77.63和42.68、350和98.01倍、189和900倍。
供试氮源为NO3--N时(图3b),HB1菌的发酵液有效磷含量在144 h达到最大值27.86 mg/L。相同培养时间内,接种HB1菌的发酵液有效磷含量均显著高于对照和灭活菌液(<0.05),分别增加了23.07和9.95倍、52.18和12.23倍、161和12.02倍。
在两种氮源条件下,HB1均能不同程度地溶解磷矿粉,但氮源为铵态氮条件下HB1的溶磷能力要显著高于硝态氮,前者为后者的7.14倍(<0.01)。
2)HB1溶解磷矿粉的作用机制
供应NH4+-N时,培养72 、108和132 h,接种HB1菌后溶液的pH值分别比对照和灭活菌液降低了32.19%和30.12%、35.24%和34.37%、36.04%和35.35%,差异显著(<0.05);供应NO3--N时,培养84、120和144 h,接种HB1菌后溶液的pH值分别比对照和灭活菌液降低了20.00%和18.87%、21.18%和19.30%、21.48%和19.61%,差异显著(<0.05)。此外,在培养后期供应铵态氮使生长介质pH下降的幅度大于硝态氮供应(表 4)。

表4 磷源为磷矿粉时各处理液体培养基中pH值的变化

图3 草酸青霉菌HB1溶解磷矿粉的能力
同时,供应NH4+-N时或供应NO3--N时,3个处理的培养液pH值与其有效磷含量之间均存在极显著负相关关系(=-0.89**,=27;=-0.95**,=27)。这说明在磷矿粉为供应磷源的情况下,HB1菌在生长繁殖过程中可分泌氢质子使生长介质中的pH降低,通过酸解作用将磷矿粉中的磷释放出来。
2.2.3 草酸青霉菌HB1溶解磷酸铁的能力
1)溶磷能力
在中国南方,大部分土壤的pH都较低,土壤中的有效磷多被Fe、Al等金属离子吸附固定,以铁铝磷酸盐的形式存在。因此,针对此类现象,探究了HB1菌对磷酸铁的溶解能力(图4)。
结果表明,供应NH4+-N时(图4a),在72 h接种HB1菌的发酵液中有效磷含量达到最高,为265 mg/L,比132 h的有效磷含量高出46.96%,差异达到显著水平(<0.05)。在相同培养期间内,接种HB1菌的发酵液有效磷含量分别高于对照和灭活菌液2.56和2.01倍、1.97和2.49倍、1.84和2.32倍,差异显著(<0.05);供应NO3--N时(图4b),HB1菌的发酵液有效磷含量在84 h达到最高,为206 mg/L,比120 h显著高出11.61%(<0.05)。在相同培养期间内,接种HB1菌处理的有效磷含量分别高于对照和灭活菌液1.78和1.25倍、1.82和2.00倍、1.84和1.80倍,差异显著(<0.05)。

图4 草酸青霉菌HB1溶解磷酸铁的能力
2种氮源对HB1溶解磷酸铁的能力影响不显著。
2)HB1溶解磷酸铁的作用机制
供应NH4+-N时,培养72、108和132 h,接种HB1菌后溶液的pH值最低(3.05~3.60)分别比对照和灭活菌液显著降低33.55%和27.38%、21.92%和17.19%、2.41%和14.89%(<0.05);供应NO3--N时,培养84、120和144 h,接种HB1菌后溶液的pH值最高(5.51~5.75),分别比对照和灭活菌液显著升高了21.63%和33.09%、25.95%和35.99%、25.82%和38.55%(<0.05)。这是因为加纯水处理的培养液初始培养液pH 7.0,培养3 d后培养液pH降为4.38~4.59,说明磷酸铁在溶解过程中,该矿物中包裹的H+得以释放(表5)。
供应NH4+-N时,对照、接种HB1菌、HB1灭活菌液3个处理培养液pH值与其有效磷含量之间存在极显著负相关关系(=-0.85**,=27),这与HB1分泌氢质子溶解磷酸钙的作用机制相同;然而,供应NO3--N时,3个处理的发酵液pH值和有效磷含量之间存在显著的正相关关系(=0.93**,=27),这与磷酸钙为磷源的趋势不同,分析原因是HB1吸收硝态氮后释放出OH-,与没有接菌的处理相比一定程度上升高了培养液pH,且菌的活性越强,吸收的硝态氮就越多,pH提升的幅度就越大,溶解磷酸铁的能力就越强,从而发酵液中有效磷含量就越高。

表5 磷源为磷酸铁时各处理液体培养基中pH值的变化
2.2.4 草酸青霉菌HB1溶解磷酸铝的能力
1)溶磷能力
供试氮源为NH4+-N时(图5a),相同培养时间内,接种HB1菌的发酵液有效磷含量均显著高于对照和灭活菌液(<0.05),分别增加了2.10和3.87倍、2.17和4.00倍、2.06和3.69倍。供试氮源为NO3--N时(图 5b),相同培养时间内,接种HB1菌的发酵液有效磷含量均显著高于对照和灭活菌液(<0.05),分别增加了3.69和8.01倍、4.07和3.89倍、3.99和6.84倍。
HB1溶解磷酸铝的能力在NO3--N条件下大于NH4+-N条件下(<0.01),有效磷含量最大为120 mg/L,前者为后者的3.29倍。由此可见,当磷源为磷酸铝时,最适宜的供试氮源为硝态氮。
2)HB1溶解磷酸铝的作用机制
供应NH4+-N时,培养72、108和132 h,接种HB1菌后溶液的pH值分别比对照和灭活菌处理降低43.26%和38.02%、42.65%和35.83%、40.73%和32.22%,差异均显著(<0.05);供应NO3--N时,培养84、120和144 h,接种HB1菌后溶液的pH值分别比对照和灭活菌处理降低了22.14%和16.17%、23.99%和18.57%、23.22%和17.06%,差异显著(<0.05)(表6)。
供应NH4+-N或供应NO3--N时,3个处理的培养液pH值与其有效磷含量之间均存在极显著负相关关系(=-0.84**,=27;=-0.88**,=27),说明HB1菌也是通过“酸解”作用来促进磷酸铝溶解的,从而获取自身生长和繁殖所需要的磷素。

图5 草酸青霉菌HB1溶解磷酸铝的能力

表6 磷源为磷酸铝时各处理液体培养基中pH值的变化
2.3 草酸青霉菌HB1在高、低2种磷水平土壤中的溶磷能力研究
为了进一步明确草酸青霉菌HB1溶磷的能力,研究了HB1在高磷和低磷土壤中的定殖情况及其活化土壤磷的能力。
2.3.1 草酸青霉菌HB1在土壤中的定殖情况
菌株在土壤中的定殖情况直接影响着菌株在土壤中发挥溶磷作用,其中溶磷菌能否在作物根际土壤成功定殖至关重要[21-22]。一般而言,溶磷菌株在土壤中的定殖能力越强,代谢分泌物越多,其功能就越显著。菌株在土壤中的定殖能力是衡量菌株溶磷能力的一种有效方法[23]。因此,本研究采用了平板计数法来探究草酸青霉菌HB1在不同磷水平土壤中的定殖情况,将菌株HB1接种到两种不同有效磷水平土壤中,结果表明菌株HB1在土壤中均能很好的定殖(图6)。
在低磷土壤中(图6a),培养到第3 d时,HB1菌的菌落数达到最大,为1.30×108cfu/g,是初始菌落数的9.77倍,之后开始逐渐下降,到第37天时,菌落基本全部消亡。
在高磷土壤中(图6b),HB1菌接入土壤后的第一天菌落数迅速增加,达到1.60×108cfu/g,是初始菌落数的12.03倍。虽然在之后的培养时间内菌落数开始呈下降的趋势,在第37天时菌落数达到最低值,但其仍旧高于初始菌落数,为初始菌落数的1.19倍。
综上所述,说明HB1菌均可很好的在低磷土壤和高磷土壤中定殖。

图6 草酸青霉菌HB1在土壤中的定殖情况
2.3.2 草酸青霉菌HB1对土壤有效磷含量变化的影响
从图7可以看出,在2种磷水平土壤中,与对照相比,接种菌株HB1的土壤速效磷含量随着培养时间的增加均呈升高趋势,说明草酸青霉菌HB1具有较好的溶磷效果。
低磷土壤中(图7a),接种HB1菌的土壤速效磷含量在培养第10天时达到最大值。在培养3~21 d内,比对照增加了17.44%~45.00%,差异显著(<0.05),溶磷效果明显;在培养第37 d时土壤速效磷含量比对照增加了14.28%,但差异不显著(>0.05)。高磷土壤中(图 7b),从培养的第一天开始,接种HB1菌土壤的速效磷含量高于对照,比对照增加了0.96%~14.17%。
同时在整个培养期间,无论是低磷土还是高磷土中,对照处理土壤中速效磷含量也有一定增加,这是因为土壤微生物系中也有一定的溶磷菌在发挥作用。

注:不同小写字母表示不同处理间差异显著(<0.05)。
Note: Different lowercase letters showed significant differences among different treatments (< 0.05).
图7 草酸青霉菌HB1对土壤速效磷含量的影响
Fig. 7 Effects ofHB1 on the content of available P in soil
3 讨 论
平板解磷圈法是研究微生物解磷能力最常用的方法,溶磷圈直径、菌落直径及其溶磷圈直径/菌落直径是表征溶磷菌相对解磷能力的指标[10]。有研究报道,青霉菌属菌株在以磷酸钙为磷源的培养基上可良好生长,且具有较高的溶磷效果[24],其中草酸青霉菌P8在以磷酸钙为磷源的固体培养基上培养5 d时溶磷圈直径/菌落直径为1.26[25],草酸青霉菌P22、P29和P36在以磷酸钙为磷源的固体培养基上培养3 d时溶磷圈直径/菌落直径为1.22~1.29[7]。本研究草酸青霉菌HB1在以磷酸钙为磷源的固体培养基上培养3 d时溶磷圈直径/菌落直径为1.23,与前人研究相比HB1菌溶解磷酸钙的能力较好;另外,草酸青霉菌P36在固体平板上溶解磷矿粉的溶磷圈直径/菌落直径为1.00[7],而草酸青霉菌HB1溶解磷矿粉溶磷圈直径/菌落直径最大达到1.22,因此HB1菌溶解磷矿粉的能力也较好;范丙全[10]研究草酸青霉菌P8和Pn1时发现两株菌株在以磷酸铁为磷源的琼脂培养基上溶磷圈直径/菌落直径分别为1.07和1.08,HB1菌在以磷酸铁为供试磷源时其溶磷圈直径/菌落直径达到1.09,说明三个草酸青霉菌株对磷酸铁的溶解能力相似。
草酸青霉菌Mo-Po溶解磷酸钙的有效磷含量为64.87 mg/L[26],草酸青霉菌C’溶解磷酸钙的有效磷浓度最高达642 mg/L[27],本研究中,草酸青霉HB1菌在铵态氮和硝态氮条件下溶解磷酸钙的有效磷浓度分别达884 mg/L和945 mg/L。王光华等[24]发现供应铵态氮,青霉菌()P66培养72 h对磷矿粉的活化率达到40%左右;钟传青等[28]研究溶磷细菌()P17时发现,该菌在铵态氮的供应下可以较好地溶解磷矿粉而释放出磷。在本研究中,HB1菌也能够有效地溶解、转化磷矿粉中的难溶磷,而且在两种氮源条件下,接种HB1菌处理的有效磷含量分别与未接菌和灭活菌处理相比,差异均达到显著水平(<0.05),且在铵态氮条件下溶磷能力显著大于硝态氮(<0.01),其有效磷含量达到199 mg/L。这说明,草酸青霉菌HB1能够更好地利用铵态氮来提高自身的溶磷能力。而范丙全[10]研究青霉菌P8和Pn1溶解磷矿粉的过程中却发现,使用硝态氮时两株溶磷菌的溶磷能力高于铵态氮。由此说明草酸青霉不同溶磷菌株供应的氮源不同,从而导致其溶磷能力存在差异,因此,应用溶磷菌株时需找到其最佳的氮源供应条件。
一般而言,微生物的溶磷机制存在以下两种情况:一是微生物在代谢过程中通过呼吸作用和NH4+同化作用分泌氢质子,使其培养介质pH下降,导致磷酸盐溶解;二是微生物分泌的有机酸降低了pH值,与Ca2+、Al3+、Fe3+等离子结合,使难溶性磷酸盐溶解[29]。有大量研究表明溶磷菌在培养过程中pH与解磷量之间的变化呈显著相关关系[29-30]。本研究中,接种HB1菌后培养液中并未检测到主要有机酸的存在,但是发酵液中pH显著低于未接菌处理,这说明草酸青霉菌HB1主要是通过第一种溶磷机制来促进难溶性磷酸盐溶解并释放磷素的。当供试氮源为铵态氮,磷源为磷酸钙、磷矿粉、磷酸铁、磷酸铝,对照、HB1菌处理、灭活HB1菌3个处理的培养液中pH值与有效磷含量之间也均存在极显著负相关关系(=-0.89**、=-0.89**、=-0.85**、=-0.84**),这进一步说明HB1主要是通过第一种溶磷机制来促进难溶性磷酸盐的溶解并释放出磷素;当供试氮源为硝态氮,磷源为磷酸钙、磷矿粉、磷酸铝,与CK相比,接种HB1菌处理的pH值也均显著降低(<0.05),且pH值与有效磷含量之间也均存在极显著负相关关系(=-0.83**、=-0.95**、=-0.88**)。众所周知,微生物吸收NO3--N并不具有向外释放H+的能力,而是微生物协同吸收NO3--N和H+,所以使溶液中OH-数量增多,进一步导致培养液的pH值升高。当微生物吸收利用1 mol NO3-时,就会消耗掉等量的H+或释放出等量的OH-,使培养介质的pH升高[31]。因此,硝态氮供应条件下接种HB1菌的发酵液pH显著降低的原因是HB1菌吸收NO3--N和H+的同时并通过自身呼吸作用向外释放CO2,后者对pH的降低程度大于前者对pH升高的程度时就导致液体培养基pH降低,达到“酸解”释放磷的目的。此外,已有的研究也发现溶磷量与培养介质的pH之间并不总是呈负的相关性[32-33]。在本研究中也发现了这一点:当供试磷源为磷酸铁,氮源为硝态氮时,不仅接种HB1菌处理的pH值与对照和灭活菌处理相比显著升高(<0.05),而且3个处理的发酵液pH值和有效磷含量之间存在显著的正相关关系(=0.93**,=27)。分析原因发现,对照、HB1菌、灭活HB1处理的初始液体培养基pH 7.0,培养3 d后培养液pH分别降为4.47~4.57、5.51~5.75、4.14~4.15(表5),说明矿物态磷酸铁中含有一定量的氢,摇瓶培养一段时间后,磷酸铁在溶解过程中,该矿物中包裹的H+得以释放导致液体培养基的pH急剧降低,尤其是对照和灭活HB1处理。接种HB1菌的处理的液体培养基中pH降低幅度较小,其原因是因为HB1在生长和繁殖过程中需要吸收氮源来完成其生命周期,当生长介质中只有NO3--N时,HB1菌协同吸收硝态氮和氢质子,使培养基中OH-的浓度增加,中和了一部分因磷酸铁溶解释放出的H+所致,这也间接说明HB1保持了活性进而促进了磷的释放。
菌株在土壤中的定殖能力对其溶磷效果起着决定性作用[34]。溶磷棘孢青霉菌()Z32可以很好地在土壤中定殖,并在第21天时HB1溶磷菌株的活菌数高出初始数量的10倍[15]。草酸青霉菌HB1在两种土壤中展现出了不同的定殖趋势,其原因与土壤中有效磷含量的多少有极大的关系。低磷土壤中,有效磷含量低,接入的HB1菌需要溶解土壤中的难溶性磷源来供给自己的生长和繁殖需要,故出现培养时间在第3天时菌数增多的现象;而在高磷土壤中,有效磷含量充足,HB1菌可以直接吸收土壤中的有效磷来满足自己的生长需求。
4 结 论
1)固体平板培养初步鉴定草酸青霉菌HB1溶解难溶性磷酸盐溶解磷酸钙的溶磷能力较强,其溶磷圈直径/菌落直径为1.10~1.23。
2)供应NH4+-N和磷酸钙、磷矿粉、磷酸铁和磷酸铝时,HB1菌发酵液pH与有效磷含量之间存在极显著负相关关系,初步探明HB1菌的溶磷作用机制为在生长过程中增加培养基质中H+质子降低pH值,通过酸解达到溶磷的效果。
3)草酸青霉菌HB1可在土壤中定殖并表现出溶磷效果,其在低磷土壤中的溶磷效果要好于高磷土壤。
[1] Khan M S, Zaidi A, Ahemad M, et al. Plant growth promotion by phosphate solubilizing fungi-current perspective[J]. Archives of Agronomy and Soil Science, 2010, 56(1): 73-98.
[2] 滕泽栋,李敏,朱静,等. 解磷微生物对土壤磷资源利用影响的研究进展[J]. 土壤通报,2017,48(1):229-235. Teng Zhedong, Li Min, Zhu Jing, et al. Research advances in effect of phosphate-solubilizing microorganisms on soil phosphorus resource utilization[J]. Chinese Journal of Soil Science, 2017, 48(1): 229-235. (in Chinese with English abstract)
[3] 陈丹阳,李汉全,张炳火,等. 两株解磷细菌的解磷活性及作用机制研究[J]. 中国生态农业学报,2017,25(3):410-418. Chen Danyang, Zhang Hanquan, Zhang Binghuo, et al. Phosphate solubilization activities and action mechanisms of two phosphate-solubilizing bacteria[J]. Chinese Journal of Eco-Agriculture, 2017, 25(3): 410-418. (in Chinese with English abstract)
[4] 卫星,徐鲁荣,张丹,等. 一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J]. 环境科学学报,2015,35(7):2052-2058. Wei Xing, Xu Lurong, Zhang Dan, et al. Phosphate solubilizing characteristics of a nitrate-tolerting bacterium,[J]Acta Scientiae Circumstantiae, 2015, 35(7): 2052-2058. (in Chinese with English abstract)
[5] Ziadi N, Whalen J K, Messiga A J, et al. Assessment and modeling of soil available phosphorus in sustainable cropping systems[J]. Advances in Agronomy, 2013, 122: 85-126.
[6] 张英,芦光新,谢永丽,等. 溶磷菌分泌有机酸与溶磷能力相关性研究[J]. 草地学报,2015,23(5):1033-1038. Zhang Ying, Lu Guangxin, Xie Yongli, et al. The relationship between organic acid secreted from phosphorus-solubilizing bacteria and the phosphate-solubilizing ability[J]. Acta Agrestia Sinica, 2015, 23(5): 1033-1038. (in Chinese with English abstract)
[7] 史发超. 高效溶磷真菌的筛选鉴定及溶磷促生效果研究[D].北京:中国农业科学院,2014. Shi Fachao. Screening, Identification of P-dissolving Fungus and Effects on Phosphate Solubilization and Plant Growth Promotion[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2014. (in Chinese with English abstract)
[8] 杨顺,杨婷,林斌,等. 两株溶磷真菌的筛选、鉴定及溶磷效果的评价[J]微生物学报,2018,58(2):264-273. Yang Shun, Yang Ting, Lin Bin, et al. Isolation and evaluation of two phosphate-dissolving fungi[J]. Acta Microbiologica Sinica, 2018, 58(2): 264-273. (in Chinese with English abstract)
[9] 钟传青. 解磷微生物溶解磷矿粉和土壤难溶磷的特性及其溶磷方式研究[D]. 南京:南京农业大学,2004. Zhong Chuanqing. Studies on Solubiling Effects on Phosphate Rock Powder and Insoluble Phosphorus in Soil of P-solubiling Microorganisms and Their Mechanism[D]. Nanjing: Nanjing Agricultural University, 2004. (in Chinese with English abstract)
[10] 范丙全. 北方石灰性土壤中青霉菌P8()活化难溶磷的作用和机理研究[D]. 北京:中国农业科学院,2001. Fan Bingquan. Study on Effects and Mechanisms ofm on Solubilization of Insoluble Phosphate from Calcareous Soils in North China[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2001. (in Chinese with English abstract)
[11] Whitelaw M A, Harden T J, Hel yar K R. Phosphate solubilisation in solution culture by the soil fungus[J]. Soil Biology and Biochemistry, 1999, 31(5): 655-665.
[12] Reddy M S, Kumar S, Babi ta K, et al. Bio solubilization of poorly soluble rock phosphates byand[J]. Bioresource Technology, 2002, 84(2): 187-189.
[13] 赵小蓉,林启美,李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报,2002,42(2):236-241. Zhao Xiaorong, Lin Qimei, Li Baoguo. The solubilization of four insolube phosphates by some microorganisms[J]. Acta Microbiologica Sinica, 2002, 42(2): 236-241. (in Chinese with English abstract)
[14] 耿丽平,陆秀君,赵全利,等. 草酸青霉菌产酶条件优化及其秸秆腐解能力[J]. 农业工程学报,2014,30(3):170-179. Geng Liping, Lu Xiujun, Zhao Quanli, et al. Optimization of enzyme-production conditions ofm and its ability for decomposition of stalks[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(3): 170-179. (in Chinese with English abstract)
[15] 鲍士旦. 土壤农化分析[M]. 第三版. 北京:中国农业出版社,2007.
[16] 龚明波,范丙全,王洪媛. 一株新的溶磷棘孢青霉菌Z32的分离、鉴定及其土壤定殖与溶磷特性[J]. 微生物学报,2010,50(5):580-585. Gong Mingbo, Fan Bingquan, Wang Hongyuan. Isolation and identification of a novel phosphate-dissolving strainZ32 and its colonization and phosphate-dissolving characteristics in soil[J]. Acta Microbiologica Sinica, 2010, 50(5): 580-585. (in Chinese with English abstract)
[17] 孙宝利,赤杰,范中南,等. 土壤及植物复合体中有机酸的测定[J]. 环境科学与技术,2010,33(9):130-134. Sun Baoli, Chi Jie, Fan Zhongnan, et al. Determination of organic acids from integrated system of soil and plant[J]. Environmental Science and Technology, 2010, 33(9): 130-134. (in Chinese with English abstract)
[18] 张洁. 小麦孢囊线虫病的生防微生物鉴定及球孢白僵菌08F04菌株对土壤微生物多样性的影响[D]. 郑州:河南农业大学,2016. Zhang Jie. Identification of Biocontrol Microorganism of Cereal Cyst Nematode and the Influence of Strain 08F04 of Beauveria Bassiana on Soil Microbial Diversity[D]. Zhengzhou: Henan Agricultural University, 2016. (in Chinese with English abstract)
[19] 张磊,范丙全,黄为一. 绿色荧光蛋白和潮霉素抗性双标记载体转化草酸青霉菌P8的研究[J]. 微生物学报,2005,45(6): 842-845.Zhang Lei, Fan Bingquan, Huang Weiyi. Study on transformation of P-dissolvingP8 with double-marker vector expressing green fluorescent protein and hygromycin B resistance[J]. Acta Microbiologica Sinica, 2005, 45(6): 842-845. (in Chinese with English abstract)
[20] 林先贵. 土壤微生物研究原理与方法[M]. 北京:高等教育出版社,2010.
[21] Lugtenberg B J, Dekkers L, Bloemberg G V. Molecular determinants of rhizosphere colonization by Pseudomonas[J]. Annual Review of Phytopathology, 2001, 39(1): 461-490.
[22] Mamta R P, Rahi P, Pathania V. Stimulatory effect of phosphate-solubilizing bacteria on plant growth, stevioside and rebaudioside: A contents ofBertoni[J]. Applied Soil Ecology, 2010, 46(2): 222-229.
[23] 龚明波. 溶磷微生物分离、应用及其相关基因的克隆与功能鉴定[D]. 北京:中国农业科学院,2011. Gong Mingbo. Screening and Application of Phosphate-dissolving Strains and Its Gene Cloning and Identification[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. (in Chinese with English abstract)
[24] 王光华,周克琴,金剑,等. 黑土区高效溶磷真菌筛选及其溶解磷矿粉效果的研究[J]. 中国生态农业学报,2004,12(3):143-145. Wang Guanghua, Zhou Keqin, Jin Jian, et al. Choose of phosphate-solubilizing fungal strains with high efficiency in black soil[J]. Chinese Journal of Eco-Agriculture, 2004, 12(3): 143-145. (in Chinese with English abstract)
[25] 范丙全,金继运,葛诚. 溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J]. 中国农业科学,2002,35(5):525-530. Fan Bingquan, Jin Jiyun, Ge Cheng. Isolation ofand its effect on solubilization of insoluble phosphate under different conditions[J]. Scientia Agricultura Sinica, 2002, 35(5): 525-530. (in Chinese with English abstract)
[26] 陈明会,莫明和,马莉,等. 滇池富磷区土壤中溶磷真菌的筛选及其对油菜的促生作用[J]. 农业工程学报,2012,28(增刊1):209-215. Chen Minghui, Mo Minghe, Ma Li, et al. Screening of phosphate-solubilizing fungi from phosphate-rich soils in Dianchi and its effect on growth promoting in[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(Supp.1): 209-215. (in Chinese with English abstract)
[27] 王莉晶. 高效解磷菌的筛选及其对小麦生长的影响[D]. 大连:大连理工大学,2008. Wang Lijing. The Screening of Phosphorus Strains and Its Influence on Wheats[D]. Dalian: Dalian University of Technology, 2008. (in Chinese with English abstract)
[28] 钟传青,黄为一. 磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J]. 土壤学报,2004,41(6):931-937. Zhong Chuanqing, Huang Weiyi. Effects and mechanism of P-solubilizingP17 strain on phosphorus solubilization of different phosphate rocks[J]. Acta Pedologica Sinica, 2004, 41(6): 931-937. (in Chinese with English abstract)
[29] 李豆豆,尚双华,韩巍,等.一株高效解磷真菌新菌株的筛选鉴定及解磷特性[J].应用生态学报,2019,30(7):2384-2392. Li Doudou, Shang Shuanghua, Han Wei, et al. Screening, identification of a new efficient phosphate solubilizing fungus and its phosphate solubilizing characteristics[J]. Chinese Journal of Applied Ecology, 2019, 30(7): 2384-2392. (in Chinese with English abstract)
[30] 赵小蓉,林启美,李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志,2003,23(3):5-7.Zhao Xiaorong, Lin Qimei, Li Baoguo. The relationship between rock phosphate solubilization and pH and organic acid production of microorganisms[J]. Journal of Micbobiology, 2003, 23(3): 5-7. (in Chinese with English abstract)
[31] 尹逊霄,华珞,张振贤,等. 土壤中磷素的有效性及其循环转化机制研究[J]. 首都师范大学学报:自然科学版,2005,26(3): 95-101. Yin Xunxiao, Hua Luo, Zhang Zhenxian, et al. Study on the effectiveness of phosphorus and mechanism of its circle in soil[J]. Journal of Capital Normal University (Natural Science Edition), 2005, 26(3): 95-101. (in Chinese with English abstract)
[32] Narsian V, Patel H H. Aspergillus aculeatus as a rock phosphate solubilizer[J]. Soil Biology & Biochemistry, 2000, 32(4): 559-565.
[33] Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J]. Soil Biology & Biochemistry, 1992, 24(4): 389-395.
[34] 虞伟斌. 解磷菌K3的溶磷特性及其在不同土壤中定殖研究[D]. 南京:南京农业大学,2010. Yu Weibin. Characterization of Phosphate-solubilizing Bacterium K3and Colonization under Different Soil[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese with English abstract)
Ability and mechanism ofHB1 solubilizing phosphates
He Di1, Geng Liping1, Guo Jia1, Lu Xiujun2, Liu Wenju1※, Li Bowen1
(1.,,,,071001,; 2.,,071001,)
We all know that some functional microorganisms can dissolve insoluble phosphates and it is different from the abilities of the same strain mobilizes different phosphates. The experiments of plate cultivation and shaking culture were carried out to explore the abilities and mechanisms ofHB1 to mobilize different insoluble phosphates (Ca3(PO4)2, phosphate rock powder, FePO4, AlPO4) when different forms of nitrogen (NH4+-N, NO3--N) were supplied in the growth medium. Furthermore, a soil incubation experiment was conducted to verify the capacity of HB1 solubilizing insoluble phosphate in two types of soils with low and high levels of available phosphorus. The results of plate cultivation showed that phosphate dissolving zone was observed on each plate with different phosphates of Ca3(PO4)2, phosphate rock powder, FePO4and AlPO4. The calculated ratios of phosphate solubilizing zone and bacterial colony followed the trends of Ca3(PO4)2> phosphate rock powder > FePO4> AlPO4,which indicated that the ability of HB1 to dissolve Ca3(PO4)2was better than others. In order to prove the abilities of HB1 mobilizing different insoluble phosphates further, the shaking cultural experiment was set up and the results clarified that the phosphate solubilizing capacity of HB1 varied with different mineral phosphates and two different forms of nitrogen in growth mediums. When Ca3(PO4)2or FePO4was supplied, the concentrations of phosphorus (P) in the nutrient solution with HB1 were 884 mg/L or 265 mg/L on the condition of NH4+-N, and 945 mg/L or 206 mg/L with NO3--N addition, respectively. However, there was no significant difference in P concentrations of solution between NH4+-N or NO3--N addition. Meanwhile, HB1 enhanced phosphorus released from Ca3(PO4)2markedly compared withFePO4, which illustrated that P concentrations in solution with HB1 and Ca3(PO4)2were 2.34-3.59 folds higher than those of FePO4in the growth medium. Moreover, when phosphate rock powder and NH4+-N supplied, the concentration of phosphorus in the solution with HB1 was 199 mg/L, which was 7.14 times of that of NO3--N situation. However, the concentration of phosphorus in the nutrient solution with HB1 was 120 mg/L when AlPO4and NO3--N applied, which was 3.29 times of that of NH4+-N. Therefore, shaking cultural experiment demonstrated thatHB1 dissolved the P from different insoluble phosphates indeed and the rank of P mobilizing ability followed Ca3(PO4)2> phosphate rock powder and FePO4> AlPO4when NH4+-N supplied in growth medium, whereas followed Ca3(PO4)2> FePO4> AlPO4> phosphate rock powder when NO3--N applied. It suggested that different N forms in growth medium did not affect the ability of HB1 dissolving P from Ca3(PO4)2and FePO4, but influence this ability for AlPO4and phosphate rock powder. NH4+-N is better for HB1 to mobilize phosphate rock powder, and NO3--N applied is a benefit for HB1 to dissolve AlPO4. Furthermore, there were significant negative relationships between P levels and pH in growth medium with NH4+-N, which indicated the possible mechanisms thatHB1 could exudate H+to the solution, then decreased pH in the growth medium, and finally enhanced the releases of P from different insoluble phosphates. The ability of HB1 dissolving insoluble P was proved in the experiment of soil incubation as well. The results showed that concentrations of available phosphorus in HB1 treatments increased by 45.00% and 14.17% in low-phosphorus soil and high-phosphorus soil after incubation for 21 days, respectively. In summary, HB1 had the strongest phosphate-dissolving capacity for Ca3(PO4)2, followed by FePO4andphosphate rock powder when NH4+-N addition, which was dissolved through H+exudate byHB1. It would be a better pathway to use HB1 mobilizing insoluble phosphate in soils with low available phosphorus.
phosphorus; soils; bacteria; insoluble phosphate; soil colonization;HB1
何 迪,耿丽平,郭 佳,陆秀君,刘文菊,李博文. 草酸青霉菌HB1溶磷能力及作用机制[J]. 农业工程学报,2020,36(2):255-265. doi:10.11975/j.issn.1002-6819.2020.02.030 http://www.tcsae.org
He Di, Geng Liping, Guo Jia, Lu Xiujun, Liu Wenju, Li Bowen. Ability and mechanism ofHB1 solubilizing phosphates[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(2): 255-265. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.02.030 http://www.tcsae.org
2019-08-01
2019-12-25
河北省应用基础研究计划重点基础研究项目(17962902D);国家科技支撑计划(2015BAD23B01)
何迪,主要从事土壤环境质量研究。Email:hedinuannuan@163.com
刘文菊,博士生导师,教授,主要从事土壤环境质量研究。Email:liuwj@hebau.edu.cn
10.11975/j.issn.1002-6819.2020.02.030
S154.3
A
1002-6819(2020)-02-0255-11
